瑞士制药巨头诺华(Novartis)靶向药物Votubia(everolimus,依维莫司)近日在欧盟监管方面传来喜讯。欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布积极建议,支持批准Votubia分散片作为一种辅助药物,用于2岁及以上患者结节性硬化症(TSC)相关难治性癫痫部分性发作(有或无继发性全身性发作)的治疗。目前,尚无药物获批专门用于TSC相关难治性癫痫的治疗;如果Votubia获批,将解决该领域存在的未满足的医疗需求。
CHMP支持批准Votubia,是基于一项III期临床研究(EXIST-3)的疗效和安全性数据。该研究结果表明,与安慰剂相比,Votubia用作辅助药物时可显著减少结节性硬化症(TSC)相关难治性癫痫发作。相关数据已提交至近日召开的第68届美国神经学会(AAN)年会。
该研究中,366例伴有难治性癫痫发作的结节性硬化症(TSC)患者随机接受everolimus低暴露量(LE,3-7ng/mL,n=117)或高暴露量(HE,9-15ng/mL,n=130)或安慰剂(n=119)。数据显示,everolimus低暴露量组(29.3%,p=0.03,CI=95%)和高剂量组(39.6%,p<0.001,CI=95%)癫痫发作频率从基线的百分比降幅显著大于安慰剂组(14.9%,CI=95%)。此外,癫痫发作缓解率(≥50%减少)方面,everolimus低暴露量组(28.2%,p=0.008,CI=95%)和高暴露量组(40.0%,p<0.001,CI=95%)也显著大于安慰剂组(15.1%,CI=95%)。研究中,与安慰剂相比,everolimus LE/HE治疗最常见(≥20%)的不良事件(AEs)包括口腔炎(LE/HE vs 安慰剂=28.2%/30.8% vs 3.4%)、口腔溃疡(LE/HE vs 安慰剂=23.9%/21.5% vs 4.2%)、腹泻(LE/HE vs 安慰剂=17.1%/21.5% vs 5.0%)。严重不良事件发生率为13.7%/13.8% vs 2.5%。
结节性硬化症(TSC)是一种罕见遗传性疾病,影响全球约100万人;癫痫是TSC最常见的神经系统表现,约60%的患者对当前可用的抗癫痫药物治疗无缓解。everolimus是获批的唯一一种非手术治疗选择,适用于特定TSC患者治疗非癌性脑部和肾脏肿瘤。来自EXIST-3研究的数据显示,在TSC群体中,everolimus是首个可实现临床意义癫痫发作控制的辅助疗法。
everolimus(依维莫司)是一种靶向药物,通过靶向抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)发挥作用。mTOR是一种蛋白,可调节多种细胞的功能,是细胞分裂、血管生长、细胞代谢中的一种重要调节因子。
结节性硬化症(TSC)由TSC1或TSC2基因突变所致,导致mTOR信号通路的过度激活,导致细胞生长和增殖、神经元过度兴奋、大脑皮质结构和网络功能异常、突触可塑性受损。临床前研究表明,过度激活的mTOR活性可能影响癫痫发生(epileptogenesis,即大脑产生癫痫的渐进过程)的几种机制。
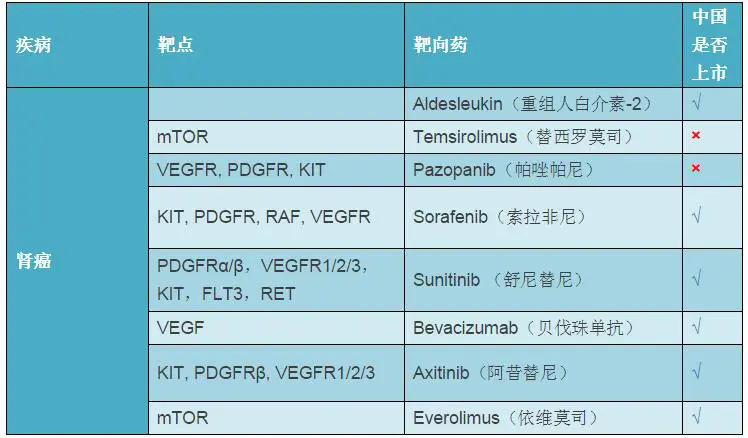
everolimus(依维莫司)在美国的商品名为Afinitor,在欧洲的商品名为Votubia。截至目前,该药已获批多个适应症,包括:(1)伴有肾血管肌脂肪瘤(renal angiomyolipoma)和结节性硬化症(TSC)但不需要立即开展手术治疗的成人患者;(2)TSC儿科及成人患者,用于治疗需要治疗干预但不能治愈性切除的室管膜下巨细胞星形细胞瘤(SEGA);(3)起源于胰腺的局部晚期、转移性或不可切除性进展性神经内分泌肿瘤(NET);(4)胃肠道或肺部起源的不可切除性、局部晚期或转移性、进展性、良好分化性非功能性NET;(5)VEGF治疗过程中或治疗后病情进展的晚期肾细胞癌(RCC);(6)联合依西美坦,治疗晚期HR+/HER2-乳腺癌。(生物谷Bioon.com)
原始出处:Novartis drug Votubia® recommended by CHMP for EU approval to treat refractory partial-onset seizures in patients with TSC
扫描上面二维码在移动端打开阅读