转化医学网
| 导读 |
循环肿瘤细胞检测对乳腺癌早期诊断和预后的临床意义
乐飚1, 宋毅1,严梅娣2,沈挺1,张晓晶1
1:宁波美晶医疗技术有限公司
2:宁波第七医院甲乳外科
临床统计结果显示,约有50%的乳腺癌患者会出现复发转移【1】,其中75%的转移性乳腺癌(Metastatic Breast Cancer: MBC)发生在初诊后的3~5年内。初诊时有腋淋巴结(axillary lymph node:ALN)阳性ALN≥4其远处转移率71.4%,阳性ALN<4时,远处转移率约为26.5%,ALN阴性患者者的远处转移率约为10%~30%[2]。MBC患者的OS期虽有存活10年以上的报道,但多数MBC患者在18~24个月死亡。其中骨转移的中位生存期2年,部分患者可达48个月,而内脏转移仅6个月。
目前循环肿瘤细胞CTCs(circulating tumor cells ),被认为与恶性肿瘤的复发、转移密切相关,对肿瘤的早期诊断、临床分期、复发转移和耐药监测、预后判断、开发新的治疗靶点具有重要价值。在针对乳腺癌,肺癌,前列腺癌和结肠直肠癌的临床试验中,对于良、恶性肿瘤的鉴别可提供较为确切的信息。
2015年NCCN【美国国家综合癌症网络(National Comprehensive Cancer Network】发布的乳腺癌诊疗指南指出Ⅳ期、转移复发乳腺癌的综合治疗可以延长生存期,重复活检和使用循环肿瘤标志物(如CTC,ctDNA等)的推荐来自临床经验和专家小组的非正式共识,但是其临床价值需要更多临床试验的验证。本文主要从CTCs的特性及其在乳腺癌转移性患者中的诊疗应用进行概述。
2. CTC与ctDNA检测技术的现状
分析血液中游离的肿瘤DNA(ctDNA)、考察血液中完整的肿瘤细胞(CTC)和收集由肿瘤细胞释放出的外泌体是目前液体活检技术的主要方向。(详见美晶医疗发表于转化医学网5月刊的“液体活检(循环肿瘤细胞)与医学影像学诊断的临床相关性”)。简而言之:CTC,ctDNA 和外泌体虽然都是液态活检的检测对象,但三者的用途不一,必须综合起来才能解决所有问题。比如:CTC 能提高诊疗的精确性,而ctDNA侧重于靶向用药和耐药性指导。外泌体目前还没有成熟的产品,但是外泌体稳定性强,且适用范围广。单一使用CTC 的临床意义将不断降低,CTC的价值将更多展现在与ctDNA 的综合应用,这样可以充分结合ctDNA 高灵敏度,以及CTC 高特异性,全息化的优势。未来,液态活检各种方式的联合使用将是大势所趋。
国外的CTC 检测公司大部分都有自己独立研发的检测平台或仪器,例如:Cynveniu公司的ClearID 微流体平台,Fluxion Biosciences 公司的基于微流体技术以及免疫磁珠的IsoFlux系统;ApoCell 公司的ApoStream®技术;国内的公司具有独立研发的CTC 检测仪器的公司并不多,包括丽珠集团旗下Cynvenio 公司的LiquidBiopsy 稀有细胞分离平台;宁波美晶医疗自主研发的CellRichTM循环肿瘤细胞检测系统及配套试剂等。(参照宁波美晶医疗官网:http://www.nanolitesystems.net或美晶医疗发表于转化医学网4月刊的“基于微芯片的自动化循环肿瘤细胞检测系统¾ CellRichTM新型液体活检平台”)
CellRich™系统主要用于检测血液中的循环肿瘤细胞,进行诊断和监控癌症病情发展。该系统已有8项发明专利获得授权,20多项实用新型和软件著作权授权。获得了2014年“国家重点新产品”称号。作为同类别中的首创产品,美晶医疗也牵头制定了相关医疗器械分类标准(分类编码6841)。目前,CellRich™系统已经在包括美国达特茅斯医学院及上海胸科医院在内的国内外多家知名医院投入使用。
在检验服务方面,为满足“精准医疗”对基因检测的需求,设立了美晶医学检验所,已获得卫生部颁发的医疗机构执业许可证书和临床PCR实验室资质。目前美晶医学检验所已开展临床细胞分子遗传学等检验服务,包括个性化用药基因检测,循环肿瘤细胞检测,疾病风险基因检测等多项业务。其中ctDNA系列检测服务包括: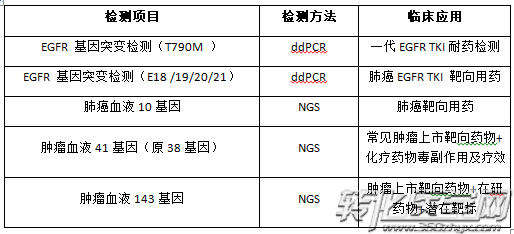 业务范围覆盖华东,华南地区,已在上海,杭州等地设立了区域营销中心。
业务范围覆盖华东,华南地区,已在上海,杭州等地设立了区域营销中心。
3. 对于转移性乳腺癌患者,CTC计数可提供较为确切的预后信息,并可作为PFS与OS相关的独立预测因素 【3】
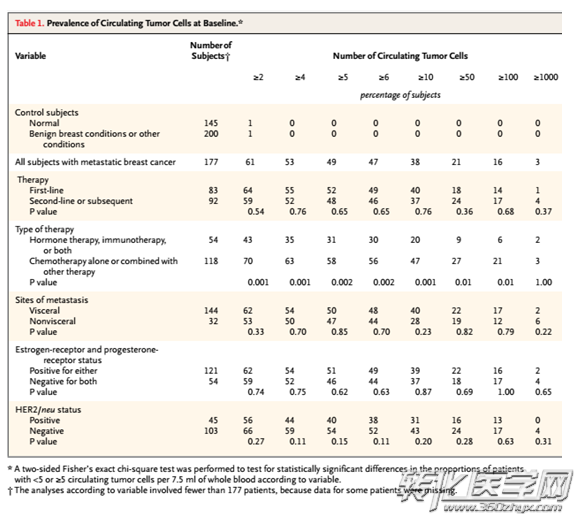
北京307医院江泽飞教授等在6家中国顶尖的癌症中心所招募的300例MBC患者,计划完成共3次CTC血样的采集以及接受两次影像学评估。结果显示:中国转移性乳腺癌患者,CTC计数可提供较为确切的预后信息,并可作为PFS与OS相关的独立预测因素,且与美国德州大学Cristofanilli M 团队,2008年在自然杂志发表的实验结论相吻合(使用Cellsearch系统,需采集7.5ml的血液样本,基线标准≥5 CTCs / 7.5ml外周血)
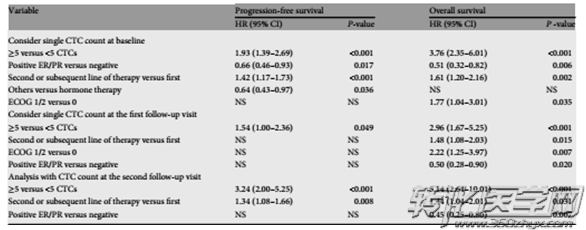
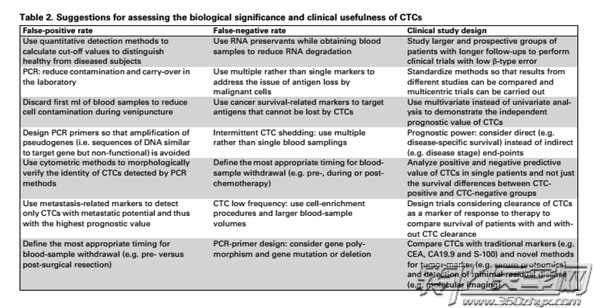
表1:CTC与MBC患者PFS或OS关联的多变量分析
近年来发表了大量的关于CTC与乳腺癌预后关联的文章,但是仍然难以得出一个比较可靠的结论,这是因为CTC检测方法、评判标准、研究对象以及临床分期等不同使这些报道无法比较。因此需要进行大规模的临床试验来验证CTC和乳腺癌患者的OS、PFS、DFS等之间的关系。
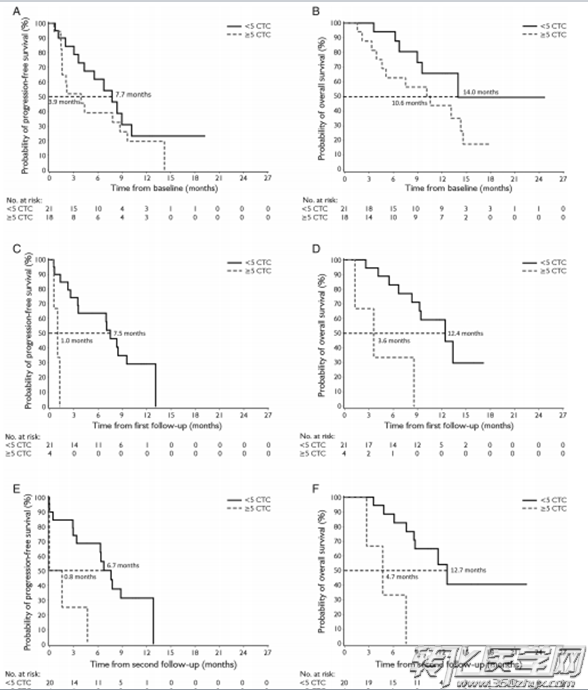
图1:CTC数量与患者PFS及OS的关联。检测时间节点:CTC与HER-2同时检测
4. 对于HER-2阳性在内的各亚型乳腺癌患者,无论治疗手段如何,CTC计数均具有预后价值。【3】
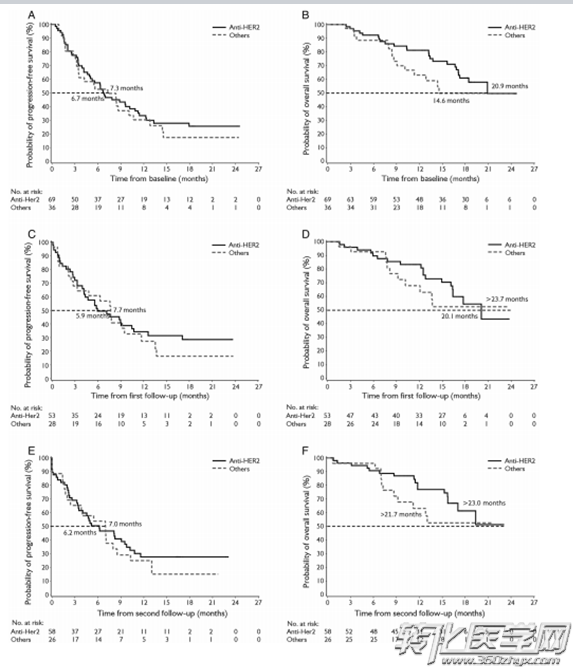
图2:治疗前后HER-2阳性表达与患者PFS及OS的关联
A,C,E(HER-2阳性率 VS PFS);B,D,F(HER-2阳性率 VS OS)
HER-2为人表皮生长因子受体-2。市场已有HER-2抑制型靶向药物与配套实施的HER-2检测套餐(通过iFISH或免疫组化平台检测组织样本中是否存在HER-2阳性蛋白或基因表达)。
5. CTC是乳腺癌的微转移(即肿瘤复发转移过程中)的必要条件 【4】
CTC进入循环系统后,可以单独或示意细胞簇的形态贴附在其他组织,以休眠状态潜伏其中,等待某种激活唤醒。一旦激活后便开始增殖或迁移到适宜的组织。研究提示,未能形成转移的关键因素在于休眠细胞未能得到适宜的激活,细胞因子、生长因子、激素和细胞外基质等微环境因素未参与到调节细胞的增殖,因此,在乳腺癌患者外周血中检测到的CTC预示有可能发生肿瘤转移,即CTC的出现是肿瘤复发转移过程中的必要条件。
7. 动态监测CTC的数量变化与患者预后的关联
为了探讨CTC检测在转移性乳腺癌(metastatic breast cancer,MBC)化疗疗效评价中的应用价值。【6,7】 2007年10月至2010年6月,苏州大学附属第一医院收治136例MBC患者,患者每3个化疗周期做一次CT检查,参照实体瘤评价标准(response evaluation criteria in solid tumors,RECIST)评价病情。评价当天采集7.5 mL外周血,应用膜滤过(isolation by size of epithelial tumor cells,ISET)结合激光扫描细胞术(laser scanning cytometry,LSC)检测CTC,CTC水平以肿瘤细胞检出数/7.5 mL血表示。结果显示:136例MBC患者共完成341次CTC检测,其中262例(76.8%)血液样本可检测到CTC,平均检出CTC数量为(6.73±4.92)个/7.5 mL样本。136例MBC患者治疗后达到完全或部分缓解43例(31.62%),稳定39例(28.67%),无效进展54例(39.71%)。患者病程中CTC数目的改变,与病情的进展显著相关,r=0.51483,P<0.01。化疗后CTC数目不变或下降的病例,预后较好,化疗后CTC数目上升的病例预后差。治疗前的CTC水平与疾病转归无明显相关性,x2=3.62,P=0.08215。结论 CTC检测可用于MBC患者化疗后疗效评价。
8. 三阴性乳腺癌患者CTC检测与患者预后的关联
8-1. 三阴性乳腺癌的临床病理特点及预后因素分析【8】
为了探讨三阴性乳腺癌患者的临床病理特点、分子生物学特性、生存率以及影响预后的因素,大连市肿瘤医院的张婕,李丽课题组回顾性分析了44例三阴性乳腺癌患者的病历资料,分析其临床病理特点、分子生物学指标和各种治疗方式对生存的影响。入组的44例女性患者的中位年龄49岁(35~82岁)。其中Ⅰ期患者6例(13.6%),Ⅱ期19例(43.2%),Ⅲ期17例(38.6%),Ⅳ期2例(4.5%)。核分级Ⅰ级6例(13.6%),Ⅱ级15例(34.1%),Ⅲ级23例(52.3%)。伴有脉管瘤栓22例(50%),伴有神经浸润10例(22.7%)。中位生存时间4.0年(1.5-8.5年)。结果显示:三阴性乳腺癌发病率较低,组织学分级较高,多为浸润性导管癌,易较早出现复发和转移。影响总生存的因素为肿瘤大小、淋巴结状态、临床分期、脉管瘤栓和神经浸润,其中影响预后的独立因素是肿瘤大小和淋巴结状态。 [6]3年总生存率为66.7%(29/44)。
8-2. TC与TE方案治疗三阴性乳腺癌的疗效比较
由于三阴性乳腺癌(TNBC)患者可能对铂更为敏感。北京肿瘤医院徐兵河课题组回顾分析了92例接受卡铂(TC)或表柔比星(TE)治疗(4-6个疗程以上)的局部晚期三阴性乳腺癌患者。以病理学完全缓解(pCR)率,临床缓解率和无复发生存期(RFS)为指标,分析比较铂类为基础的新辅助化疗与非铂方案治疗局部晚期三阴性乳腺癌患者的差异。结果显示:92例入组患者中TC治疗组43例,其余均为TE治疗组(49例)。TC治疗组的完全缓解优于TE治疗组 (37.2% VS 16.1%,P = 0.032)。两组间的临床缓解率相似(83.7% VS 87.8%,P=0.500)。中性粒细胞减少(TC:39.5%比TE:46.9%,P=0.399)和发热性中性粒细胞减少发生率无显著差异。周围神经病变常见,但不严重。TE组G3脱发比TC组更频繁。因随访时间所限,还没有进行RFS评估。研究表明,通过病理学完全缓解率发现,治疗局部晚期三阴性乳腺癌时,铂类为基础的新辅助化疗优于非铂类方案。但还有必要进行进一步的大规模前瞻性随机试验。
9. 结语
综上所述转移性乳腺癌患者外周血CTC临床辅助诊断具有重要的临床意义和应用前景,并已成为当前的研究热点。通过连续观察CTCs数量的变化情况,为监测肿瘤动态,早期发现/诊断肿瘤的复发转移,评估治疗效果或调整治疗方案,为个体化治疗提供全面,实时的信息与思路。但是CTCs检测的敏感性与特异性是限制其临床应用的主要因素,因此其临床价值需要更多临床试验的验证。
10. 参考文献:
[1]沈镇宙,邵志敏.现代乳腺肿瘤学进展[J].上海:上海科学技术文献出版社,2002, 209-225.
[2]赵丽娜,蔡莉.乳腺癌循环肿瘤细胞研究进展与展望[J].中华肿瘤防治杂志,2011,(22).
[3]Jiang ZF, Cristofanilli M et al.Circulating tumor cells predict progression- free and overall survival in Chinese patients with metastatic breast cancer, HER2-positive or triple-negative (CBCSG004): a multicenter, double-blind, prospective trial. Ann Oncol. 2013 Nov;24(11):2766-72.
[4]Belkacemi Y, Westenberg H; Breast Working Party of the EORTC Radiation Oncology Group (ROG).Patterns of practice of regional nodal irradiation in breast cancer: results of the European Organization for Research and Treatment of Cancer (EORTC) NOdal Radiotherapy (NORA) survey. Ann Oncol. 2015 Mar;26(3):529-35.
[5] Lee SH, Lee JK, Ahn MJ, Kim DW, Sun JM, Keam B, Kim TM, Heo DS, Ahn JS, Choi YL, Min HS, Jeon YK, Park K. Vandetanib in pretreated patients with advanced non-small cell lung cancer-harboring RET rearrangement: a phase II clinical trial. Ann Oncol. 2017 Feb 1;28(2):292-297.
[6] Cristofanilli M, Budd GT, Ellis MJ, Stopeck A, Matera J, Miller MC, Reuben JM, Doyle GV, Allard WJ, Terstappen LW, Hayes DF. Circulating tumor cells, disease progression, and survival in metastatic breast cancer. N Engl J Med. 2004 Aug 19;351(8):781-91.
[7] Mego M, De Giorgi U, Cristofanilli M. Characterization of metastatic breast cancer patients with nondetectable circulating tumor cells. Int J Cancer. 2011 Jul 15;129(2):417-23.
[8] 《中国肿瘤临床与康复》 2009年05期 张婕 李丽 (大连市肿瘤医院)
[9] 齐晓伟,姜军.乳腺癌循环肿瘤细胞检测方法的研究进展[J].中华肿瘤防治杂志,2010,(19).
作者简介:
乐飚博士:宁波美晶医疗技术有限公司研发总监。日本名古屋大学工学博士,12年日本肿瘤临床与研究经历,擅长基于纳米技术的肿瘤早期诊断与治疗的放射性医药品研发及分子诊断,曾获得2001年度,日本生物工学学会第一届优秀论文奖等荣誉,入选2012年度上海市浦江人才,主持重大科研项目5项,参与或协助主持科研项目数十项,发表多篇SCI论文。
宋毅:宁波美晶医疗技术有限公司基因检测服务部经理。浙江师范大学理学硕士,7年的临床基因检测工作经验,目前主要带领部门开展相关临床检测服务,及开发CTC下游基因检测项目。
严梅娣:宁波第七医院甲乳外科主任医师。从事普外科临床工作多年,对外科急危重病人的救治积累了丰富的经验,擅长甲状腺疾病和乳腺疾病的诊治及腹部腔镜手术。曾荣获“镇海区学榜样,讲奉献先进个人”、“镇海区首届十佳医卫工作者”等光荣称号。多项科研课题获厅局级、市区级立项,并有多篇论文在国家级及省级杂志上发表。
沈挺博士:宁波美晶医疗技术有限公司总经理,入选浙江省“千人计划”。作为主要项目及团队负责人开发的“新一代癌症血液检测生物芯片及系统”项目,获得了中国科技创业计划大赛项目组一等奖,中国首届创新创业大赛优秀企业奖,宁波市首批市“3315计划”海外高端创业创新团队最高奖A类,宁波市发明创新大赛奖,及国家科技部中小企业技术创新基金的立项。本科毕业于清华大学自动化系,2004年获美国斯坦福大学 (Stanford University)管理科学与工程博士学位。具备丰富的工程技术研究,高新技术产业化和国际化企业管理的经验与背景。善于团结带领团队,整合资源,带领公司不断创新,开拓业务。
张晓晶博士:宁波美晶医疗技术有限公司董事长。入选国家第二批“万人计划” 科技创新领军人才,科技部中青年科技创新领军人才,浙江省“千人计划”,美国医学和生物工程研究院院士(AIBME Fellow),获得美国国立卫生院(NIH)院长创新研究奖。毕业于美国斯坦福大学,回国创业前任美国著名常春藤盟校(Ivy League)之一的达特茅斯学院(Dartmouth College)正教授, 任生物医学微纳米型器件实验室主任。学术休假期间,曾任美国美国斯坦福大学访问教授,上海交通大学“王宽诚”讲席教授。
(转化医学网360zhyx.com)
https://www.360zhyx.com/home-research-index-rid-68973.shtml?from=timeline
乐飚1, 宋毅1,严梅娣2,沈挺1,张晓晶1
1:宁波美晶医疗技术有限公司
2:宁波第七医院甲乳外科
- CTCs(circulating tumor cells )已成为多种类型癌症临床诊疗的标记物,在针对乳腺癌,肺癌,前列腺癌和结肠直肠癌的临床试验中,对于良、恶性肿瘤的鉴别可提供较为确切的信息;被认为与恶性肿瘤的复发、转移密切相关,对肿瘤的早期诊断、临床分期、复发转移和耐药监测、预后判断、开发新的治疗靶点具有重要价值。本文主要从CTCs的特性及其在乳腺癌转移性患者中的诊疗应用进行概述。
- 引言
临床统计结果显示,约有50%的乳腺癌患者会出现复发转移【1】,其中75%的转移性乳腺癌(Metastatic Breast Cancer: MBC)发生在初诊后的3~5年内。初诊时有腋淋巴结(axillary lymph node:ALN)阳性ALN≥4其远处转移率71.4%,阳性ALN<4时,远处转移率约为26.5%,ALN阴性患者者的远处转移率约为10%~30%[2]。MBC患者的OS期虽有存活10年以上的报道,但多数MBC患者在18~24个月死亡。其中骨转移的中位生存期2年,部分患者可达48个月,而内脏转移仅6个月。
目前循环肿瘤细胞CTCs(circulating tumor cells ),被认为与恶性肿瘤的复发、转移密切相关,对肿瘤的早期诊断、临床分期、复发转移和耐药监测、预后判断、开发新的治疗靶点具有重要价值。在针对乳腺癌,肺癌,前列腺癌和结肠直肠癌的临床试验中,对于良、恶性肿瘤的鉴别可提供较为确切的信息。
2015年NCCN【美国国家综合癌症网络(National Comprehensive Cancer Network】发布的乳腺癌诊疗指南指出Ⅳ期、转移复发乳腺癌的综合治疗可以延长生存期,重复活检和使用循环肿瘤标志物(如CTC,ctDNA等)的推荐来自临床经验和专家小组的非正式共识,但是其临床价值需要更多临床试验的验证。本文主要从CTCs的特性及其在乳腺癌转移性患者中的诊疗应用进行概述。
2. CTC与ctDNA检测技术的现状
分析血液中游离的肿瘤DNA(ctDNA)、考察血液中完整的肿瘤细胞(CTC)和收集由肿瘤细胞释放出的外泌体是目前液体活检技术的主要方向。(详见美晶医疗发表于转化医学网5月刊的“液体活检(循环肿瘤细胞)与医学影像学诊断的临床相关性”)。简而言之:CTC,ctDNA 和外泌体虽然都是液态活检的检测对象,但三者的用途不一,必须综合起来才能解决所有问题。比如:CTC 能提高诊疗的精确性,而ctDNA侧重于靶向用药和耐药性指导。外泌体目前还没有成熟的产品,但是外泌体稳定性强,且适用范围广。单一使用CTC 的临床意义将不断降低,CTC的价值将更多展现在与ctDNA 的综合应用,这样可以充分结合ctDNA 高灵敏度,以及CTC 高特异性,全息化的优势。未来,液态活检各种方式的联合使用将是大势所趋。
国外的CTC 检测公司大部分都有自己独立研发的检测平台或仪器,例如:Cynveniu公司的ClearID 微流体平台,Fluxion Biosciences 公司的基于微流体技术以及免疫磁珠的IsoFlux系统;ApoCell 公司的ApoStream®技术;国内的公司具有独立研发的CTC 检测仪器的公司并不多,包括丽珠集团旗下Cynvenio 公司的LiquidBiopsy 稀有细胞分离平台;宁波美晶医疗自主研发的CellRichTM循环肿瘤细胞检测系统及配套试剂等。(参照宁波美晶医疗官网:http://www.nanolitesystems.net或美晶医疗发表于转化医学网4月刊的“基于微芯片的自动化循环肿瘤细胞检测系统¾ CellRichTM新型液体活检平台”)
CellRich™系统主要用于检测血液中的循环肿瘤细胞,进行诊断和监控癌症病情发展。该系统已有8项发明专利获得授权,20多项实用新型和软件著作权授权。获得了2014年“国家重点新产品”称号。作为同类别中的首创产品,美晶医疗也牵头制定了相关医疗器械分类标准(分类编码6841)。目前,CellRich™系统已经在包括美国达特茅斯医学院及上海胸科医院在内的国内外多家知名医院投入使用。
在检验服务方面,为满足“精准医疗”对基因检测的需求,设立了美晶医学检验所,已获得卫生部颁发的医疗机构执业许可证书和临床PCR实验室资质。目前美晶医学检验所已开展临床细胞分子遗传学等检验服务,包括个性化用药基因检测,循环肿瘤细胞检测,疾病风险基因检测等多项业务。其中ctDNA系列检测服务包括:

3. 对于转移性乳腺癌患者,CTC计数可提供较为确切的预后信息,并可作为PFS与OS相关的独立预测因素 【3】
北京307医院江泽飞教授等在6家中国顶尖的癌症中心所招募的300例MBC患者,计划完成共3次CTC血样的采集以及接受两次影像学评估。结果显示:中国转移性乳腺癌患者,CTC计数可提供较为确切的预后信息,并可作为PFS与OS相关的独立预测因素,且与美国德州大学Cristofanilli M 团队,2008年在自然杂志发表的实验结论相吻合(使用Cellsearch系统,需采集7.5ml的血液样本,基线标准≥5 CTCs / 7.5ml外周血)

表1:CTC与MBC患者PFS或OS关联的多变量分析
近年来发表了大量的关于CTC与乳腺癌预后关联的文章,但是仍然难以得出一个比较可靠的结论,这是因为CTC检测方法、评判标准、研究对象以及临床分期等不同使这些报道无法比较。因此需要进行大规模的临床试验来验证CTC和乳腺癌患者的OS、PFS、DFS等之间的关系。

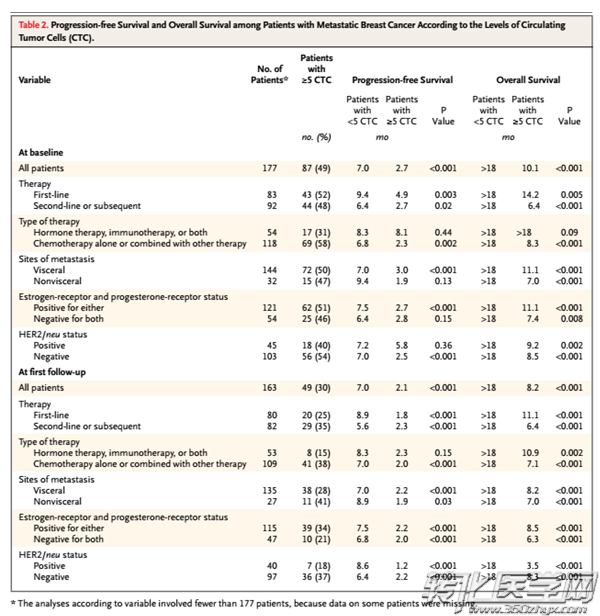
图1:CTC数量与患者PFS及OS的关联。检测时间节点:CTC与HER-2同时检测
4. 对于HER-2阳性在内的各亚型乳腺癌患者,无论治疗手段如何,CTC计数均具有预后价值。【3】

图2:治疗前后HER-2阳性表达与患者PFS及OS的关联
A,C,E(HER-2阳性率 VS PFS);B,D,F(HER-2阳性率 VS OS)
HER-2为人表皮生长因子受体-2。市场已有HER-2抑制型靶向药物与配套实施的HER-2检测套餐(通过iFISH或免疫组化平台检测组织样本中是否存在HER-2阳性蛋白或基因表达)。
5. CTC是乳腺癌的微转移(即肿瘤复发转移过程中)的必要条件 【4】
CTC进入循环系统后,可以单独或示意细胞簇的形态贴附在其他组织,以休眠状态潜伏其中,等待某种激活唤醒。一旦激活后便开始增殖或迁移到适宜的组织。研究提示,未能形成转移的关键因素在于休眠细胞未能得到适宜的激活,细胞因子、生长因子、激素和细胞外基质等微环境因素未参与到调节细胞的增殖,因此,在乳腺癌患者外周血中检测到的CTC预示有可能发生肿瘤转移,即CTC的出现是肿瘤复发转移过程中的必要条件。

- CTC与乳腺癌肿瘤患者的临床分期,是否存在远处转移的标准之一。【5】


7. 动态监测CTC的数量变化与患者预后的关联
为了探讨CTC检测在转移性乳腺癌(metastatic breast cancer,MBC)化疗疗效评价中的应用价值。【6,7】 2007年10月至2010年6月,苏州大学附属第一医院收治136例MBC患者,患者每3个化疗周期做一次CT检查,参照实体瘤评价标准(response evaluation criteria in solid tumors,RECIST)评价病情。评价当天采集7.5 mL外周血,应用膜滤过(isolation by size of epithelial tumor cells,ISET)结合激光扫描细胞术(laser scanning cytometry,LSC)检测CTC,CTC水平以肿瘤细胞检出数/7.5 mL血表示。结果显示:136例MBC患者共完成341次CTC检测,其中262例(76.8%)血液样本可检测到CTC,平均检出CTC数量为(6.73±4.92)个/7.5 mL样本。136例MBC患者治疗后达到完全或部分缓解43例(31.62%),稳定39例(28.67%),无效进展54例(39.71%)。患者病程中CTC数目的改变,与病情的进展显著相关,r=0.51483,P<0.01。化疗后CTC数目不变或下降的病例,预后较好,化疗后CTC数目上升的病例预后差。治疗前的CTC水平与疾病转归无明显相关性,x2=3.62,P=0.08215。结论 CTC检测可用于MBC患者化疗后疗效评价。
8. 三阴性乳腺癌患者CTC检测与患者预后的关联
8-1. 三阴性乳腺癌的临床病理特点及预后因素分析【8】
为了探讨三阴性乳腺癌患者的临床病理特点、分子生物学特性、生存率以及影响预后的因素,大连市肿瘤医院的张婕,李丽课题组回顾性分析了44例三阴性乳腺癌患者的病历资料,分析其临床病理特点、分子生物学指标和各种治疗方式对生存的影响。入组的44例女性患者的中位年龄49岁(35~82岁)。其中Ⅰ期患者6例(13.6%),Ⅱ期19例(43.2%),Ⅲ期17例(38.6%),Ⅳ期2例(4.5%)。核分级Ⅰ级6例(13.6%),Ⅱ级15例(34.1%),Ⅲ级23例(52.3%)。伴有脉管瘤栓22例(50%),伴有神经浸润10例(22.7%)。中位生存时间4.0年(1.5-8.5年)。结果显示:三阴性乳腺癌发病率较低,组织学分级较高,多为浸润性导管癌,易较早出现复发和转移。影响总生存的因素为肿瘤大小、淋巴结状态、临床分期、脉管瘤栓和神经浸润,其中影响预后的独立因素是肿瘤大小和淋巴结状态。 [6]3年总生存率为66.7%(29/44)。
8-2. TC与TE方案治疗三阴性乳腺癌的疗效比较
由于三阴性乳腺癌(TNBC)患者可能对铂更为敏感。北京肿瘤医院徐兵河课题组回顾分析了92例接受卡铂(TC)或表柔比星(TE)治疗(4-6个疗程以上)的局部晚期三阴性乳腺癌患者。以病理学完全缓解(pCR)率,临床缓解率和无复发生存期(RFS)为指标,分析比较铂类为基础的新辅助化疗与非铂方案治疗局部晚期三阴性乳腺癌患者的差异。结果显示:92例入组患者中TC治疗组43例,其余均为TE治疗组(49例)。TC治疗组的完全缓解优于TE治疗组 (37.2% VS 16.1%,P = 0.032)。两组间的临床缓解率相似(83.7% VS 87.8%,P=0.500)。中性粒细胞减少(TC:39.5%比TE:46.9%,P=0.399)和发热性中性粒细胞减少发生率无显著差异。周围神经病变常见,但不严重。TE组G3脱发比TC组更频繁。因随访时间所限,还没有进行RFS评估。研究表明,通过病理学完全缓解率发现,治疗局部晚期三阴性乳腺癌时,铂类为基础的新辅助化疗优于非铂类方案。但还有必要进行进一步的大规模前瞻性随机试验。
9. 结语
综上所述转移性乳腺癌患者外周血CTC临床辅助诊断具有重要的临床意义和应用前景,并已成为当前的研究热点。通过连续观察CTCs数量的变化情况,为监测肿瘤动态,早期发现/诊断肿瘤的复发转移,评估治疗效果或调整治疗方案,为个体化治疗提供全面,实时的信息与思路。但是CTCs检测的敏感性与特异性是限制其临床应用的主要因素,因此其临床价值需要更多临床试验的验证。
10. 参考文献:
[1]沈镇宙,邵志敏.现代乳腺肿瘤学进展[J].上海:上海科学技术文献出版社,2002, 209-225.
[2]赵丽娜,蔡莉.乳腺癌循环肿瘤细胞研究进展与展望[J].中华肿瘤防治杂志,2011,(22).
[3]Jiang ZF, Cristofanilli M et al.Circulating tumor cells predict progression- free and overall survival in Chinese patients with metastatic breast cancer, HER2-positive or triple-negative (CBCSG004): a multicenter, double-blind, prospective trial. Ann Oncol. 2013 Nov;24(11):2766-72.
[4]Belkacemi Y, Westenberg H; Breast Working Party of the EORTC Radiation Oncology Group (ROG).Patterns of practice of regional nodal irradiation in breast cancer: results of the European Organization for Research and Treatment of Cancer (EORTC) NOdal Radiotherapy (NORA) survey. Ann Oncol. 2015 Mar;26(3):529-35.
[5] Lee SH, Lee JK, Ahn MJ, Kim DW, Sun JM, Keam B, Kim TM, Heo DS, Ahn JS, Choi YL, Min HS, Jeon YK, Park K. Vandetanib in pretreated patients with advanced non-small cell lung cancer-harboring RET rearrangement: a phase II clinical trial. Ann Oncol. 2017 Feb 1;28(2):292-297.
[6] Cristofanilli M, Budd GT, Ellis MJ, Stopeck A, Matera J, Miller MC, Reuben JM, Doyle GV, Allard WJ, Terstappen LW, Hayes DF. Circulating tumor cells, disease progression, and survival in metastatic breast cancer. N Engl J Med. 2004 Aug 19;351(8):781-91.
[7] Mego M, De Giorgi U, Cristofanilli M. Characterization of metastatic breast cancer patients with nondetectable circulating tumor cells. Int J Cancer. 2011 Jul 15;129(2):417-23.
[8] 《中国肿瘤临床与康复》 2009年05期 张婕 李丽 (大连市肿瘤医院)
[9] 齐晓伟,姜军.乳腺癌循环肿瘤细胞检测方法的研究进展[J].中华肿瘤防治杂志,2010,(19).
作者简介:
乐飚博士:宁波美晶医疗技术有限公司研发总监。日本名古屋大学工学博士,12年日本肿瘤临床与研究经历,擅长基于纳米技术的肿瘤早期诊断与治疗的放射性医药品研发及分子诊断,曾获得2001年度,日本生物工学学会第一届优秀论文奖等荣誉,入选2012年度上海市浦江人才,主持重大科研项目5项,参与或协助主持科研项目数十项,发表多篇SCI论文。
宋毅:宁波美晶医疗技术有限公司基因检测服务部经理。浙江师范大学理学硕士,7年的临床基因检测工作经验,目前主要带领部门开展相关临床检测服务,及开发CTC下游基因检测项目。
严梅娣:宁波第七医院甲乳外科主任医师。从事普外科临床工作多年,对外科急危重病人的救治积累了丰富的经验,擅长甲状腺疾病和乳腺疾病的诊治及腹部腔镜手术。曾荣获“镇海区学榜样,讲奉献先进个人”、“镇海区首届十佳医卫工作者”等光荣称号。多项科研课题获厅局级、市区级立项,并有多篇论文在国家级及省级杂志上发表。
沈挺博士:宁波美晶医疗技术有限公司总经理,入选浙江省“千人计划”。作为主要项目及团队负责人开发的“新一代癌症血液检测生物芯片及系统”项目,获得了中国科技创业计划大赛项目组一等奖,中国首届创新创业大赛优秀企业奖,宁波市首批市“3315计划”海外高端创业创新团队最高奖A类,宁波市发明创新大赛奖,及国家科技部中小企业技术创新基金的立项。本科毕业于清华大学自动化系,2004年获美国斯坦福大学 (Stanford University)管理科学与工程博士学位。具备丰富的工程技术研究,高新技术产业化和国际化企业管理的经验与背景。善于团结带领团队,整合资源,带领公司不断创新,开拓业务。
张晓晶博士:宁波美晶医疗技术有限公司董事长。入选国家第二批“万人计划” 科技创新领军人才,科技部中青年科技创新领军人才,浙江省“千人计划”,美国医学和生物工程研究院院士(AIBME Fellow),获得美国国立卫生院(NIH)院长创新研究奖。毕业于美国斯坦福大学,回国创业前任美国著名常春藤盟校(Ivy League)之一的达特茅斯学院(Dartmouth College)正教授, 任生物医学微纳米型器件实验室主任。学术休假期间,曾任美国美国斯坦福大学访问教授,上海交通大学“王宽诚”讲席教授。
(转化医学网360zhyx.com)
https://www.360zhyx.com/home-research-index-rid-68973.shtml?from=timeline
扫描上面二维码在移动端打开阅读





