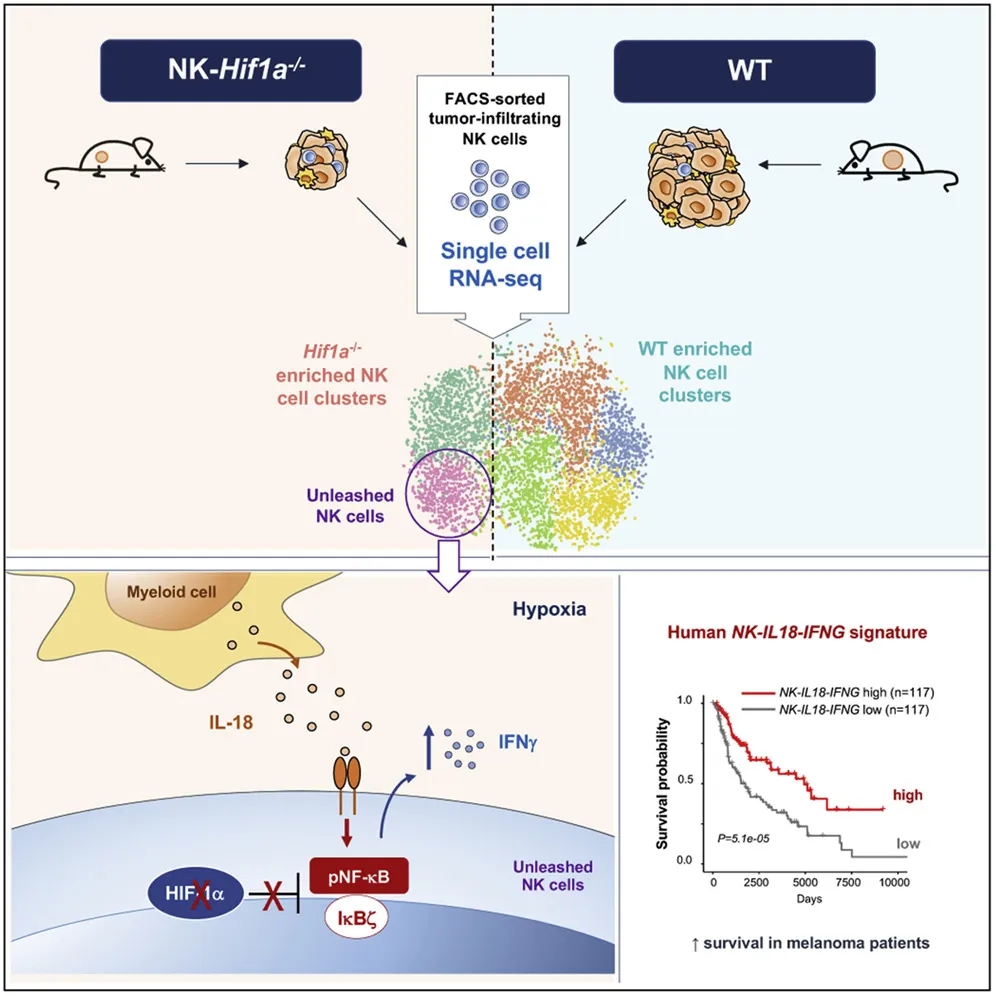
在肿瘤免疫治疗领域,如何增强免疫细胞的功能是目前面临的巨大挑战。低氧是所有实体瘤的共同特征,细胞可通过上调转录因子HIF-1α以适应低氧环境,目前尚不清楚 HIF-1α如何在细胞本体水平调节NK细胞信号转导和抗肿瘤效应功能。本文研究者利用单细胞RNA测序技术确定了肿瘤浸润自然杀伤(NK)细胞的转录图谱。条件性敲除NK细胞Hif1a基因可导致肿瘤生长减慢,NK细胞激活标志及效应分子表达升高,以及NF-kB信号通路富集。而NF-kB激活以及Hif1a-/-NK细胞抗肿瘤活性的增强都需要髓样细胞衍生的白介素18(IL-18)。在人肿瘤浸润NK细胞中,HIF1A低表达与IFNG的高表达密切相关,并且总体生存率改善的实体瘤患者都具有NK- IL18 -IFNGhigh信号特征。因此,本研究认为转录因子HIF-1α的抑制释放了NK细胞活性,有望被开发应用于免疫治疗。
论文ID
原名:Single-Cell RNA Sequencing of Tumor-Infiltrating NK Cells Reveals that Inhibition of Transcription Factor HIF-1α Unleashes NK Cell Activity
译名:肿瘤浸润性NK细胞的单细胞RNA测序揭示了转录因子HIF-1α的抑制释放了NK细胞活性
期刊:Immunity
IF:21.522
发表时间:2020.5
通讯作者:Adelheid Cerwenka
通讯作者单位:海德堡大学曼海姆医学院,欧洲血管科学中心(ECAS)
DOI号:10.1016/j.immuni.2020.05.001
背景介绍
天然杀伤(NK)细胞是先天溶细胞和产生细胞因子的效应细胞,可有效杀死各种肿瘤靶标。NK细胞在潜在的靶细胞上整合源自激活性NK受体的信号后被激活,该信号被特异于自身MHC I类分子的抑制性受体所抵消。在实体瘤中,浸润肿瘤的NK细胞常常表现出功能异常的表型,包括表达的激活受体水平降低,抑制受体水平升高,细胞因子干扰素γ(IFN-γ)的产生能力和细胞毒性降低。这种功能障碍是否存在于所有浸润肿瘤的NK细胞,或者是否存在分子异质性,目前还未明确。
肿瘤微环境中存在的细胞和因子可以驱动免疫抑制以及肿瘤进展和转移。缺氧是实体瘤的共同特征,在低氧应激环境下,肿瘤,基质和免疫细胞可分泌趋化因子来募集免疫抑制细胞。细胞通过上调转录因子HIF-1α来适应缺氧。常氧条件下,HIF-1α蛋白被结构性降解,但在缺氧环境,如实体瘤中,HIF-1α蛋白可被稳定易位至细胞核。转录因子HIF-1α可调节许多过程的基因表达,如葡萄糖代谢,细胞增殖,存活和血管生成。在免疫系统中,HIF-1α表达于多种不同的细胞,并且能够促进血管生成,调节细胞分化和功能。目前尚不清楚,HIF-1α如何在细胞本体水平调节NK细胞信号转导和抗肿瘤效应功能,尤其在实体瘤等慢性缺氧条件下。
作者利用条件性敲除NK细胞Hif1a的小鼠,并通过HIF-1α抑制剂与人NK细胞的共扩展培养,证明NK细胞中的HIF-1α抑制作用会增强其抗肿瘤活性。对肿瘤浸润性NK细胞的单细胞RNA测序(scRNA-seq)分析显示,在Hif1a缺陷型NK细胞中有一活化的NK亚群,具有表达IκBζ(核因子kappa B zeta的抑制剂),以及NF-kB(核因子kappa B)活性和功能增强的特征。Hif1a-/-NK细胞的抗肿瘤活性以及对肿瘤恶化的控制依赖于肿瘤微环境中髓样细胞衍生的IL-18。结果
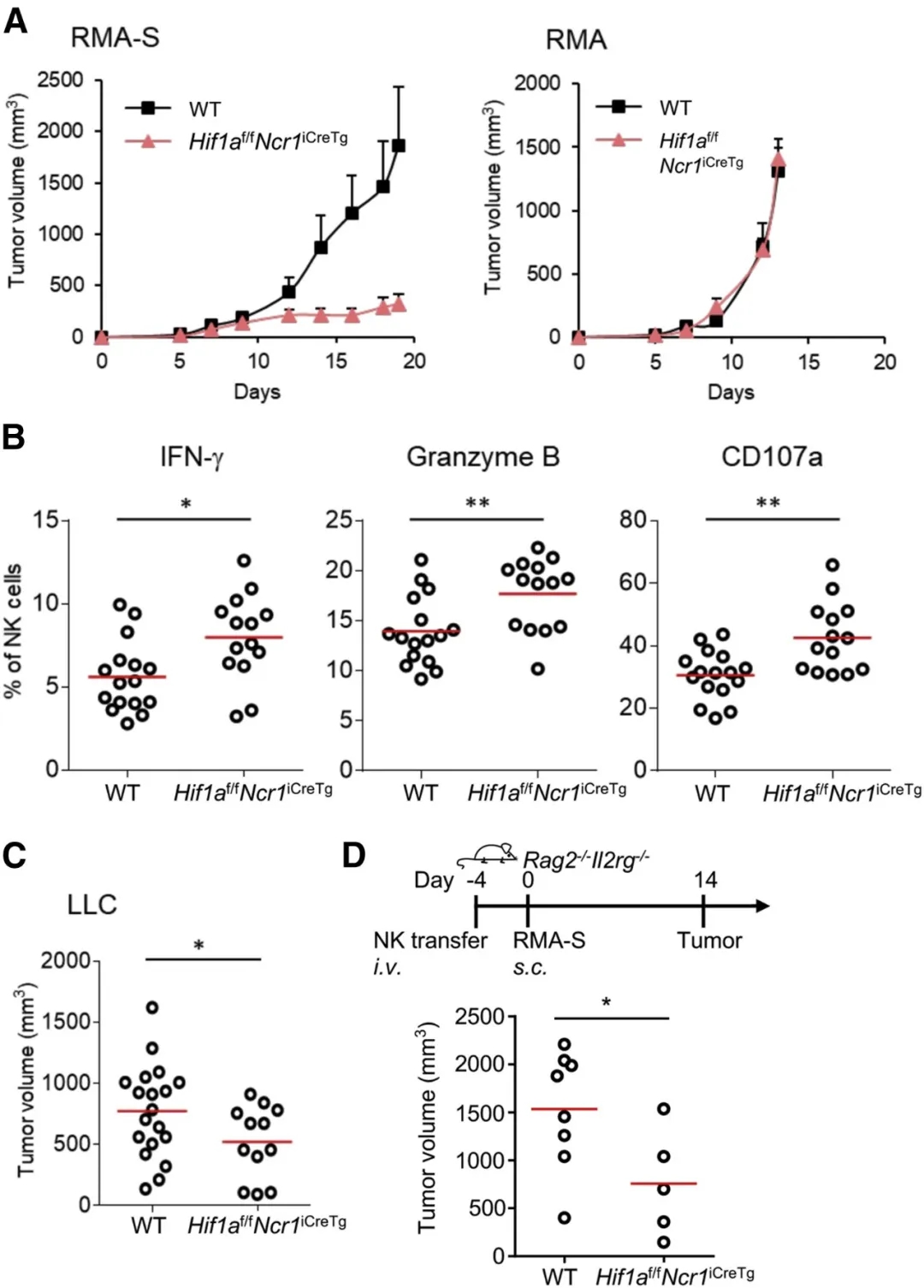
1.Hif1a缺乏的NK细胞表现出强大的抗肿瘤活性并抑制肿瘤生长
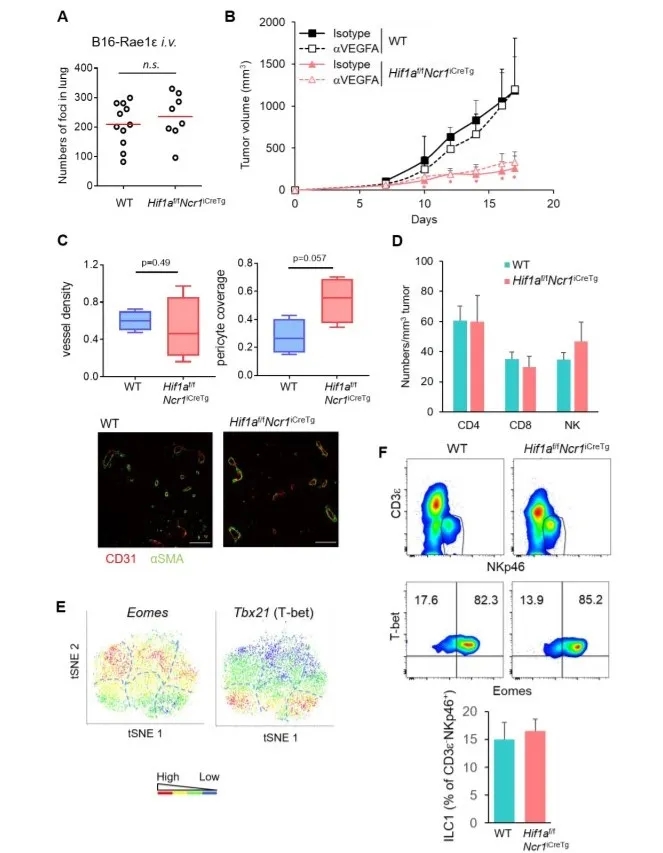
为了研究HIF-1α在长期低氧环境和实体瘤组织中对NK细胞反应的调节作用,本研究利用Hif1af/fNcr1iCreTg小鼠(即特异性敲除NK细胞中Hif1a基因),接种不同的肿瘤模型,在体外研究Hif1a-/-NK细胞的抗肿瘤活性。皮下接种RMA-S淋巴瘤(此瘤细胞不表达MHCⅠ类分子),与野生型(WT)小鼠相比,Hif1af/fNcr1iCreTg鼠的肿瘤大小显著降低(图1A,左);但当接种RMA淋巴瘤(此瘤细胞正常表达MHCⅠ类分子),两组间肿瘤的增长无差异(图1A,右)。同时,相比于WT小鼠,Hif1af/fNcr1iCreTg小鼠的脾脏NK细胞对RMA-S瘤细胞展现出更强的脱颗粒反应,并且IFN-γ和颗粒酶B的表达升高(图1B)。皮下接种Lewis肺癌细胞(LCC)的实验得到同样结果(图1C)。在静脉接种B16-Rae1ε黑色素瘤细胞建立肿瘤肺转移实验中,两组间的肺部肿瘤转移并无差异(图S2A)。为了验证实验模型中的抗肿瘤作用是否受到促血管生成因子VEGFA(血管内皮生长因子A)的影响,研究者应用中和性抗VEGFA单克隆抗体(mAb),但中和性抗体并不影响野生型和Hif1af/fNcr1iCreTg小鼠RMA-S实体瘤的生长(图S2B)。而且,各组间的RMA-S肿瘤既未显示血管密度差异,也未显示肿瘤相关血管周细胞覆盖率的明显变化(图S2C),肿瘤浸润的NK细胞和T细胞的相对数目也无差异(图S2D)。
为了探究Hif1a-/-NK细胞内在的功能,研究者在接种RNA-S肿瘤前,过继转移Hif1a-/-NK细胞到Rag2-/-Il12rg-/-小鼠(此小鼠缺乏T,B,NK细胞),与过继转移WT鼠NK细胞相比,这导致肿瘤生长降低(图1D)。提示HIF-1α在调节NK细胞抗肿瘤活性中的内在作用。
图1. NK细胞中Hif1a缺乏导致肿瘤生长减慢
(A)皮下注射RMA-S细胞(缺乏MHC I类分子;左)或RMA细胞(表达MHC I类分子;右)到Hif1af / fNcr1iCreTg和Hif1af / f(WT)小鼠中,同时监测肿瘤生长情况。
(B)将来自WT(n = 16)或Hif1af / fNcr1iCreTg(n = 14)的RMA-S荷瘤小鼠的脾细胞与RMA-S细胞在缺氧条件下共培养22 h。使用流式细胞仪检测IFN-γ,颗粒酶B和CD107a表达。
(C)WT或Hif1af / fNcr1iCreTg小鼠经皮下注射106个LLC细胞。监测小鼠第14天的肿瘤体积及其平均值。
(D)IL-2刺激下扩增的WT或Hif1a-/-NK细胞过继转移到Rag2-/-Il2rg-/-小鼠。4天后皮下注射RMA-S细胞,并监测肿瘤的生长。
补充图2. Hif1af / fNcr1iCreTg小鼠中肿瘤的生长,淋巴细胞的浸润和血管特征
(A)静脉注射B16-Rae1ε细胞(5×105)至WT或Hif1af / fNcr1iCreTg小鼠体内。在第14天进行肺转移分析。数据显示了各小鼠的肺结节数及平均值。
(B)RMA-S荷瘤的Hif1af / fNcr1iCreTg或WT小鼠接受抗VEGFA中和抗体mAb(αVEGFA)或同种型匹配的对照抗体(同种型),动态监测肿瘤生长。
(C)石蜡包埋的肿瘤组织切片进行抗CD31和抗αSMA染色分别检测内皮细胞和周细胞。并计算Hif1af / fNcr1iCreTg和WT小鼠的血管密度和肿瘤周细胞覆盖率。
(D)Hif1af / fNcr1iCreTg或WT小鼠经皮下注射RMA-S肿瘤细胞。通过流式细胞仪分析NK细胞和T细胞(CD4+和CD8+)数。
(E)Hif1af / fNcr1iCreTg或WT小鼠经皮下注射RMA-S肿瘤细胞。收集CD3ε-NK1.1+细胞并进行scRNA-seq分析,结果显示两种基因型在各细胞簇的丰度。
(F)流式细胞仪分析肿瘤浸润CD3ε-NKp46+细胞中Eomes和T-bet的表达。ILC1被定义为T-bet+ Eomesint / low细胞。
2.利用高通量ScRNA-Seq技术在Hif1af/fNcr1iCreTg小鼠肿瘤浸润性NK细胞中明确一不同的NK效应细胞亚群。
为了确定来自Hif1af/fNcr1iCreTg和WT小鼠的肿瘤浸润NK细胞的转录谱,研究者进行了scRNA-seq(10X Genomics)(图2A)。共分析5,721个NK细胞(3,075 WT和2,646个Hif1a-/-NK细胞),并检测了WT中平均1,763个基因转录本和Hif1a-/-NK细胞中1,563个基因转录本。基于转录特征,所有测序的NK细胞分为六个细胞簇(图2B),Hif1a-/-和 WT NK细胞在整个细胞簇中呈现不同的分布(图2C)。并且,约60%的Hif1a-/-NK细胞分布在细胞簇1和4(图2D),在细胞簇1和4有90%以上的细胞都是Hif1a-/-NK细胞(图2E)。相比之下,大部分WT NK细胞分布于细胞簇2,3,5和6(图2D和E)。细胞簇1,2,和3 的细胞都是Cd11blowCd27high,有别于Cd11bhighCd27low的细胞簇4,5,和6(图2F和G)。此表型与Klrg1,Ncr1(NKp46),Klrb1c(NK1.1),Itga2(CD49b,DX5),Klra3(Ly49C)和Klra9(Ly49I)的表达增加以及Kit(c-Kit)的表达减少相关(图2F和G)。在 Cd11bhighCd27low NK细胞中,分别编码溶细胞分子穿孔素和颗粒酶A和B的Prf1,Gzma和Gzmb的表达也较高(图2G)。编码转录因子Eomes(Eomes)和T-bet(Tbx21)的转录本的表达在WT和Hif1a-/-NK细胞之间分布相似(补充图2E)。在两组肿瘤浸润的CD3ε-NKp46+细胞中,检测到相似频率的代表ILC1表型的Eomesint/lowT-bet+ 细胞(补充图2F)。在细胞簇1,2和3的细胞高表达编码免疫检查抑制性受体PD-1,TIGIT,CTLA4的基因Pdcd1,Tigit,Ctla4(图2G)。在细胞簇4的Hif1a-/-NK细胞中,细胞因子IFN-γ和激活标志CD69的转录本Ifng,Cd69表达明显升高(图2H)。在细胞簇4中少于10%的WT NK细胞也显示出Hif1a的低表达;在WT NK细胞中,Hif1a及其靶基因的低表达与Ifng转录增加相关(图2I)。指示HIF-1α在NK细胞活化和效应功能中的负性调节作用。
(A)Hif1af / fNcr1iCreTg或WT小鼠经皮下注射RMA-S肿瘤细胞。两周后,利用scRNA-seq分析经流式细胞仪分选的肿瘤浸润CD3ε-NK1.1+ NK细胞。
(B–E)5,721个NK细胞的t分布邻域嵌入(tSNE)和图形可视化(A),从两个小鼠品系(C)定义了六个细胞簇(B)。计算Hif1a-/-和WT NK细胞占总NK细胞(D)和每个细胞簇(E)的百分比。
(F)六个细胞簇中表达最高的基因热图。
(G和H)tSNE图中所选基因的表达,彩色代表MAGIC推导的基因表达值的高低。(G)成熟标志物、激活和抑制受体、细胞毒性分子;(H)细胞因子Ifng和激活标记Cd69。
(I)Hif1a或Hif1a靶基因与Ifng表达的相关性,在WT NK细胞(左);WT NK细胞的6个细胞簇(中);Hif1a-/-和WT NK细胞(右)。
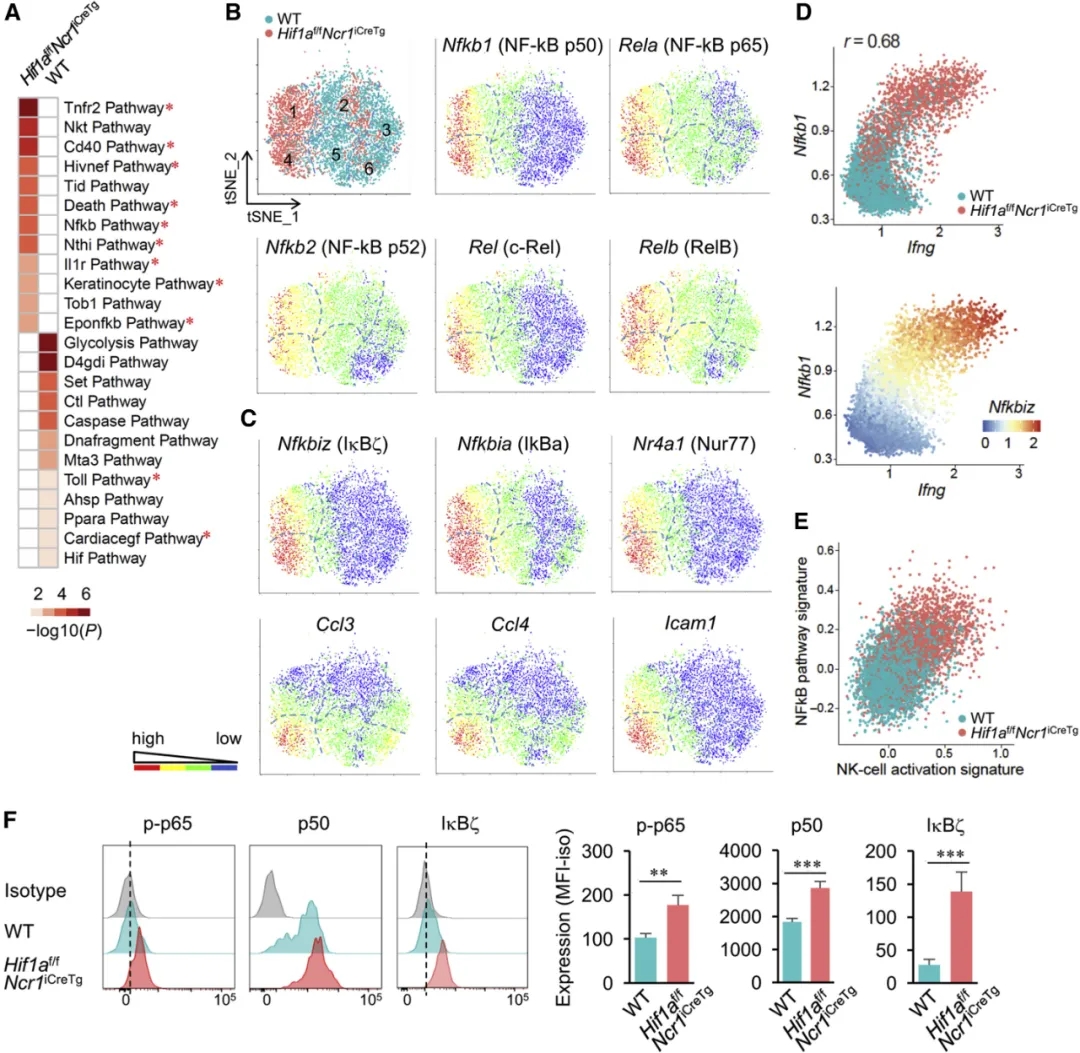
对WT和Hif1a-/-肿瘤浸润NK细胞之间差异表达的转录本的通路分析显示,Hif1a-/-NK细胞中NF-κB通路和其他涉及NF-κB活性的通路富集(图3A),在细胞簇1和4中也是如此(补充图3)。这些包括编码NF-κB1,RelA和其它 NF-κB 家族成员,如NF-κB2, c-Rel和RelB的转录本 Nfkb1,Rela, Nfkb2, Rel和Relb(图3B)。除此之外,NF-κB的靶基因Nfkbiz的表达也升高,Nfkbiz编码一种核因子IκBζ,据报道该核因子可在细胞因子刺激下驱动NK细胞产生IFN-γ(图3C和图2F)。其它NF-κB靶基因,例如Nfkbia,Nr4a1,Ccl3,Ccl4和Icam1都主要共表达在细胞簇4中(图3C和图2F)。重要的是,NF-κB激活的富集特征与Ifng基因的高表达(图3D),以及前人报道的NK细胞激活特征有关(图3E)。为了证实在缺乏Hif1a的肿瘤浸润NK细胞中NF-κB通路的激活,我们使用流式细胞仪确定了磷酸化的p65(p-p65),p50和IκBζ的表达。确实,我们的结果证实了与WT肿瘤浸润NK细胞相比,Hif1a-/-中p-p65和p50的增加以及IκBζ的诱导作用(图3F)。因此得出结论,在肿瘤微环境内NK细胞HIF-1α激活负调节NF-κB活性及其靶基因表达,从而阻碍了NK细胞全部效应功能的获得和维持。
图3. 利用单细胞RNA-Seq在肿瘤中明确一Hif1a-/-NK细胞活化亚群
(A)Hif1a-/-和WT肿瘤浸润性NK细胞中12种最丰富的通路(基于BioCarta通路集)的热图。
(B和C)NF-κB成员(B)和NF-κB靶基因转录本(C)的跨tSNE分布。
(D)Hif1a-/-和WT NK细胞中Nfkb1和Ifng基因表达的相关性(上图);肿瘤浸润NK细胞中Nfkb1,Ifng和Nfkbiz基因表达的相关性(下图)。
(E)Hif1a-/-和WT NK细胞中NF-κB通路和NK细胞激活特征的相关性。
(F)流式分析RMA-S肿瘤浸润Hif1a-/-和WT NK细胞(CD3ε-NK1.1+)的NF-κBp65(p-p65),NF-κBp50(p50)磷酸化和IκBζ表达。
3. Hif1a-/-NK细胞的抗肿瘤活性依赖于髓样细胞衍生的IL-18
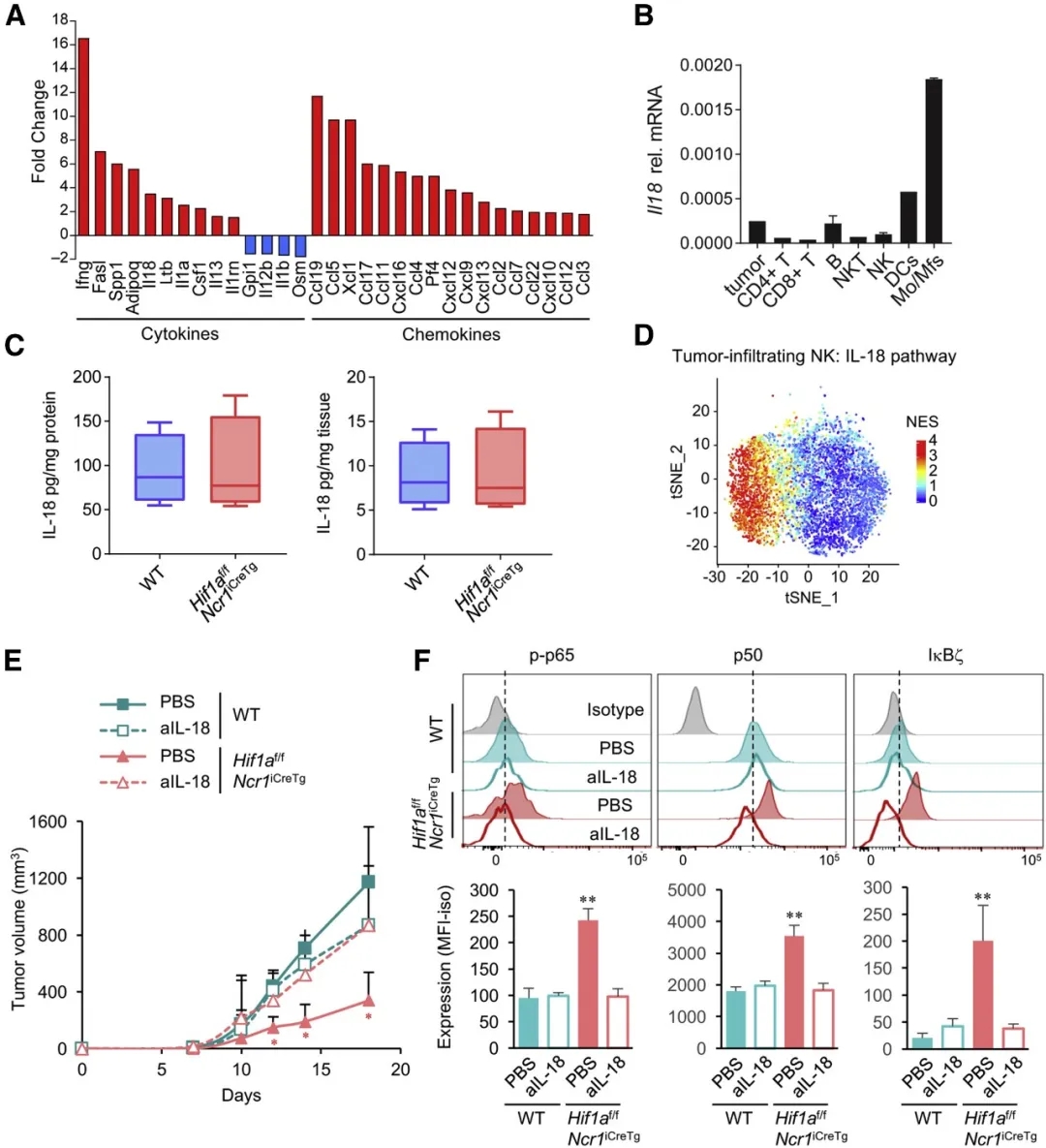
为了探究驱动肿瘤浸润Hif1a-/-NK细胞中NF-κB活性增强的因素,我们分析了全肿瘤组织的细胞因子和趋化因子转录谱。与scRNA-seq数据一致,与WT小鼠相比,Ifng是Hif1af/fNcr1iCreTg小鼠肿瘤组织中表达最高的转录物(图4A)。除此之外,编码IL-18的mRNA在Hif1af/fNcr1iCreTg小鼠肿瘤组织中有较高的丰度,IL-18先前被报道能够诱导NK细胞IκBζ的表达和IFN-γ的产生(图4A)。肿瘤细胞和肿瘤浸润的免疫细胞分析表明,主要在肿瘤浸润的免疫细胞区检测到Il18转录,其中单核细胞,巨噬细胞和程度较低的树突状细胞(DC),IL18的表达量最高(图4B)。两组中IL-18蛋白在肿瘤组织的表达量相似,提示肿瘤组织中IL-18的可用性无差异(图4C)。然而,与WT NK细胞相比,包含IL-18受体(IL-18R)下游信号分子(包括IκBζ和其他NF-κB家族成员)的IL-18通路在Hif1a-/-NK细胞中明显富集(图4D)。因此,我们利用中和性抗体mAb中和IL-18来研究IL-18在RMA-S肿瘤控制中的作用,在WT小鼠中和IL-18并不影响肿瘤生长(图4E)。相反,抗IL-18 mAb的应用消除了Hif1af/fNcr1iCreTg小鼠的肿瘤生长延迟(图4E)。与此一致的是,与对照组小鼠相比,IL-18中和作用降低了Hif1af/fNcr1iCreTg小鼠肿瘤浸润NK细胞的p-p65和p50的表达并消除了IκBζ的上调(图4F)。总之,这些发现表明,HIF-1α的缺乏增强了NK细胞对IL-18的反应能力,这是控制Hif1af/fNcr1iCreTg小鼠肿瘤生长所必需的。
图4. Hif1a-/-NK细胞介导的抗肿瘤活性依赖于髓样细胞衍生的IL-18
(A)Hif1af / fNcr1iCreTg或WT小鼠经皮下注射RMA-S肿瘤细胞。两周后,分离肿瘤并裂解部分肿瘤组织以提取RNA。qPCR分析细胞因子和趋化因子mRNA的表达。
(B)BL6或BL6-Ly5.1小鼠经皮下注射106个RMA-S肿瘤细胞。10至14天后,分离肿瘤并从合并的肿瘤组织单细胞悬液中分选出肿瘤细胞或指定的免疫细胞群。qPCR分析Il18 mRNA的丰度。
(C)Hif1af / fNcr1iCreTg和WT小鼠经皮下注射106个RMA-S肿瘤细胞。11天后,分离肿瘤,部分肿瘤组织称重并裂解。利用基于微珠的流式细胞术测定组织裂解液中IL-18蛋白量,并将其标准化为裂解液中或初始组织单重的蛋白量。
(D)基于scRNA-seq数据得到的肿瘤浸润性NK细胞中IL-18通路基因的tSNE图。
(E)Hif1af / fNcr1iCreTg和WT小鼠经皮下注射RMA-S细胞。小鼠接受抗IL-18中和抗体 mAb(αIL-18)或PBS,同时动态监测肿瘤生长。
(F)流式细胞仪分析肿瘤浸润的Hif1a-/-和WT NK细胞(CD3ε-NK1.1+)NF-κBp-p65,p50和IκBζ表达。
4.小鼠NK细胞中HIF-1α的抑制导致细胞效应功能增强和代谢增加
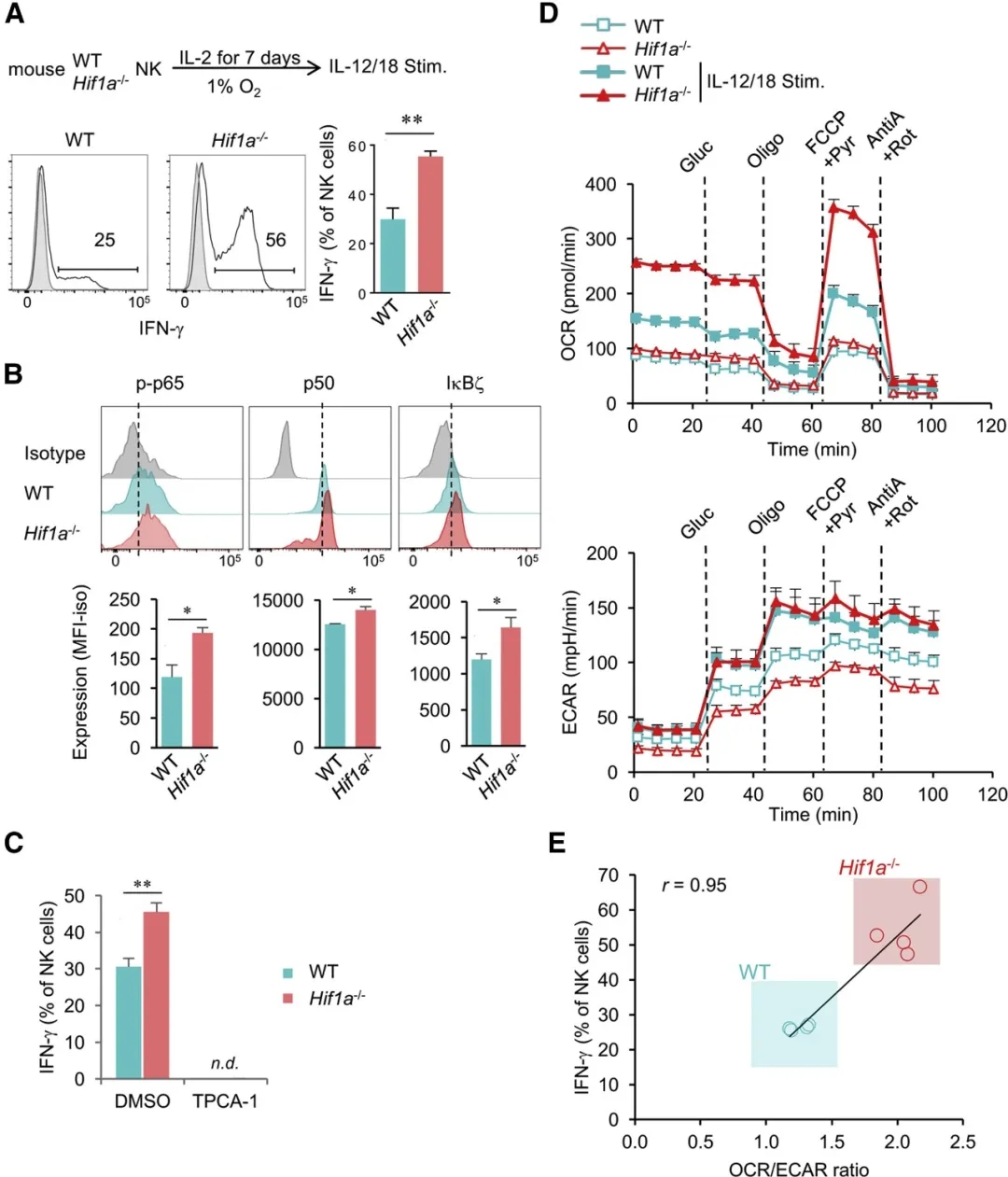
为了进一步证实IL-18诱导的Hif1a-/-NK细胞效应功能的机制,我们在1%O2低氧条件下体外培养了脾脏的Hif1a-/-或WT NK细胞7天,模拟了肿瘤的低氧微环境。用IL-12和IL-18刺激后,与WT NK细胞相比,低氧条件下的Hif1a-/-NK细胞产生更多的IFN-γ(图5A),这也与Hif1a-/-NK细胞中p-p65, p50和IκBζ表达增强相一致(图5B)。用药理抑制剂TPCA-1抑制NF-κB活化完全阻断了IFN-γ的产生(图5C),而不影响细胞活力,证实了其对IL-18R下游产生IFN-γ的必要性。据报道,HIF-1α可调节免疫细胞分化和涉及细胞代谢的效应功能。当比较长时间缺氧(7天)环境下WT和Hif1a-/-NK细胞的代谢活性时,我们观察到氧消耗率(OCR)没有差异,而作为糖酵解指标的细胞外酸化率(ECAR)在Hif1a -/-NK细胞中降低(图5D)。IL-12和IL-18刺激后,WT和Hif1a-/-NK细胞的ECAR增加到相似的值,而Hif1a-/-NK细胞的OCR更高。OCR的增加和随之而来的OCR / ECAR比升高,与Hif1a-/-NK细胞产生IFN-γ的能力增强相关(图5E)。因此,缺氧环境下的Hif1a-/-NK细胞产生IFN-γ的能力增强与NF-κB通路的激活和代谢改变有关。
图5. Hif1a缺乏的NK细胞刺激后增强的IFN-γ产生能力与NF-κB通路激活和耗氧率增加有关
(A和B)从Hif1af / fNcr1iCreTg或WT小鼠中纯化脾脏NK细胞,在低氧条件(1%O2),IL-2条件下培养7天,然后在低氧条件下IL-12和IL-18再刺激4-6小时。流式细胞仪分析了IFN-γ的产生(A)和NF-κBp-p65,NF-κBp50和IκBζ的表达(B)。
(C)在NF-κB抑制剂(TPCA-1)或溶剂对照(DMSO)存在下,IL-12和IL-18刺激低氧培养的Hif1a-/-或WT NK细胞,分析NK细胞IFN-γ产生。
(D)从Hif1af / fNcr1iCreTg或WT小鼠中纯化脾脏NK细胞,在低氧条件(1%O2),IL-2条件下培养7天,然后用IL-12和IL-18刺激。4小时后,在注射葡萄糖,寡核苷酸,FCCP,Pyr,AntiA和Rot120分钟后,利用Seahorse分析法分析线粒体的呼吸作用和糖酵解。数据显示NK细胞的耗氧率(OCR)和细胞外酸化率(ECAR)随时间变化的平均值。
(E)IL-12和IL-18刺激后,分析了(D)中NK细胞的IFN-γ产生。数据显示了IFN-γ产生与OCR / ECAR的相关性。
5.HIF-1α的抑制导致活化的人NK细胞效应功能增强
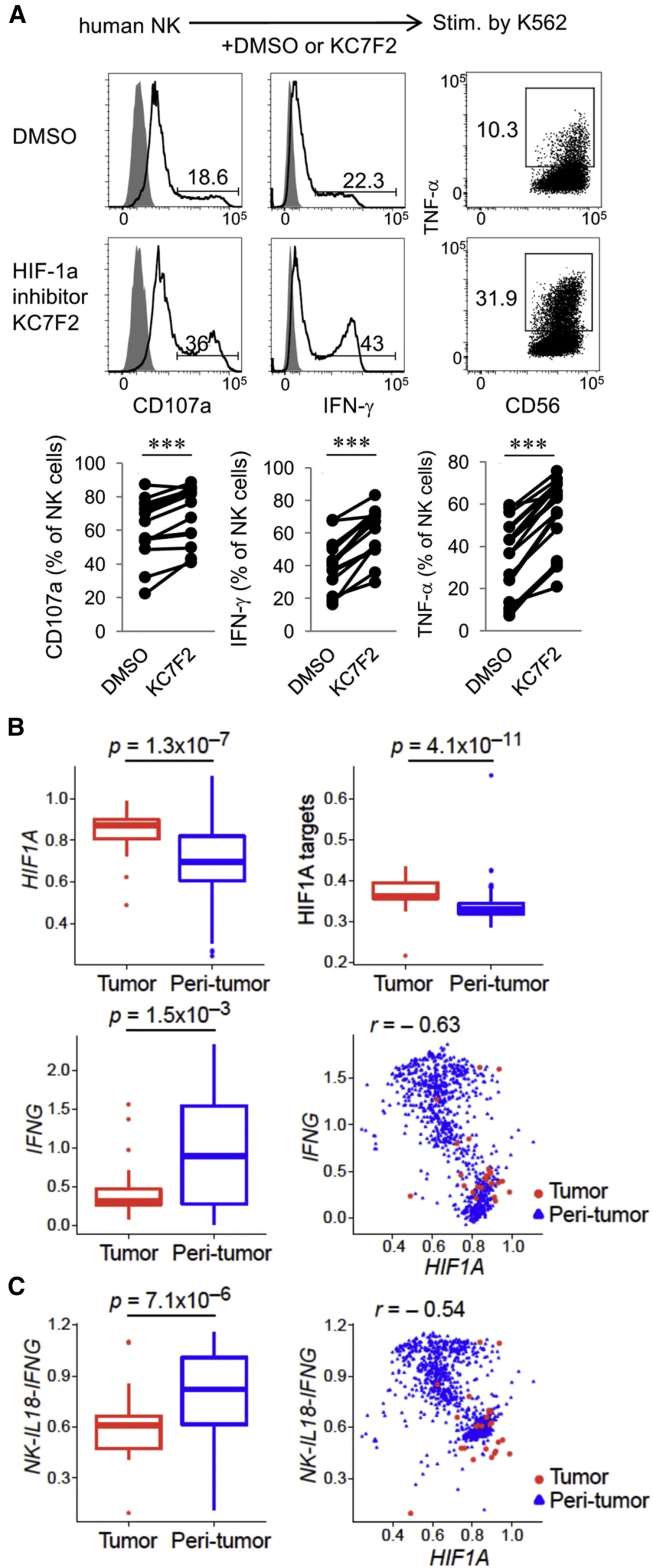
为了研究抑制HIF-1α是否以相似的方式增强人类NK细胞的效应功能,我们用小分子化合物KC7F2处理了纯化的人类外周血NK细胞。KC7F2处理的人NK细胞在IL-2条件下扩增7天,在针对K562的应答过程中,表现出更强的脱颗粒效应,并且IFN-γ和TNF-α的产生增加(图6A)。这些发现凸显了已报道的HIF-1α抑制剂诱导功能性人类NK细胞的潜力。为了研究HIF-1α是否影响癌症患者中人NK细胞的抗肿瘤反应,我们从已发表的数据库中分析了非小细胞肺癌(NSCLC)浸润和肿瘤周围组织的单个NK细胞的转录谱。我们发现,与肿瘤周围区域的NK细胞相比,肿瘤浸润的NK细胞的HIF1A表达升高,这与其靶基因表达升高和IFNG的转录降低相关(图6B)。与肿瘤周围区相比,NK-IL18-IFNG特征的减少进一步支持了肿瘤中NK细胞效应功能的负调节,这与单个NK细胞中的HIF1A表达负相关(图6C)。这些结果表明,与小鼠肿瘤浸润性NK细胞相似,癌症患者中人NK细胞的HIF1A表达与它们的抗肿瘤潜能负相关。图6. 人类NK细胞中HIF-1α的激活与抗肿瘤活性降低相关
(A)在HIF-1α抑制剂KC7F2或溶剂对照DMSO存在下,将纯化的人NK细胞与IL-2共培养7天。用K562细胞刺激后分析CD107a,IFN-γ和TNF-α。图表显示了在不同的供体中CD107a的表达以及IFN-γ和TNF-α的蛋白丰度。
(B和C)分析三名非小细胞肺癌(NSCLC)患者的肿瘤或肿瘤周围组织中单个NK细胞。
(B)箱形图显示肿瘤或肿瘤周围组织中单个NK细胞的HIF1A(左上方),HIF1A靶基因(右上方)和IFNG基因表达(左下方)。散点图指示HIF1A和IFNG转录表达之间的相关性。
(C)肿瘤或肿瘤周围组织中单个NK细胞的NK-IL18-IFNG信号特征(左)及其与HIF1A转录表达的相关性(右)。
6.NK-IL18-IFNGhigh信号特征预示着不同癌症患者总体生存期的改善
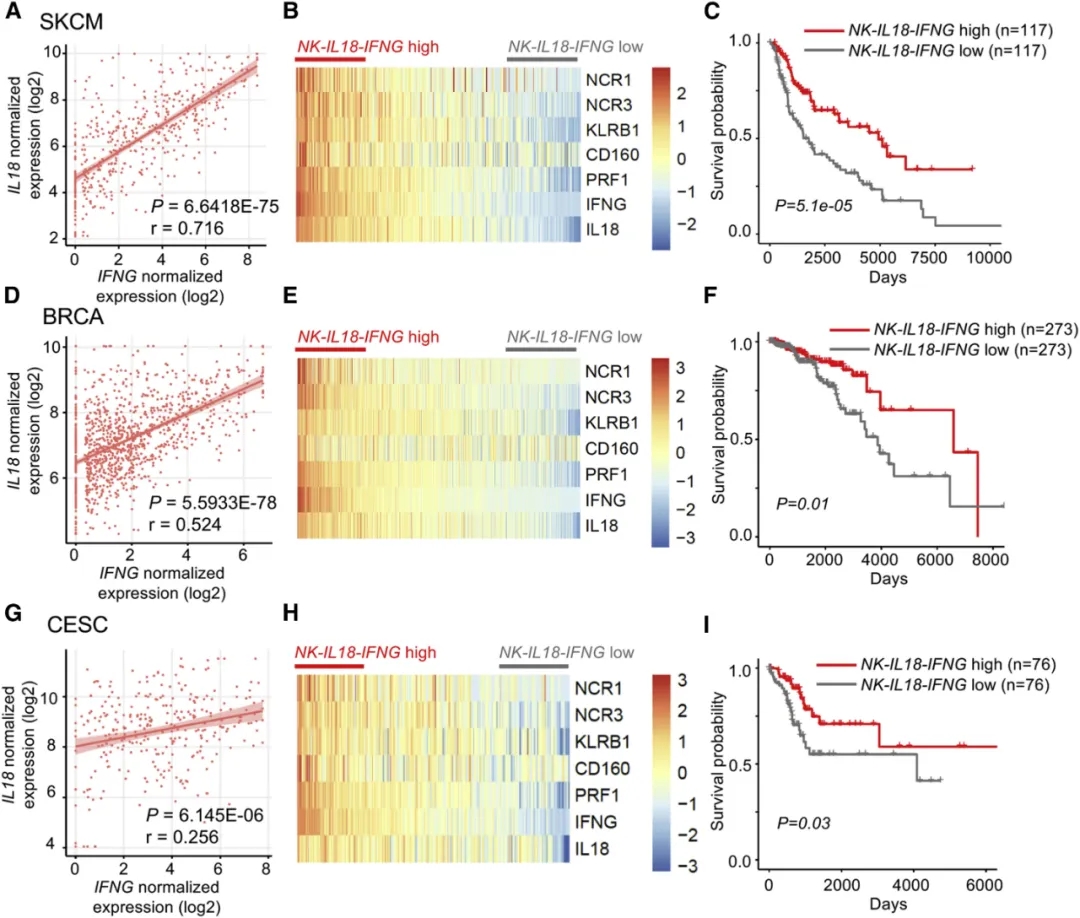
我们表明在肿瘤微环境中IL-18的存在导致NK细胞反应增强,表现为NF-κB激活和Ifng表达,在没有HIF-1α的情况下,进一步降低肿瘤生长。单个人肿瘤浸润的NK细胞中NK-IL18-IFNG特征与HIF1A表达负相关。因此,我们旨在分析人类肿瘤样品中的整体NK-IL18-IFNG信号是否可预测癌症患者生存期的改善。对癌症基因组图谱(TCGA)数据库中469位皮肤黑色素瘤(SKCM)患者的样本分析显示,SKCM肿瘤中IL18和IFNG基因表达呈正相关(图7A)。此外,我们发现NK细胞相关基因(NCR1, NCR3, KLRB1, CD160, and PRF1)的表达与IL18-IFNG基因表达正相关(图7B)。重要的是,在SKCM患者中与NK-IL18-IFNGlow相比,NK-IL18-IFNGhigh信号与更好的总体患者生存率相关(图7C)。在乳腺癌和宫颈癌患者中发现了相似的相关性(图7D-7I)。这些数据表明NK-IL18-IFNG信号在不同癌症患者中可能具有预后作用。图7. NK-IL18-IFNG信号特征与不同肿瘤患者中总体生存率的改善相关
(A,D和G)SKCM(皮肤黑色素瘤)(A),BRCA(乳腺浸润癌)(D)和CESC(宫颈鳞状细胞)(G)中IL18和IFNG基因表达的相关性,患者数据来自 TCGA数据库。
(B,E和H)与NK细胞相关的NCR1,NCR3,KLRB1,CD160和PRF1转录本以及IL18和IFNG转录本表达热图。
(C,F和I)比较高四分位数和低四分位数,NK-IL18-IFNG信号特征与癌症患者总体生存率的相关性。
讨论
肿瘤微环境中的免疫细胞表现出高度的异质性,其异质性由许多因素和细胞形成。ScRNA-seq作为一项功能强大的技术,,有助于鉴定一个细胞群体内的细胞多样性和异源转录特征。最近使用scRNA-seq进行的几项研究从小鼠和人类组织(如血液,脾脏,骨髓和子宫)中鉴定了器官特异性NK细胞特征。本研究提供了来自小鼠肿瘤的单个NK细胞的转录图谱,对包括激活和抑制受体和参与效应功能的分子的不同转录特征进行聚类,确定了一个Hif1a-/-肿瘤浸润NK亚型,表现出Ifng和Cd69的高表达。除了Ifng,这些细胞还显示Gzma和Gzmb的高表达和Prf1的中等表达,表明具有多功能的潜力。同时,这些细胞表现出抑制性检查点受体基因Pdcd1,Tigit和Ctla4的低转录,先前已报道了它们对NK细胞效应子功能的负面影响。尽管这些组合特征可能使Hif1a-/-NK细胞具有较高的抗肿瘤反应,但它们可能受到HIF-1α的差异调节。实际上,在WT NK细胞中检测到Prf1的最高表达,而且在两种基因型中NK细胞中都存在类似的颗粒酶编码转录物。值得注意的是,即使在富含WT NK细胞的簇中,效应分子(例如Prf1 / Gzm)也被差异表达,表明在肿瘤浸润的NK细胞内较高的转录异质性。
Hif1a缺乏的NK细胞在编码NF-κB和IκB家族成员以及多个NF-κB靶基因的转录本中富集。尽管某些靶标富集在大多数Hif1a-/-NK细胞中,但优先在Ifnghigh亚组中观察到其他靶标(Icam1,Ccl3,Ccl4,Nur77),这进一步支持了肿瘤浸润NK细胞的功能分离。 最近,已证明NK细胞产生的趋化因子对于招募DC1亚群到肿瘤微环境进而促进肿瘤排斥至关重要。 Hif1a-/-NK细胞中Ccl3和Ccl4编码的趋化因子上调,还是Hif1af / fNcr1iCreTg小鼠肿瘤组织中Ccl5和Xcl1的上调有助于整体的抗肿瘤免疫反应,值得进一步探究。
缺氧是调节HIF-1α稳定和活性的主要条件。暴露于低氧浓度的NK细胞其HIF-1α蛋白的丰度增加。据报道,在低氧条件下培养人类NK细胞会影响NK细胞活化性受体的表达以及包括IFN-γ在内的细胞因子和趋化因子的分泌。缺氧还与IL-15引发协同作用,并通过诱导糖酵解关键酶的基因表达进一步支持NK细胞功能。但是,缺氧和HIF-1α的影响可能取决于肿瘤微环境。暴露后早期,HIF-1α的快速稳定可确保对缺氧的急性细胞反应。长时间暴露于与实体瘤组织高度相关的缺氧环境会产生其他后果,包括细胞适应慢性低氧环境,HIF-1α可能在其中发挥重要作用。
细胞代谢调节是介导低氧适应和养分利用率变化的主要机制。在巨噬细胞中,HIF-1α被证明可控制好氧糖酵解,这对炎症反应和后天获得性免疫至关重要。在肿瘤细胞中,HIF-1α介导的糖酵解与细胞生长,增殖和凋亡有关。NK细胞产生的IFN-γ以特异性激活方式进行代谢调节。本研究表明,当体外暴露于低氧和炎性细胞因子(如IL-12和IL-18)时,WT和Hif1a-/-NK细胞表现出相似的ECAR,提示存在有氧糖酵解。然而,Hif1a-/-NK细胞的OCR较高,并且与IFN-γ的产生能力增强相关,表明Hif1a-/-NK细胞中效应功能增强的潜在代谢控制。因此,在没有HIF-1α介导的低氧适应性情况下,NK细胞可能能够充分利用氧化磷酸化的潜力来发挥其功能。
结论
研究者利用Hif1af/fNcr1iCreTg小鼠,通过ScRNA-Seq技术在肿瘤浸润性NK细胞中明确一不同的效应亚群,表明转录因子HIF-1α的抑制释放了NK细胞活性,且在人NK细胞中得以验证。总体生存率改善的实体瘤患者具有NK- IL18 -IFNGhigh特征。本研究加深了对肿瘤微环境中HIF-1α介导的NK细胞效应功能的机制理解。IL-18与NK特异性HIF-1α靶向的组合方法有望改善基于NK细胞敏感性的实体瘤免疫疗法。
扫描上面二维码在移动端打开阅读