2020年6月11日,Viela Bio的新型CD19抗体Inebilizumab获得FDA批准,用于治疗视神经脊髓炎谱系疾病(NMOSD),商品名为Uplizna。Inebilizumab最初由MedImmune开发,2018年2月Viela Bio从MedImmune独立出来。2019年5月,豪森药业以预付款+里程碑总金额2.2亿美元获得Inebilizumab的中国区权益。
Inebilizumab为靶向CD19、糖基化改造去除岩藻糖成分的IgG1亚型人源化抗体,氨基酸序列如下图。此前,FDA批准的CCR4抗体Poteligeo(Mogamulizumab)为首款获批的去岩藻糖抗体药物,第二款为罗氏CD20抗体Gazyva(Obinutuzumab)。葛兰素史克前不久申报上市的靶向BCMA的Belantamab mafodotin也为去除岩藻糖的ADC药物。去除岩藻糖成分,可以大幅提高ADCC活性。
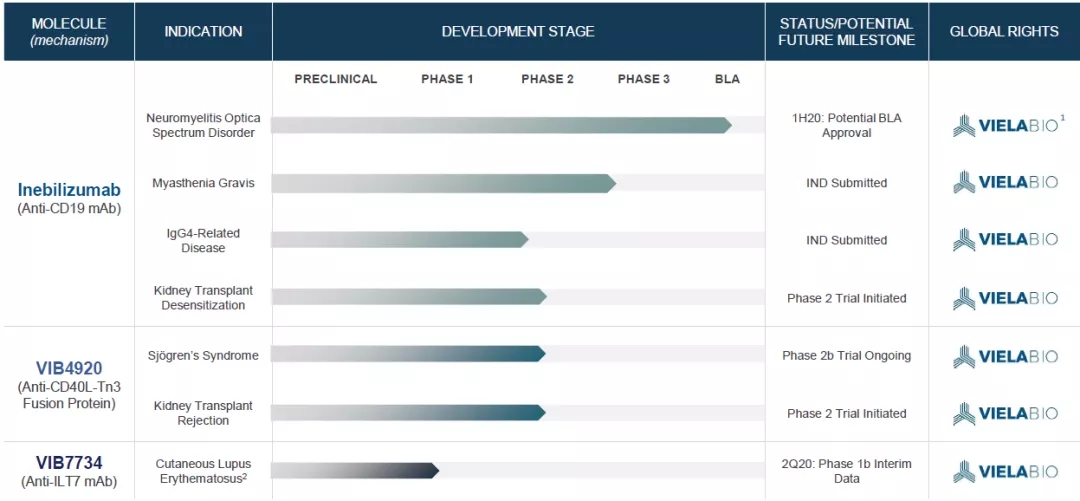
Viela Bio研发管线包括靶向CD19的Inebilizumab,靶向CD40L的类抗体药物VIB4920(今年初在中国申报临床)以及靶向ILT7的抗体VIB7734。构建起对抗自身免疫病的完整机制切入点。
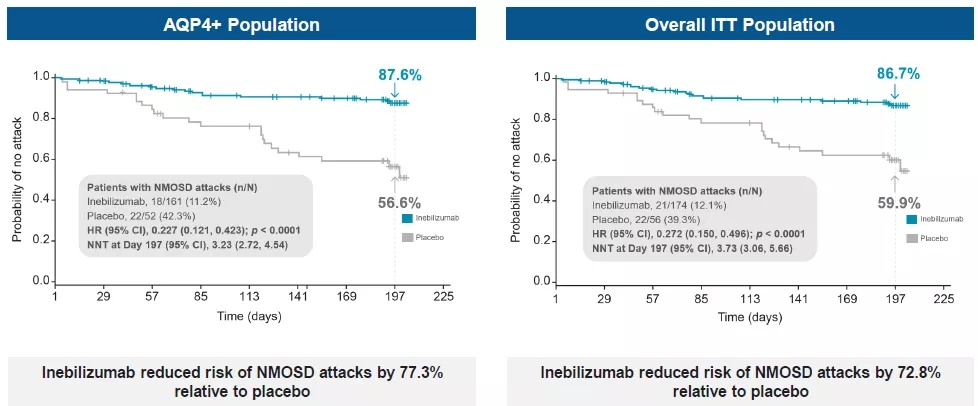
Inebilizumab能够清楚表达CD19的浆细胞,减少自身抗体的产生,缓解症状。在抗AQP4阳性患者中,相对安慰剂Inebilizumab将NMOSD的发作风险降低77.3%,全数据集这一降低幅度为72.8%。
此外,Viela Bio还在推进Inebilizumab治疗重症肌无力(gMG)、IgG4相关疾病、肾移植排免。
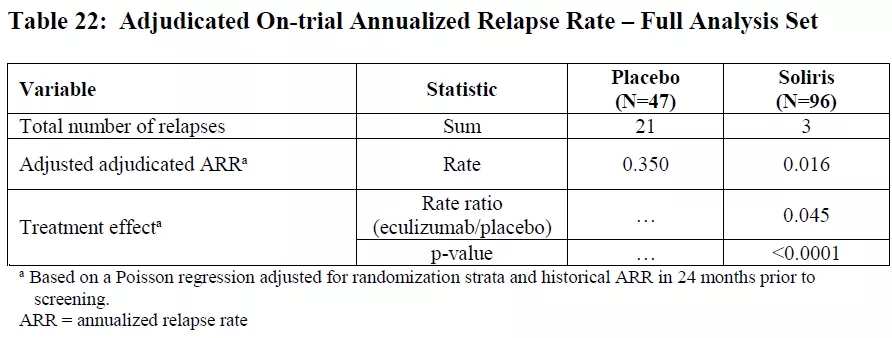
Inebilizumab是FDA批准的第二款NMOSD药物,此前的2019年6月,FDA批准C5抗体Soliris用于治疗NMOSD,Soliris可以将NMOSD发作次数降低96%(下图)。不过,由于抑制C5抑制了天然免疫的补体系统,Soliris仍然有脑膜炎球菌感染风险的黑框警告。
总结
扫描上面二维码在移动端打开阅读