背景
Dana-Farber癌症研究所的研究者分析了272例接受OncoPanel测序的胆道癌患者的体细胞变化。在135例肝内胆管癌队列中发现16例FGFR2融合(14%),还有5例(4%)携带有FGFR2胞外区插入/缺失突变,其中有2个病例带有相同的FGFR2框内缺失变异(p.H167_N173del)。研究者在体外证实该缺失变异为“致病”变异,两名携带FGFR2p.H167_N173del的患者遂接受了FGFR-1/2/3抑制剂(Debio-1347)的治疗。令人惊喜的是,2名患者均获得了超过11个月的持续性部分缓解(PR)。其中一位患者在发生Debio-1347耐药后进行二次活检,NGS检测发现了FGFR2激酶结构域突变(p.L617F), 随后证明为Debio-1347耐药突变。该患者遂接受了第二种FGFR抑制剂治疗,并达到了持续17个月的PR。在对第二种FGFR抑制剂具有抗性时,再次对肿瘤进行活检,发现新的潜在耐药突变BRAF p.L597Q。2例病人携带相同的FGFR2胞外区框内缺失突变,接受FGFR抑制剂治疗均获得了超过11个月的PR,其中一例接受2次FGFR抑制剂治疗获得的总缓解时间更是超过了28个月,这些数据表明FGFR2 p.H167_N173del极可能是除了融合/重排外新的对FGFR抑制剂敏感的变异类型。
这是个什么变异
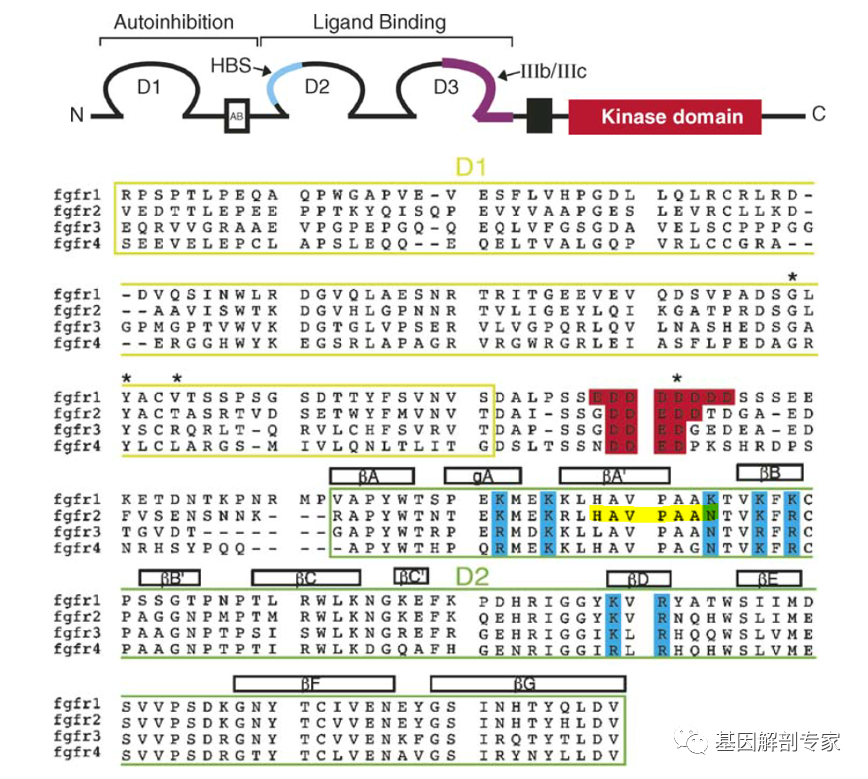
FGFR2p.H167_N173del,p.表示蛋白序列,数字表示氨基酸的位置,del表示缺失,该突变的含义是FGFR2第167-173的7个氨基酸发生了缺失,根据氨基酸编码原则,3个碱基对应1个氨基酸,可知在DNA层面缺失了21个碱基。这种缺失的碱基恰好是3的倍数不影响其他氨基酸编码的缺失便是框内缺失。FGFR家族有着相似的蛋白结构,胞外区3个球蛋白结构域D1,D2,D3,跨膜区以及激酶区。缺失的7个氨基酸(下图中黄色高亮区域HAVPAAN 7个氨基酸)位于D2结构域中的肝素结合区(HBS)。
图1 FGFR的序列和结构
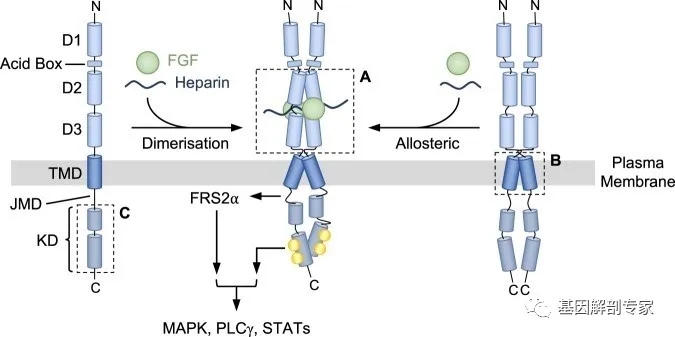
我们简单回忆一下上一篇文章中介绍的FGFR激活机制,在配体和肝素的诱导下,FGFR形成二聚体,导致激酶区的“反式”自磷酸化,进而激活下游信号通路(图2 中)。其中肝素结合的区域正是缺失7个氨基酸所在的HBS区。
突变所在HBS区有什么功能
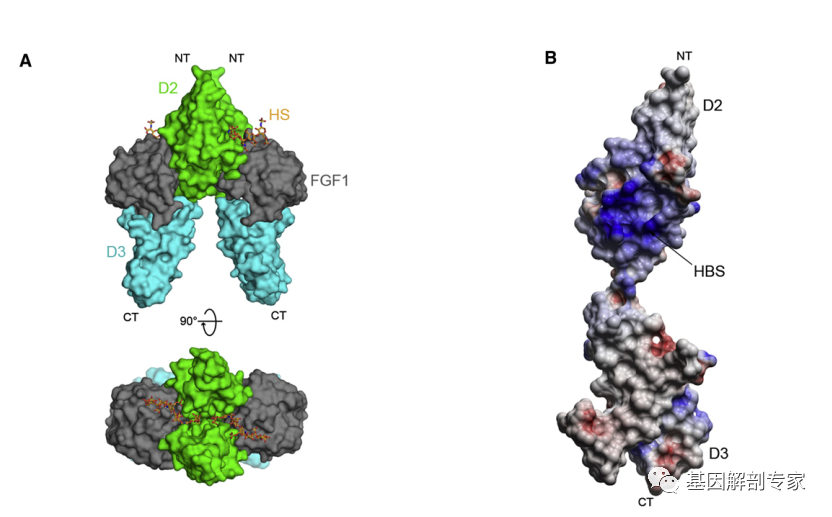
与其他的激酶受体不同,FGFR与其配体在组织分布上有很大的重叠,这种空间上的重叠就要求FGFR需要具有严格的“自我抑制”调控,否则极容易导致FGFR通路的异常激活。在FGFR胞外区的D1和D2结构域之间,有一段由酸性氨基酸组成的区域被称为酸性盒子(AB)区域。结构学研究表明这段带有负电荷的区域与肝素竞争性结合由碱性氨基酸构成带有正电荷的HBS区域(图 3B 蓝色区)。
图3 显示FGFR 胞外区和与肝素结合的HBS区域
这种竞争结合处于一种动态平衡中,通常情况下,AB区与HBS区结合能力更强,平衡倾向于FGFR2自我结合形成“封闭状态”。这种倾向于“自我抑制”的动态平衡使得FGFR既可以在一定条件下被FGF和肝素激活,也不会失去控制导致过度激活。
图4 FGFR 胞外区的“自我抑制”机制
该突变可能的致癌机理是什么
根据突变所在HBS区域的功能,我们不难做出下面的推测:一个偶然的“错误”产生了FGFR2p.H167_N173del突变,突变改变了HBS区域的氨基酸构成,导致了AB区与HBS区形成的“自我抑制”的平衡被打破,更多处于“展开”状态的FGFR2被附近的FGF和肝素结合,导致FGFR2通路持续激活,细胞获得了更强的增殖能力,而分化能力则减弱,又伴随着一些抑癌基因的失活最终变成了肿瘤细胞。
结语
细胞进化出如此精密的调控机制以应对机体复杂的功能需求,但有时也会出现一些意外,比如DNA的一些复制“错误”产生了上述的突变。尽管于群体而言,“错误”是生命进化的源泉,但于个体而言,便可能是生与死的差别。该突变对FGFR抑制剂疗效非常好,但作为一个相对罕见的变异,在同样相对罕见的胆管癌中,开展大规模临床实验验证的可能性微乎其微,自然也很难成为FDA批准的目标人群。不过总会有一些患者携带这类突变,当我们真正遇到的时候,也算是多了一种尝试。多了一些尝试,也便多了一些希望。
参考文献:
1. Session VMS.MD01.01 - Advancing Cancer ResearchThrough An International Cancer Registry: AACR Project GENIE Use Cases. FGFR2in-frame indels: A novel targetable alteration in intrahepaticcholangiocarcinoma.
2. Structure.2012 Jan 11;20(1):77-88. doi:10.1016/j.str.2011.10.022.
3. Cytokine Growth Factor Rev. 2005Apr;16(2):107-37.
4. Proc Natl Acad Sci U S A. 2004 Jan27;101(4):935-40. Epub 2004 Jan 19.
扫描上面二维码在移动端打开阅读