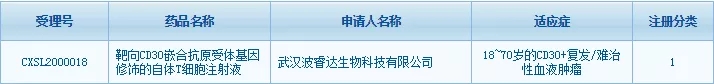
4月21日,武汉波睿达生物科技有限公司自主研发的BRD-01产品—靶向CD30嵌合抗原受体基因修饰的自体T细胞注射液获得国家药品监督管理局(NMPA)药品审评中心(CDE)的临床试验默示许可,即将开展临床试验。该产品是中国被受理的第一个以CD30为靶点的CAR-T细胞治疗产品。
1月22日,其获得国家药品监督管理局(NMPA)药品审评中心(CDE)受理(受理号:CXSL2000018)。
▲图片来源:CDE
2019年8月,武汉波睿达生物科技有限公司收到国家知识产权局一项发明专利授予专利权的通知:《一种靶向表达CD30表面抗原的细胞的嵌合抗原受体(专利号:201611246081.9)》被授予专利权。
CD30是位于激活的淋巴细胞上的一种膜蛋白受体,是肿瘤坏死因子受体超家族的一员,主要特异性的表达于霍奇金淋巴瘤及间变大细胞淋巴瘤细胞表面,是霍奇金淋巴瘤及间变大细胞淋巴瘤的肿瘤标记物,此专利提供了一种靶向表达CD30表面抗原的嵌合抗原受体。此项发明专利的取得,是波睿达生物前期药学研究、临床前动物实验和非注册临床试验数据的印证。
CAR-T细胞疗法是目前肿瘤细胞免疫治疗领域最热的研究方向之一,也是最有希望的新疗法。鉴于国内的CAR-T细胞药品扎堆CD19、BCMA靶点,特别是CD19靶点,临床申请获得CDE受理的CAR-T产品占比超过80%,所以差异化靶点的筛选非常有必要,在众多靶点中CD30是最具有潜力一个。
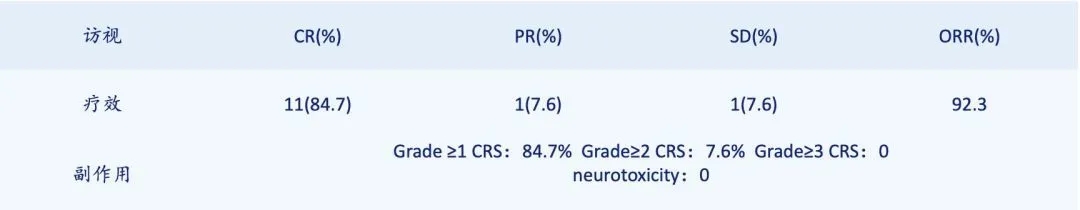
该产品的研发历时五年,从靶点的选择与验证,抗体的筛选,CAR-T细胞的制备,体内外杀瘤和安全性评估以及研究者发起的临床实验均由波睿达生物独立主导完成。基于蛋白质阵列和组织交叉等的安全性实验,我们发现BRD-01产品对于特异性的识别CD30包内段蛋白且仅在淋巴结,脾脏等少数器官中发现少量的产品相互作用,动物毒理学研究结果也表明BRD-01产品安全性良好。这意味着该产品具有非常高的安全性
此次FDA授权Tessa公司CD30 CAR-T产品更加确定以CD30为靶点的CAR-T产品的有效性与安全性,同时也表示CD30 CAR-T具有很好成药潜能。这也证明我司在产品研发上有着优秀的预见性和扎实的创新性。基于此次BRD-01产品授权的机遇,波睿达生物将和全球优秀的CAR-T研发企业一道,推出更多、更有效的肿瘤治疗产品。
扫描上面二维码在移动端打开阅读