许多研究都在关注小鼠以及人类固有淋巴细胞Innate lymphoid cells (ILCs) 的功能特征。目前ILCs包括细胞毒性ILC(如NK细胞)和辅助性ILC(ILC1-3)。研究发现ILCs参与抵御感染、伤口愈合以及肿瘤等多个过程中【1】。与获得性免疫不同,ILCs缺乏重新排列的抗原特异性受体,而且在外周淋巴结中很少见,主要以组织驻留细胞的形式定位在非淋巴组织中【2】。ILC2能够调控机体对病原体以及共生菌的免疫反应。尽管在肿瘤组织中存在ILC2细胞,但是它在肿瘤免疫中的作用尚不清楚。
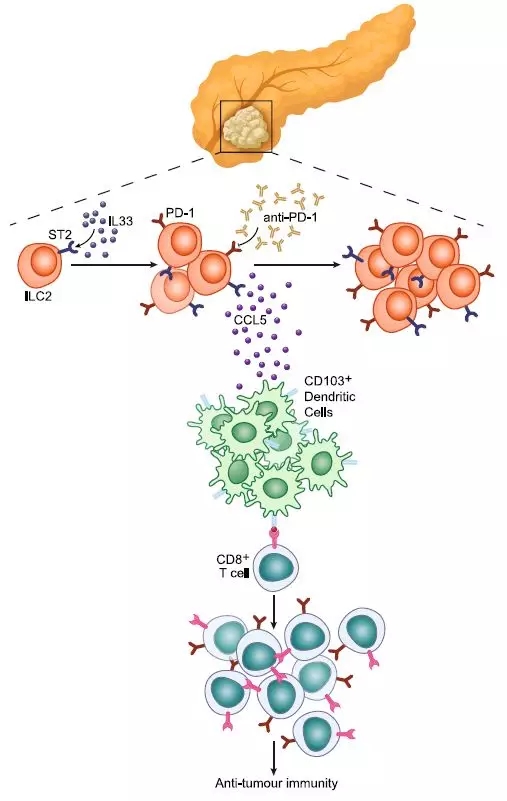
近日,来自美国Memorial Sloan Kettering肿瘤中心的Taha Merghoub和Vinod P. Balachandran课题组合作在Nature上发表了题为ILC2s amplify PD-1 blockade by activating tissue-specific cancer immunity的文章。该研究发现浸润在胰腺导管腺癌(pancreatic ductal adenocarcinomas PDACs)中的肿瘤ILC2(TILC2)能够被IL33(Interleukin-33,白细胞介素-33)激活而抑制肿瘤生长,抗体阻断PD-1可以降低TILC2固有的PD-1抑制,增强抗肿瘤免疫反应。
作者首先在人PDACs检测ILC2的浸润情况发现,人PDACs组织中表达有ILC的标志物(CD25、CD127)以及ILC2的标志物(IL33R,又称ST2和GATA3)。TILC2在CD8+T细胞富集的肿瘤组织中浸润数量多,TILC2细胞含量丰富和IL33表达高的患者生存期长。在胰腺癌小鼠模型(Kras和p53突变的KPC小鼠和PDAC原位小鼠)中检测ILC2发现肿瘤组织中TILC2数量增加,与人肿瘤组织中表型类似,但是邻近器官ILC2细胞没有明显增加,这与ILC2组织驻留型特点一致。这些结果表明ILC2是人和小鼠PDAC中特征性的细胞类型。
接下来作者期望找到肿瘤组织中富集ILC2细胞的信号分子。作者注意到IL33是在PDAC组织中激活ILC细胞的表达最高的细胞因子,而且IL33在人和小鼠PDAC中髓系细胞中表达较高。在IL33敲除小鼠中构建的PDAC模型TILC2的数量和相关细胞因子均明显减少。重组IL33 (rIL33) 则能够在Rag2敲除的小鼠中能够促进PDAC组织中ILC2的扩增。进一步检测发现IL33能够激活TILC2,从而激活CD8+T细胞抗肿瘤免疫反应。而利用rIL33处理发现rIL33通过激活TILC2释放CCL5,募集CD103+树突状细胞,激活CD8+T细胞抗肿瘤免疫反应。
目前阻断免疫检查点是否对ILC2产生影响还未知。作者利用单细胞转录组分析发现TILC2中PD-1的表达较弱,在基线水平。用rIL33刺激后TILC2中PD-1的表达水平上升,而不影响引流淋巴结中ILC2中PD-1的表达。深入分析发现PD-1的阻断能够直接抑制TILC2中PD-1信号通路而激活TILC2细胞,而不是作用于T细胞或者其他途径间接激活TILC2,达到促进肿瘤免疫治疗的效果。之后作者选取了免疫细胞浸润少的KPC小鼠模型---IL33的表达低的肿瘤中CD8+T细胞的数量只有IL33表达高的肿瘤组织中数量的50%或者更少,生存期中位数只有两周。在这些小鼠模型中同时进行rIL33和抗PD-1处理发现,近一半的小鼠肿瘤体积变小,生存期得到延长。在人PDAC肿瘤样本中检测发现近60%的肿瘤组织中PD-1+的TILC2和T细胞丰度都较低,两种细胞数量存在明显相关性,IL33的表达与PD-1表达相关性也较显著。因为PD-1的表达与更长的生存期相关,因此本研究结果表明IL33-PD-1轴促进PDAC肿瘤患者良好预后。换句话说,白细胞介素-33刺激的肿瘤固有淋巴细胞对PD-1抗体有更好的响应。
本研究探讨了ILC2在PDAC肿瘤以及抗肿瘤免疫反应中的重要功能。由于激活的ILC2和T细胞共享多种免疫调节分子,而且二者在肿瘤组织中往往同时出现,因此有必要进一步研究免疫检查点阻断剂同时靶向两种细胞在抗肿瘤免疫反应中的效果。
参考文献
1. Vivier, E., van de Pavert, S. A., Cooper, M. D. & Belz, G. T. The evolution of innate lymphoid cells. Nat. Immunol. 21, 790–794 (2016).,
2. Gasteiger, G., Fan, X., Dikiy, S., Lee, S. Y. & Rudensky, A. Y. Tissue residency of innate lymphoid cells in lymphoid and nonlymphoid organs. Science 350, 981–985 (2015).
扫描上面二维码在移动端打开阅读