导读
2020年4月19日,发表在影响因子14.2的Annals of Oncology期刊上的一项研究结果发现,相比单独的TMB,经过HLA校正的TMB对PD-1/PD-L1抑制剂具有更好的预测价值。下面,小编就为大家详细解读一下这项研究结果。
划重点
1. 非小细胞肺癌中,仅使用TMB作为生物标志物时,对ICIs应答的预测不够准确;
2.通过HLA校正的TMB算法,即TMB联合HLA LOH,改善了TMB对生存期预测的准确性;
3.HLA校正的TMB的预测和预后价值并不局限于某一些癌种;
4.HLA校正的TMB可以作为筛选免疫治疗获益人群新的策略。
简介
针对PD-1/PD-L1通路的免疫检查点抑制剂改善了许多晚期癌种的生存期,临床研究发现一旦对免疫治疗产生应答,将实现长期获益。尽管如此,免疫治疗在大多数癌种中的应答率较低(20%~30%),仅少部分患者能从该治疗中获益,因此使用有效的生物标志物筛选对免疫治疗获益的人群显得十分重要。
既往,研究发现在一些癌种中,TMB高的患者使用ICIs的治疗效果更好。但TMB的分布在应答和无应答患者中的具有显著的重叠,说明使用TMB预测药物疗效具有较高的假阳性和假阴性率,因此仅使用TMB作为生物标志物,对ICIs应答的预测不够准确。
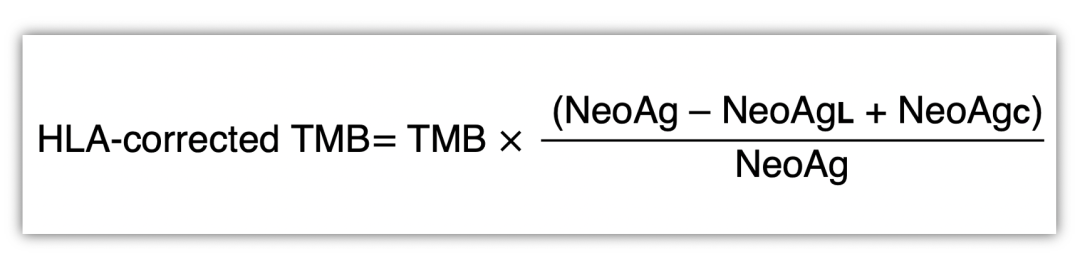
最近,研究发现造成免疫逃逸的抗原呈递通路中的基因改变可能可以作为潜在的生物标志物预测ICIs的疗效。该研究使用WES方法对198位晚期非小细胞肺癌患者免疫治疗前(anti-PD-1或anti-PD-L1单药治疗)的肿瘤样本进行了测序,开发了一种新的算法用于表征肿瘤抗原呈递的改变与免疫治疗疗效的相关性,即HLA校正的TMB。该算法如下:
TMB:非同义突变数量(SNV和Indels);
NeoAg:生信算法预测的新生抗原负荷;
NeoAgL:与丢失的HLA等位基因结合的新生抗原,当没有HLA LOH时,数值为0;
NeoAgC:既能与丢失的HLA等位基因结合,又能与仍然存在的等位基因结合的新生抗原,当没有HLA LOH时,数值为0。
主要研究成果
与既往研究一致,对免疫治疗产生应答的患者的TMB显著高于无应答患者(中位TMB 194 vs 131 mutations)。
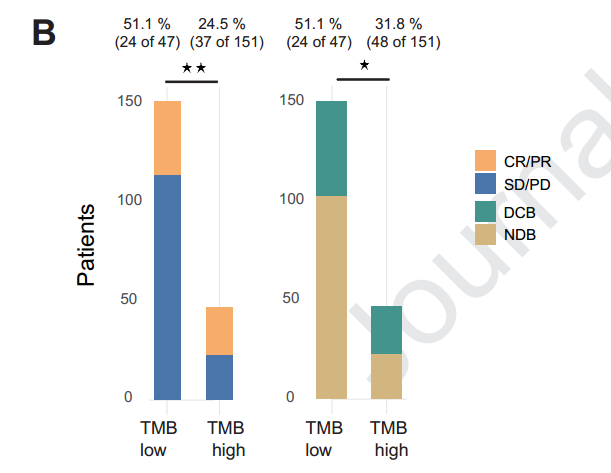
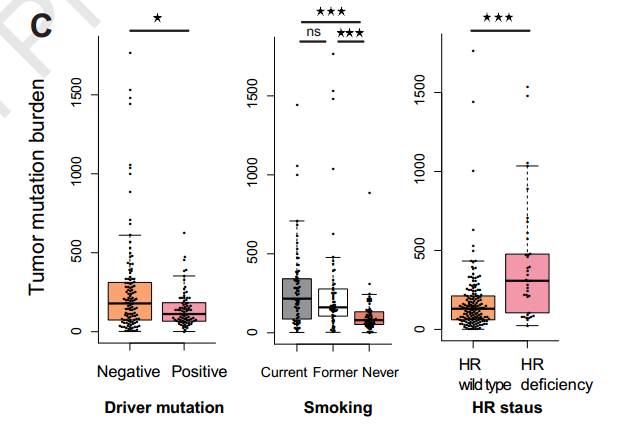
将本研究队列与另外一个使用免疫治疗的非小细胞肺癌独立队列结合,定义TMB数值位于人群前25%的为TMB-H,发现高的TMB与改善的PFS相关。然而,针对TMB与ORR相关性的AUC仅为0.62,与DCB的AUC仅为0.56,表明单独使用TMB作为ORR和DCB预测的标志物具有较高的假阳性和假阴性率。
02
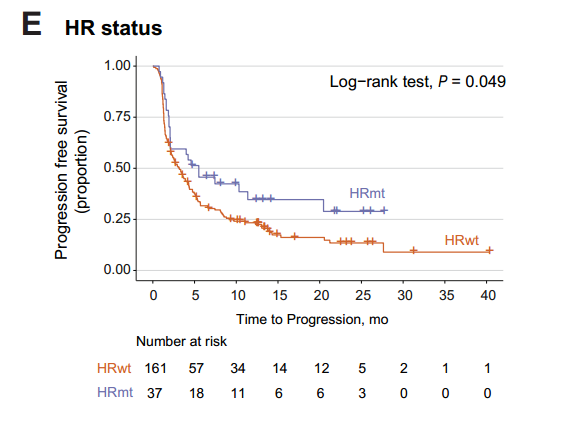
HR基因突变与TMB升高及ICIs获益相关
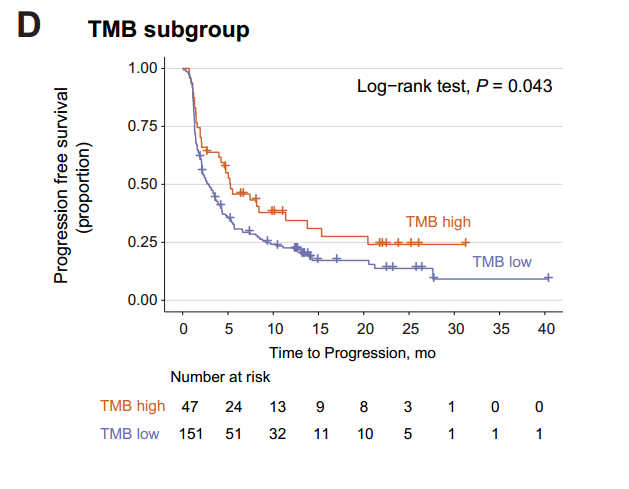
HR缺陷在37个患者中观察到,这些患者的TMB更高并且拥有更长的PFS。多变量模型分析中,在校正年龄、性别、ECOG评分、吸烟、病理类型、PD-L1表达后,HRD仍然是ICIs应答的独立预测因子。
03
PD-L1表达与ICIs疗效的相关性
使用DAKO的22C3抗体对PD-L1表达进行检测,PD-L1≥50%的患者ORR为42%,DCB为44%。对免疫治疗产生应答的患者与无应答患者相比,或DCB与NDB的患者相比,PD-L1表达均显著升高。然而,与TMB类似,单独使用PD-L1表达,对ICIs应答的预测不够准确,AUC仅为0.66。
04
抗原呈递通路突变与ICIs疗效相关性
研究队列中,抗原呈递机制中的截断或有害突变发生很少,未能评估其相关性。此外,未发现STK11以及CNA与药物疗效的相关性。
05
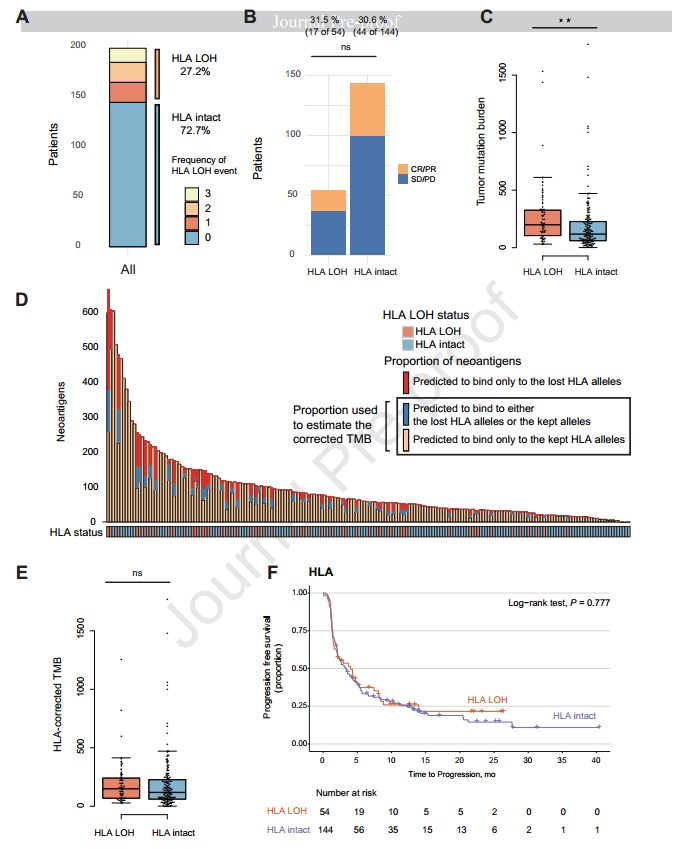
HLA-I类基因LOH与TMB
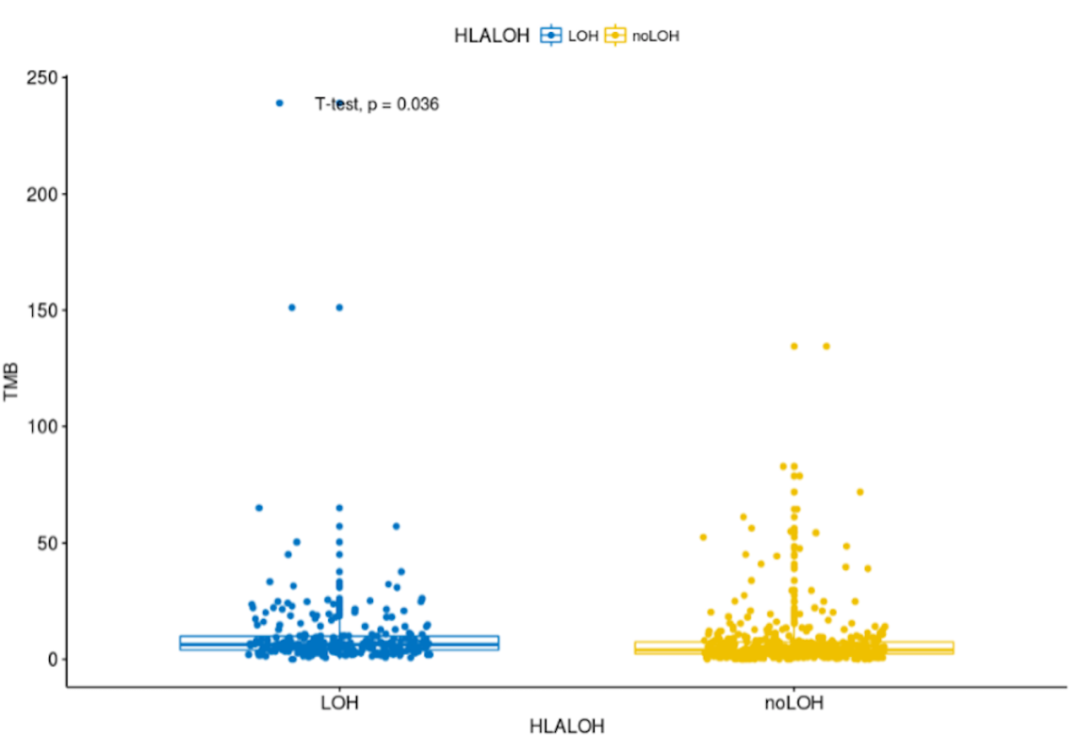
在198位非小细胞肺癌患者中,54位携带HLA-I类基因的LOH。与无HLA LOH的相比,HLA LOH的患者拥有更高的体细胞非同义突变(中位TMB 199 vs 118 mutations),与之前的研究结果一致。另外,研究发现HLA LOH与抗PD-1药物应答无关。
在HLA LOH的患者中观察到的TMB升高是否是由于新生抗原结合在了丢失的HLA等位基因上使得亚克隆突变(新生抗原)累积导致的?因为之前在Cell上发表的研究观察到,HLA LOH的患者,TMB升高是由于亚克隆新生抗原结合到了丢失的HLA等位基因上。为了验证这一观点,研究人员开发了使用HLA校正TMB的算法,结果显示HLA LOH的患者相对于无HLA LOH的患者,HLA校正的TMB并未显著升高(中位HLA校正的TMB 149 vs 118 mutations)。
06
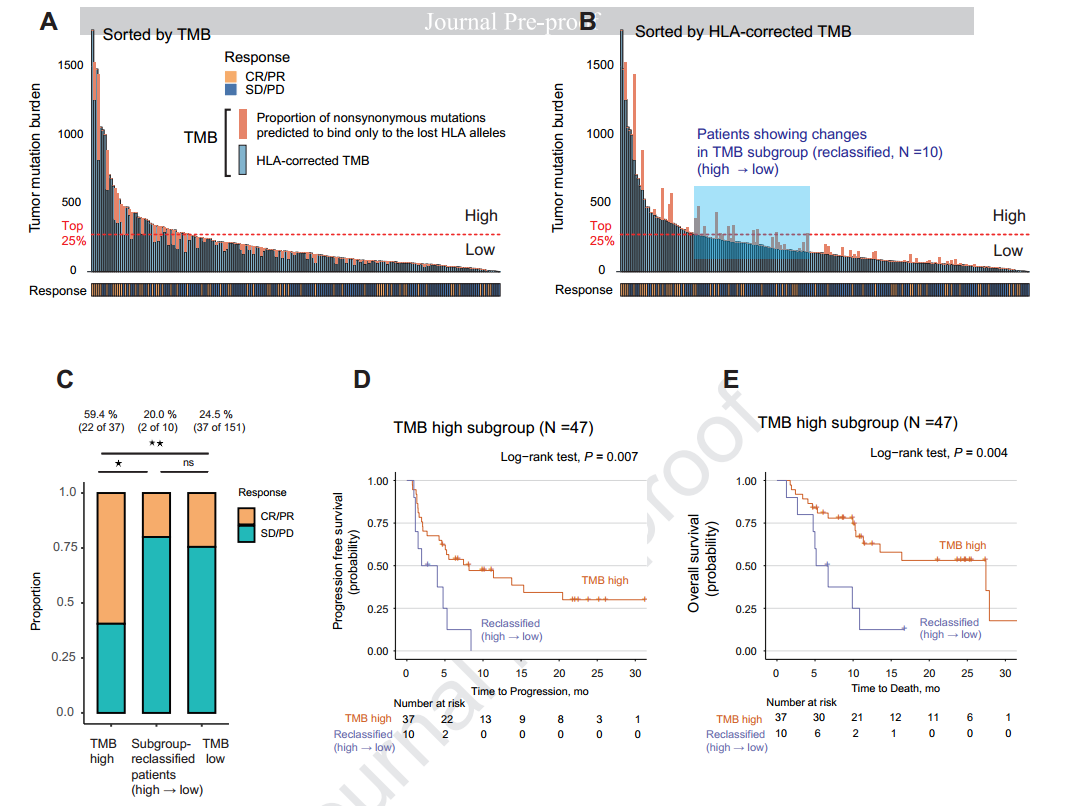
HLA校正的TMB提高了预测价值
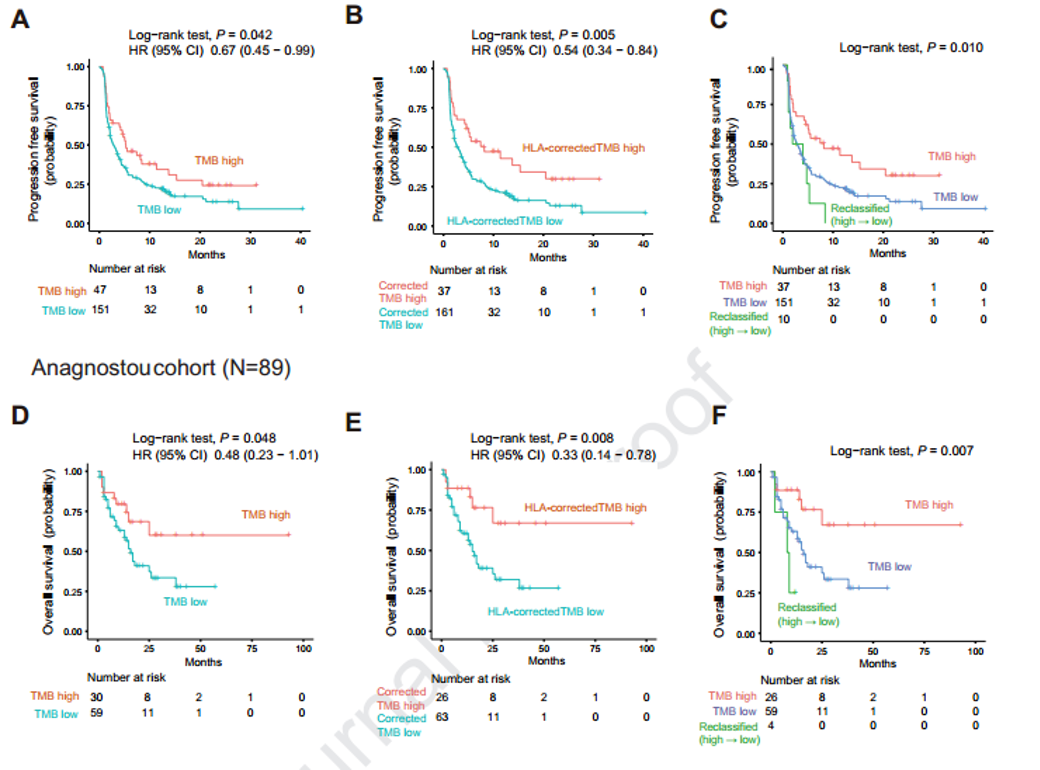
进一步发现,HLA校正的TMB相对于传统方法计算的TMB,具有更好的预测价值。在多变量分析中,HLA校正的TMB对PFS和OS显示出很好的预测价值(HLA校正的TMB高,PFS HR =0.45 P=0.004、OS HR=0.44 P=0.015),而传统方法计算的TMB与OS无显著相关性。
为验证这一发现,来自另外一个包含89位使用ICIs治疗的非小细胞肺癌独立队列的研究显示HLA校正的TMB提高了传统方法计算TMB对生存期的预测能力。此外,在黑色素瘤队列中也发现了一致的结论。
讨论
该研究发现无论单独使用TMB或PD-L1都不能很好地预测ICIs药物的疗效。通过对抗原呈递机制的探索发现,HLA LOH的患者的TMB相对于无HLA LOH的患者而言更高,这一发现部分解释了为何一些TMB-H的患者对药物不能产生应答。
HLA作为抗原呈递的关键物质,在抗肿瘤免疫应答中发挥重要作用。若突变产生的新生抗原对应的HLA丢失且没有其他HLA等位基因能够与该抗原结合,则可能会降低肿瘤的免疫原性,从而使得免疫治疗疗效不佳。基于此,研究者开发了使用HLA校正TMB的算法,这种算法将那些不能成为潜在新生抗原的突变删除,从而更好地反映了肿瘤的免疫原性。
另外,值得注意的是,文章并未发现单独的HLA LOH与免疫药物疗效的相关性,说明丢失的等位基因如果没有对应的新生抗原呈递,或者对应的新生抗原存在其他HLA等位基因进行呈递(补偿效应),都不会真正地影响免疫药物的疗效。因此,在分析HLA LOH时必须同时考虑其有无对应的新生抗原或有没有补偿效应发生,进一步强调了TMB与HLA LOH联合检测的意义。
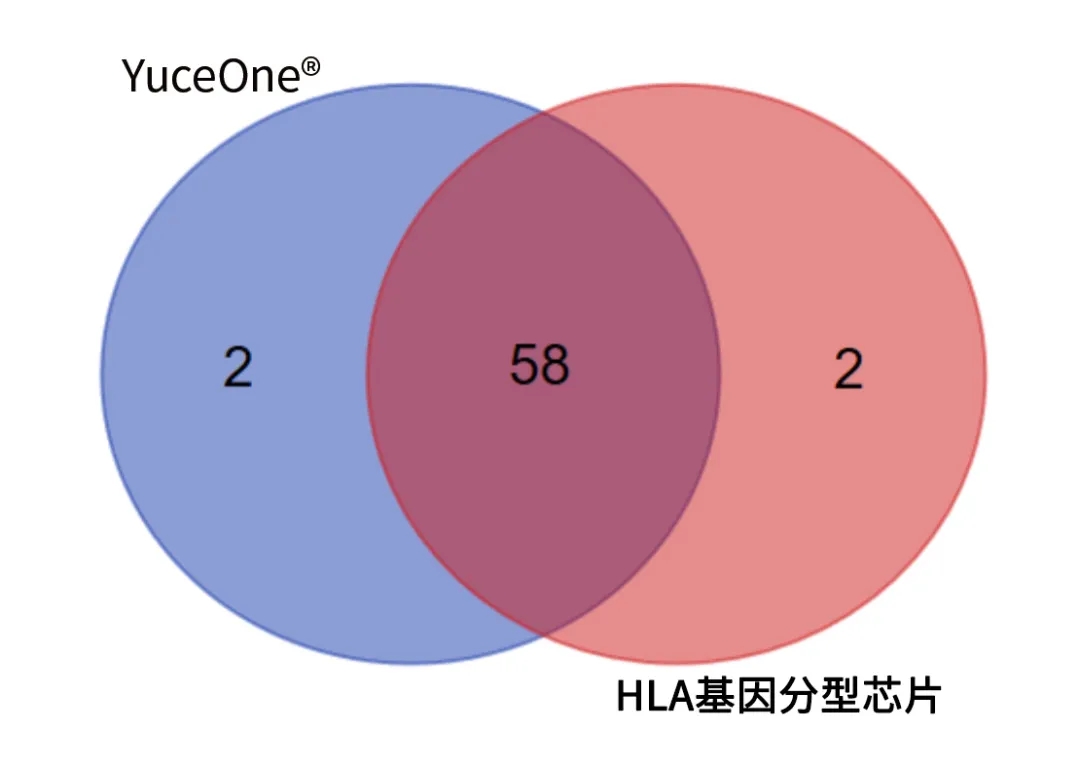
裕策生物作为专注肿瘤免疫的公司,拥有国内首个包含HLA LOH检测的肿瘤免疫用药评估产品,在免疫用药评估上拥有很高的前瞻性和科学性。由于HLA复合体呈现高度的多态性,在各人群中的分型不一,因此裕策生物的大Panel产品YuceOne® Plus系列和YuceOne® ICIs系列所用芯片专门针对中国人群的HLA分型进行了捕获探针的优化,使得分型更为准确、捕获率更高,与金标准相比,一致性为96.67%。
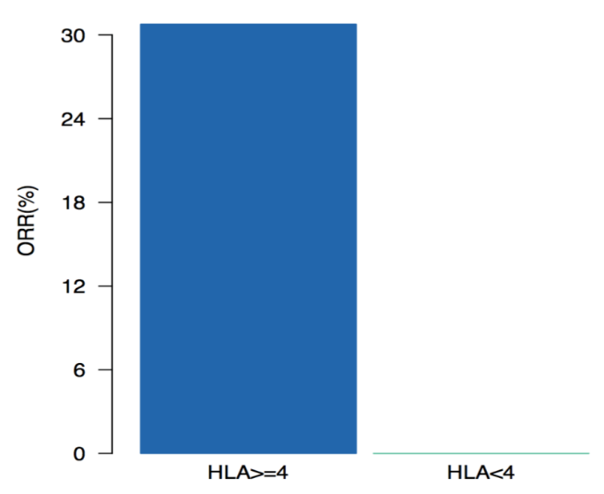
另外,裕策生物在HLA LOH分析上面,并非单独分析有或无,而是判断HLA LOH的程度,即3个等位基因都发生缺失还是1~2个等位基因发生缺失。裕策生物天梯计划的研究数据显示,等位基因缺失程度不同,与药物疗效的相关性不同,HLA-A/B/C三个等位基因缺失的患者,对药物的应答率为0,而仅1~2个缺失的患者,对免疫治疗仍然有一定的应答。
HLA LOH的缺失程度解释了为什么在文献当中所发现的仅考虑HLA LOH有或无,并不一定与药物疗效相关的情况。因为等位基因丢失得越多,与之对应的新生抗原无法被呈递的概率越大,发生补偿效应的概率越小,因此分析HLA LOH的程度与文献当中使用HLA校正TMB有异曲同工之妙,都更能反映肿瘤的免疫原性。
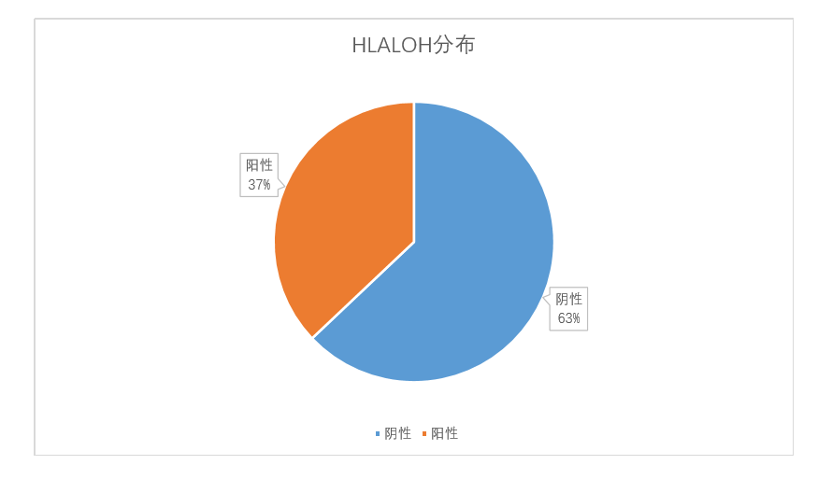
HLA-I类基因 LOH的发生比例非常高,裕策生物临床样本数据统计,HLA-I类基因在泛癌种当中发生LOH的比例为37%,这与文献报道的在非小细胞肺癌中的比例为40%一致。
并且同样发现,HLA LOH更容易出现在TMB-H的患者当中,因此仅仅评估TMB,但不知道TMB-H背后的原因,可能会给出错误的用药指导。
裕策生物的大Panel产品YuceOne® Plus系列和YuceOne® ICIs系列同时包含TMB、HLA LOH等多个指标,可以为临床用药提供精确的指导。
参考文献:
Ann Oncol. 2020 Apr 19;S0923-7534(20)39295-4. doi: 10.1016/j.annonc.2020.04.004.
扫描上面二维码在移动端打开阅读