4月27日,本是一年一度医药行业的饕餮盛宴,全世界众多肿瘤医生和制药公司的专家们欢聚一堂,畅谈肿瘤新进展的的美国癌症研究协会年会(AACR),因新冠肺炎病毒(COVID-19)疫情的肆虐,会议首次以虚拟会议的形式在线上举行。
通过网络,世界各地的癌症研究学者们分享了癌症研发领域的最新结果。这段时间,咚咚将整理诸多重要临床数据以飨读者。
会间,Iovance Biotherapeutics公司公布的肿瘤浸润淋巴细胞(TIL),引起了很多人的关注。I期临床数据显示:
针对12名PD-1耐药的、并且疾病进展的非小细胞肺癌患者,有效率达25%,其中2名患者达到持久的完全缓解。
在此次公布的TIL细胞疗法治疗非小细胞肺癌(NSCLC)患者的I期临床试验结果中,共纳入16名患者接受TIL治疗,其中12名患者可以被评估。
在中位随访时间为1.4年时,3名患者得到确认的缓解,其中两名患者达到完全缓解,这两名患者的缓解持续时间已经接近1年。
大多数患者的肿瘤在接受TIL治疗后有所缩小,在接受治疗后的第一次CT扫描时,肿瘤病变直径平均缩小38%。
需要指明一点,临床收治的这些患者均是PD-1耐药的、并且疾病进展的非小细胞肺癌患者,是非常难治的患者,后续并无可行的有效的治疗方案。而TIL疗法能过取得如此成绩,实属不易。
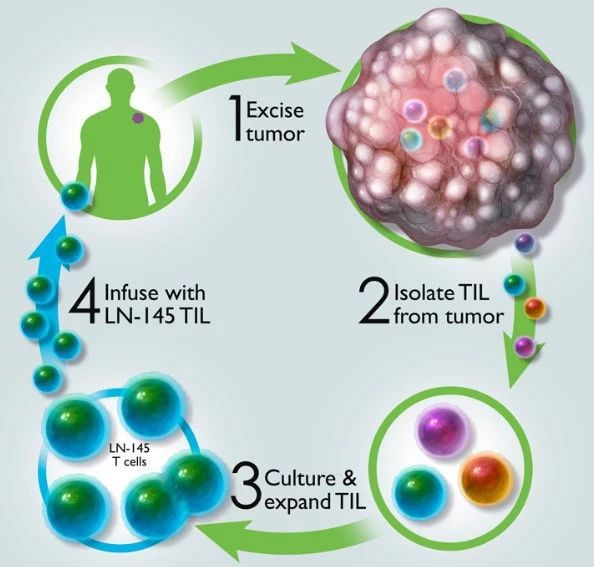
就目前来看,TIL免疫疗法能在多种实体瘤的后线治疗中发挥作用,是非常具有潜力的一种细胞免疫疗法。
美国FDA已经授予了LN-145针对晚期宫颈癌突破性疗法地位,TIL免疫疗法很有可能是未来免疫细胞疗法领域的一颗明星。
就在AACR大会火热进行的同时,FDA也不忘凑下热闹!
02 EGFR 20号插入突变“潜力股”——mobocertinib获美国FDA突破性药物资格!
4月27日,同日,FDA已授予mobocertinib(TAK-788)突破性药物资格(BTD),用于治疗接受含铂化疗期间或之后病情进展、携带表皮生长因子受体(EGFR)第20号外显子插入突变的转移性非小细胞肺癌(NSCLC)患者。
简单介绍一下,EGFR 20号插入突变患者仅占NSCLC患者的1-2%,预后比其他EGFR突变差,目前还没有批准的治疗方案,当前可用的EGFR靶向药和化疗对这类患者临床效果有限。
mobocertinib是一种强效的小分子酪氨酸激酶抑制剂(TKI),专为选择性靶向EGFR和HER2第20号外显子插入突变而设计。在2019年,美国FDA授予了mobocertinib孤儿药资格,用于治疗EGFR突变或HER2突变(包括20号插入突变)的肺癌患者。
另外,突破性药物资格(BTD)是FDA的一种新药评审方式,获得BTD的药物,在研发时能得到包括FDA特别关照,在新药上市审查有资格进行滚动审查和优先审查,以保障在最短时间内为患者提供新的治疗选择。
此次,FDA授予mobocertinib突破性药物资格,是基于一项I/II期研究。入组的为系统化疗失败的局部晚期或转移的NSCLC患者,且携带EGFR 20号插入突变。
数据显示:mobocertinib治疗的中位无进展生存期(PFS)为7.3个月、总缓解率(ORR)为43%(n=12/28)。
研究中,mobocertinib的安全性可控,最常见的治疗相关不良事件是腹泻(85%)、恶心(43%)、皮疹(36%)、呕吐(29%)和食欲下降(25%)。
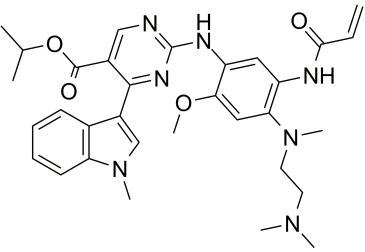

mobocertinib化学结构式(图片来源:medchemexpress.cn)
[1]. CT056 - Durable complete responses to adoptive cell transfer using tumor infiltrating lymphocytes (TIL) in non-small cell lung cancer (NSCLC): A phase I trial. Retrieved April 27, 2020, from https://www.abstractsonline.com/pp8/#!/9045/presentation/10763
[2]. Takeda Announces U.S. FDA Breakthrough Therapy Designation for Mobocertinib (TAK-788) for the Treatment of NSCLC Patients with EGFR Exon 20 Insertion Mutations

扫描上面二维码在移动端打开阅读