2020年5月29日至5月31日,一年一度的全球肿瘤领域盛会——美国临床肿瘤学会(ASCO)年会首次在线上召开,以多种形式传递肿瘤学最新进展,分享多学科观点,探讨未来发展。信达生物有7项重要研究发布,本文谨介绍第一部分的内容。
全瘤种
【摘要3062】IBI318作为首款双特异性抗PD-1/PD-L1药物治疗晚期肿瘤的Ⅰa期剂量递增临床研究
该研究为Ⅰa/Ⅰb期研究,所纳入的患者为晚期和/或难治性的实体瘤或血液系统恶性肿瘤,进行IBI318的治疗,采用加速滴定结合改良的毒性概率区间-2设计,药物剂量从0.3mg爬坡至600mg(8个队列),以28天为剂量限制性毒性观察期。对于没有剂量限制性毒性的患者采取q2w治疗,每6周进行1次评估。
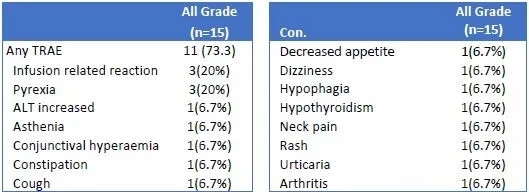
共15例至少经一线治疗后失败的患者入组,中位治疗时间为6.1周,患者对IBI318显示出了较好的耐受性,在已完成的 0.3mg至300mg之间,无剂量限制性毒性事件的发生。15例患者中11例出现治疗相关不良事件,最常见的为发热(1/2级,20.0%)以及药物输注相关不良反应(1/2级,20.0%)。在300mg组中1例患者出现免疫相关不良事件(2级关节炎),无≥3级治疗相关不良事件发生。15例患者中,12例患者进行过至少1次的肿瘤评估。在剂量为10mg及以上组的9例患者中,3例获部分缓解(PR)。整个研究中,共有10例患者因疾病进展(8例)和不良事件(2例,与治疗无关的4级肺部感染和4级上消化道出血)而中断治疗。
徐瑞华教授点评
徐瑞华 教授 医学博士 博士生导师
中山大学肿瘤防治中心主任、院长、所长
华南肿瘤学国家重点实验室主任
肿瘤医学省部共建协同创新中心主任
国家新药(抗肿瘤药物)临床试验中心主任
教授,博士生导师,入选国家百千万人才工程,国务院政府特殊津贴专家,南粤百杰
教育部科技委生物与医学学部委员
中国抗癌协会副理事长
中国临床肿瘤学会(CSCO)副理事长
中国医药生物技术协会副理事长
广东省抗癌协会理事长
中国抗癌协会靶向治疗专业委员会主任委员
中国临床肿瘤学会胃癌专家委员会主任委员
中国临床肿瘤学会肠癌专家委员会候任主委
《Cancer Communications》主编
国家食品药品监督管理局(CFDA)药物审评咨询专家
徐瑞华教授:IBI318作为首款抗PD-1/PD-L1的双特异性抗体,可以提供强大的抗肿瘤活性。本研究显示IBI318相对安全,患者对其耐受性较好,在晚期肿瘤的治疗中具备一定的前景。如今,正在进行该药600mg q2w的临床研究,我们共同期待最终结果。
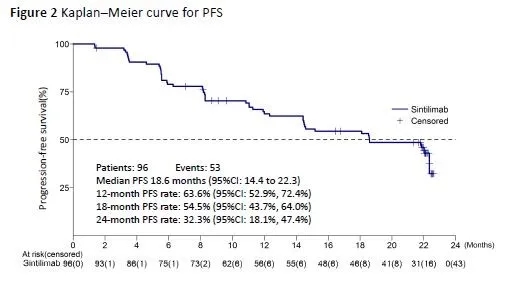
先前,多中心、单臂Ⅱ期ORIENT-1研究的初步分析已经显示出信迪利单抗对二线及以上治疗失败的复发/难治性cHL有效。此次报道为该研究长期随访的结果。信迪利单抗采取的是200mg IV,每3周1次,直到肿瘤进展。96例患者接受治疗,截至此次分析时,57.3%的患者完成了2年的治疗,中位随访时间为26.7个月,中位治疗时间为24.1个月。研究者对49例出现进展(PD)的患者进行观察,39/49(79.6%)的患者在PD后继续接受治疗,病情进展后,治疗的中位时间为8.0个月,整体患者的中位PFS为18.6个月,中位OS尚未达到。2年的OS率为96.3%。治疗相关不良事件发生率为92/96(95.8%),绝大多数为1~2级(71/96,74.0%),最常见的3或4级治疗相关不良事件为发热(3/96,3.1%)、脂肪酶升高(3/96,3.1%)、淋巴细胞降低(3/96,3.1%)。
石远凯教授点评
石远凯
国家癌症中心副主任
中国医学科学院肿瘤医院副院长
国家抗肿瘤药物临床研究机构副主任
抗肿瘤分子靶向药物临床研究北京市重点实验室主任
中国医师协会肿瘤医师分会会长
中国药学会抗肿瘤药物专业委员会主任委员
中国医疗保健国际交流促进会肿瘤内科分会主任委员
中国抗癌协会常务理事、副秘书长
中国抗癌协会淋巴瘤专业委员会主任委员
中国抗癌协会肿瘤临床化疗专业委员会前任主任委员
中国抗癌协会肿瘤分子靶向治疗专业委员会副主任委员
中国老年学和老年医学学会肿瘤分会副主任委员
中国临床肿瘤学会(CSCO)常务委员
国家食品药品监督管理局药品审评专家
“重大新药创制”科技重大专项GCP组和化药组责任专家
国家干细胞临床研究专家委员会委员
石远凯教授:信迪利单抗是国内首个获批用于治疗cHL的PD-1单抗,ORIENT-1研究结果自2018年ASCO公布以来,受到了国内外肿瘤学术界的高度评价,研究结果登上2019年第一期《柳叶刀•血液学》的封面。本次报告的长期随访结果,可以观察到信迪利单抗在治疗cHL中,除了高缓解率外,2年OS率达到96.3%,且多数不良反应都为1~2级,具备持久的治疗反应和可耐受的毒性。2019年,信迪利单抗作为唯一进入国家医保目录的PD-1单抗,兼具临床价值高和药物经济学的特点,为复发/难治性cHL患者带来了长期生存的希望。
【摘要8050】信迪利单抗用于复发/难治性结外NK/T细胞淋巴瘤(ENKTL):多中心、单臂Ⅱ期临床研究的扩展随访(ORIENT-4)
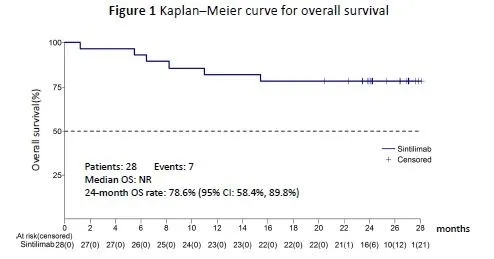
本次ASCO更新了延长随访后ORIENT-4研究的疗效和安全性结果。共28例病理确诊的复发/难治性ENKTL患者入组,给予信迪利单抗200 mg IV q3w治疗直至死亡、出现不可接受的毒性或最多24个月的治疗,允许进展(PD)后治疗。中位随访时间为26.9个月,中位治疗时长为24.15个月。根据Lugano 2014标准,20例患者PD,其中95%(19/20)的患者接受了进展后治疗。中位OS尚未达到,24个月的OS率为78.6%,ORR为67.9%,其中包括4例在治疗缓解前PD的患者。疾病控制率(DCR)为85.7%,包括5例在病情稳定或缓解前出现PD的患者。治疗后,患者生活质量量表评分有所改善,任一级别的治疗相关不良事件发生率为100%,3级不良事件发生率为39.4%,最常见的不良事件为淋巴细胞计数减少(7.1%)和糖尿病(7.1%),无4~5级不良事件发生。
教授、主任医师、博士生导师、博士后合作导师
江苏省人民医院血液科主任
血液病研究室主任、血液学教研室主任
中国抗癌协会血液肿瘤专业委员会 名誉主任委员
中国医师协会整合血液病学专业委员会副主任委员
中华医学会肿瘤学分会淋巴瘤学组 副组长
江苏省医学会血液学分会前任主任委员
CSCO中国淋巴瘤联盟 副主席
中国免疫学会血液免疫分会 常委
李建勇教授:对于NK/T细胞淋巴瘤这样一种中国人高发的病种,Orient-4研究的研究结果令人震撼。自去年在ASCO报道了早期数据以来,在国内外都引起了很大的反响。通常而言,一线标准治疗失败后的复发/难治性ENKTL患者预后极差。ORIENT-4研究已证实抗PD-1的单克隆抗体信迪利单抗,在复发/难治性ENKTL患者中具备相应疗效,今年新的扩展随访结果显示了信迪利单抗的长期的临床获益优势,在延长随访中,亦观察到了该药物的长期安全性,24个月的OS率可以达到78.6%。免疫检查点抑制剂PD-1单抗治疗复发难治ENKTL疗效令人鼓舞,是未来重要的治疗方向,在此研究的基础上,未来以PD-1抗体作为基础药物可以发展出多个新的治疗方案,给以传统治疗为基础的NK/T细胞淋巴瘤带来新的希望。
扫描上面二维码在移动端打开阅读