一
摘要
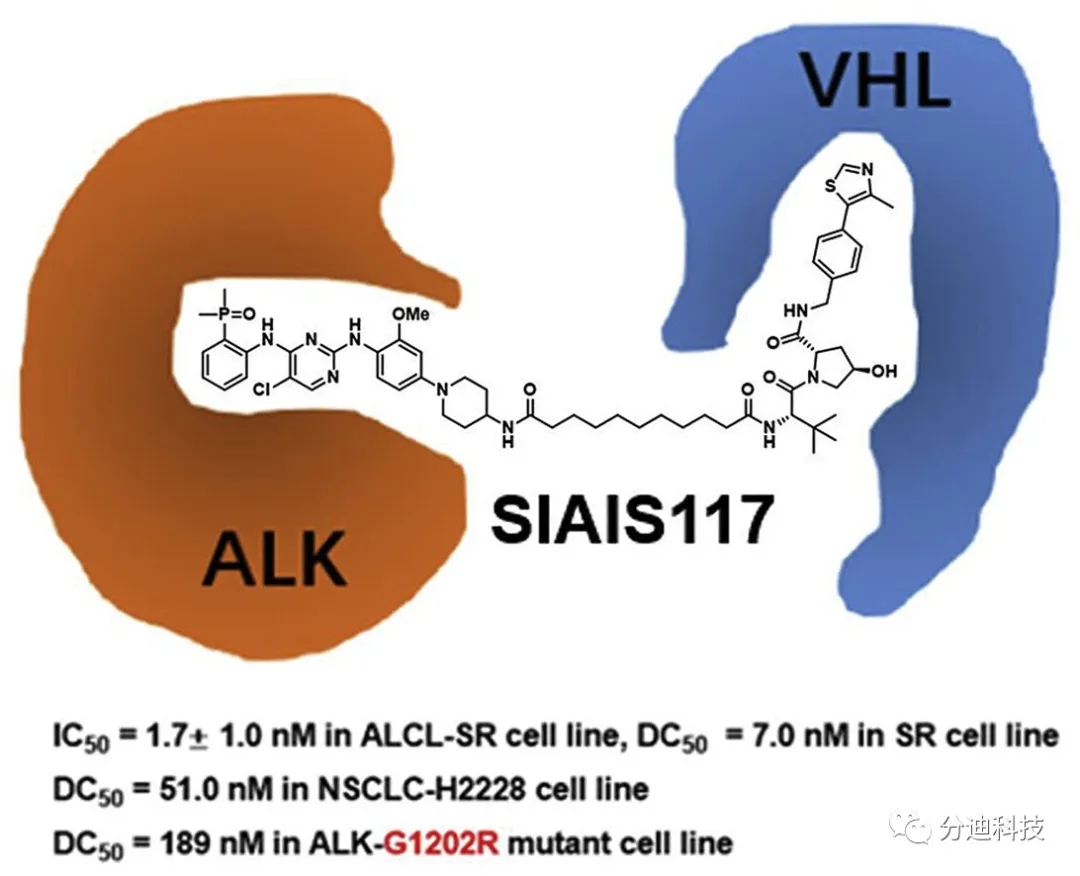
2020年2月29日,上海科技大学免疫化学研究所姜标教授课题组发文报道了基于布加替尼设计的PROTAC分子能在体外有效降解ALK阳性的突变蛋白,抑制下游信号传导和癌细胞增殖,显示出较好解决ALK阳性突变耐药的潜力。EML4-ALK和NPM-ALK融合蛋白能组成型激活ALK(间变性淋巴瘤激酶),导致非小细胞肺癌(NSCLC)和间变性大细胞淋巴瘤(ALCL)的发展,ALK抑制剂虽有较好效果但长期使用会导致耐药。本文探讨PROTAC技术在解决ALK抑制剂耐药方面的潜力,通过设计合成一系列基于布加替尼(Brigatinib)和VHL-1的ALK PROTACs,筛选出最佳分子SIAIS117。SIAIS117能降解ALK蛋白,抑制SR和H2228癌细胞生长;对于表达ALK蛋白G1202R突变的293T细胞系,SIAIS117显示出比布加替尼更好的生长抑制效果;此外,SIAIS117还能抑制小细胞肺癌增殖。总之,本文开发的PROTAC分子显示出较好解决ALK阳性突变耐药的潜力。
二
背景
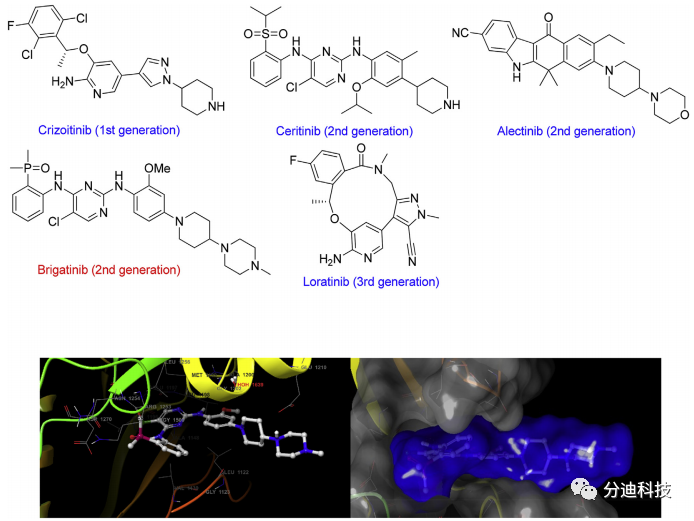
ALK首先在间变性大细胞淋巴瘤中被发现。它在癌症中能与20多种不同的基因产生融合蛋白,组成型激活ALK信号通路。在肺癌中,EML4-ALK基因融合是ALK融合的最常见形式,具有此类突变(包括H2228)的细胞系高度依赖ALK激酶的活性。NPM-ALK存在于约60%的间变性大细胞淋巴瘤(ALCL)患者中。第一代ALK抑制剂药物克唑替尼,第二代色瑞替尼、阿来替尼、布加替尼和第三代劳拉替尼相继被用于治疗ALK阳性NSCLC患者(图1),但耐药性问题始终没有解决。因此,本文希望通过蛋白质降解技术,发现能够克服抑制剂治疗缺陷的新型PROTAC分子。
图1 FDA批准的ALK抑制剂药物以及ALK与布加替尼的共晶体结构
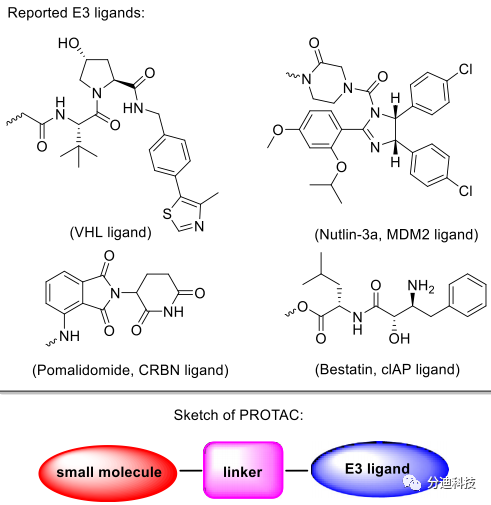
PROTAC是一种双功能小分子(图2),可与靶蛋白和E3-泛素连接酶结合形成三元复合物后通过蛋白酶体途径降解靶蛋白。该技术已成功应用于许多靶蛋白的降解,如AR、ER、BET、FKBP-12、Bcr-Abl、PARP、BTK、EGFR、FLT-3、TBK1、CDK4/6和HER-2。常用的E3连接酶配体如下(图2)。
图2 文献报告的E3连接酶配体和PROTAC分子示意图
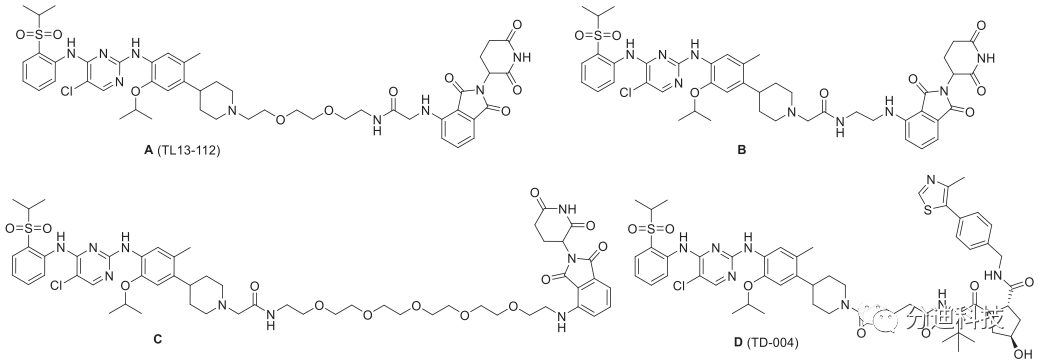
最近报道了多个靶向降解ALK的PROTAC,其中与ALK结合部分均采用的是ALK抑制剂色瑞替尼(图3 A、B和C)。迄今为止,尚未报道基于布加替尼的PROTAC,布加替尼被FDA批准用于治疗转移性非小细胞肺癌,与其他第二代ALK抑制剂相比,布加替尼对大多数ALK点突变的疗效更高并表现出更高的总体缓解率和更长的无进展生存期。布加替尼与ALK的共结晶结构(PDB ID:6MX8)表明其溶剂暴露哌啶基部分适用于PROTAC设计(图1),因此本文基于布加替尼设计了一系列Brigatinib-PROTACs。
图3 文献报道的靶向ALK的PROTAC
三
试验过程和结果
3.1 ALK PROTACs的化学合成
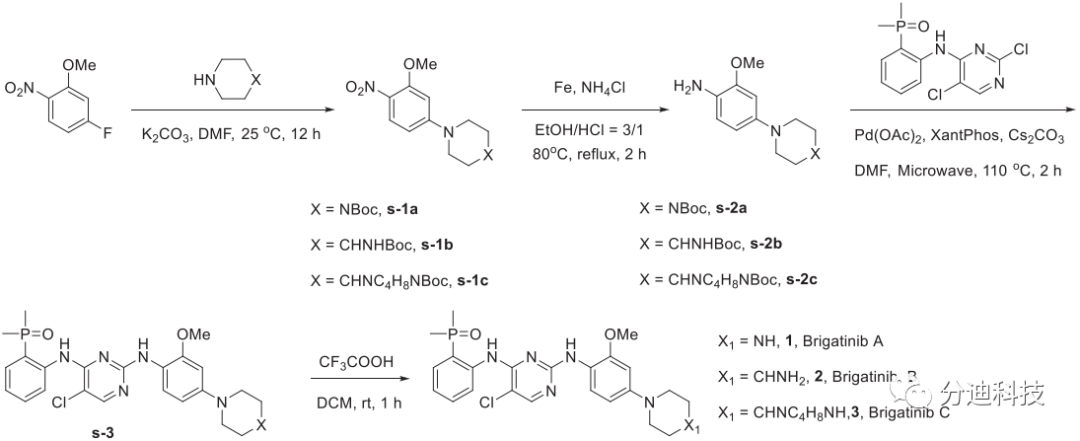
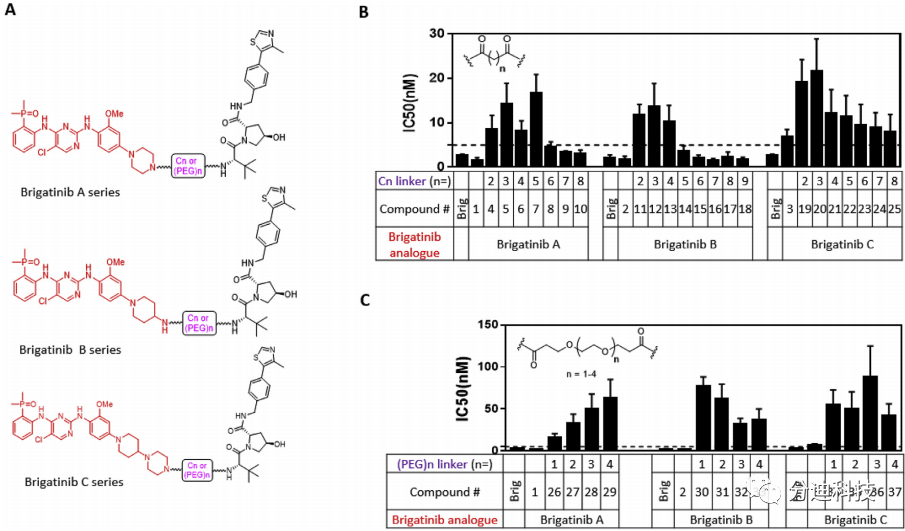
研究人员首先通过亲核取代、还原、Buchwald偶联和脱BOC保护等步骤合成了布加替尼类似物(A、B和C)(方案1);
方案1 布加替尼类似物的合成
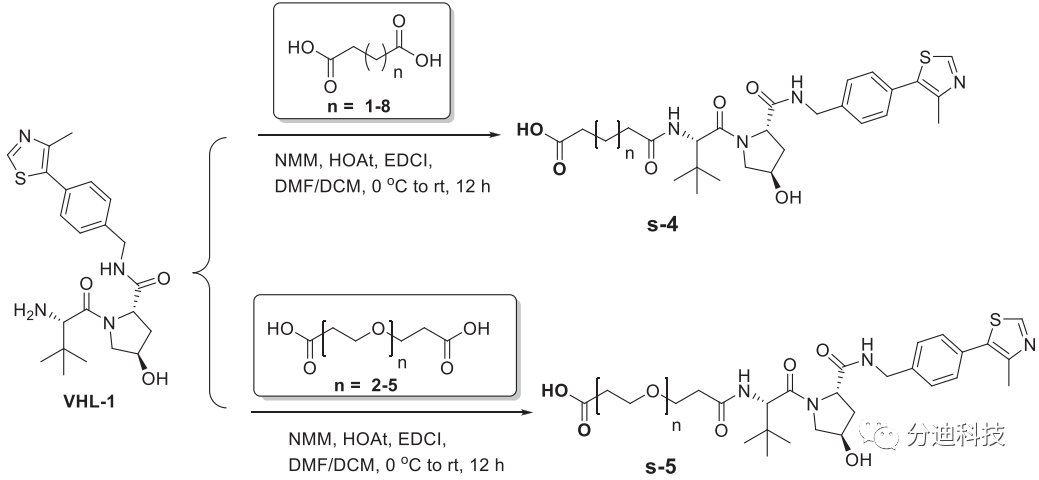
之后基于VHL-1合成了VHL配体(方案2);
方案2 VHL的配体的合成
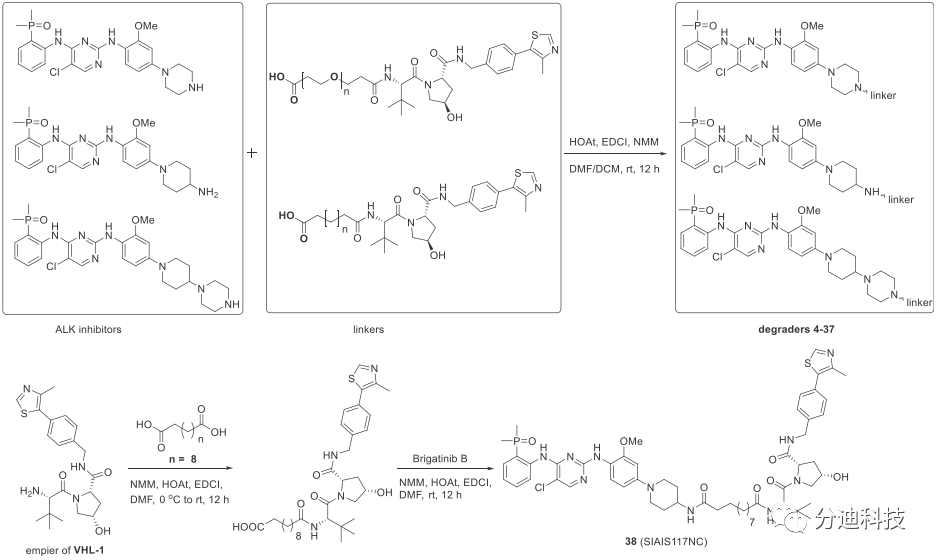
最后通过酰胺缩合生成一系列ALK PROTACs,同时合成了阴性对照化合物38(SIAIS117NC)(可干扰了与E3连接酶的结合)(方案3)。
方案3 ALK PROTACs的合成
3.2 ALK PROTACs抑制ALK阳性癌细胞生长
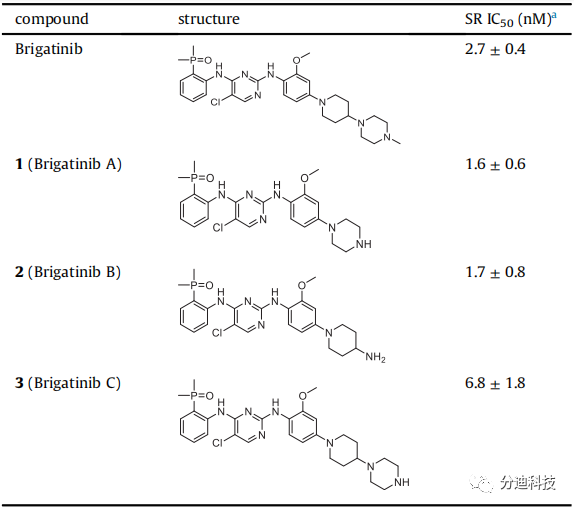
因带有NPM-ALK融合基因的ALCL SR细胞系对ALK抑制剂非常敏感,因此本研究将其用于PROTAC筛选(表1)。研究发现三种形式的布加替尼均可有效抑制SR细胞的生长,但布加替尼和三个类似物均未降解ALK蛋白。
表1 布加替尼与其类似物的化学结构及其IC50
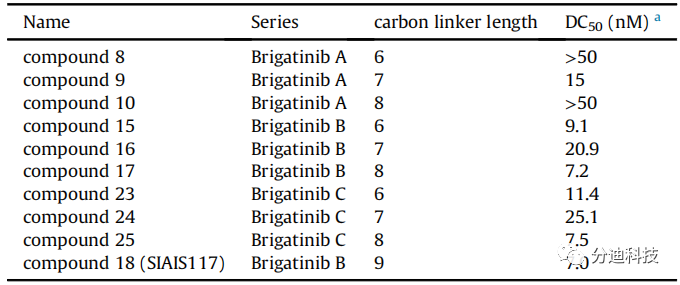
研究发现基于布加替尼类似物和与VHL配体均可生成PROTAC分子(图4A),但Linker的结构会干扰了PROTAC对SR细胞系的抑制作用。随着Linker碳链长度从C2增加到C5,其生长抑制能力明显变弱(如IC50值增加所示),从C6到C8生长抑制能力又逐渐增强。当Linker碳链长度相同时,布加替尼B系列显示出最佳的生长抑制效果(图4)。当碳链型Linker长度增加到C9时,化合物18(SIAIS117)表现出最强的抑制效果(IC50 = 1.7±1.0 nM)。但使用PEG型Linker生成的三个系列的布加替尼PROTACs(图4A)对SR细胞系的生长抑制作用均明显下降(图4C)。
图4 Linker类型和长度对SR抗增殖活性的影响3.3 SIAIS117有效降低ALK蛋白水平
ALK PROTAC可以在低至7.0 nM的浓度下降解ALK蛋白且其降解能力与细胞生长抑制之间并没有明显的相关性(图4和表2)。不论布加替尼类似物是何种类型,基于PEG Linker的PROTAC均不能且这些化合物均不能降解ALK蛋白和抑制癌细胞系的增殖。
表2 Linker类型和长度对SR降解活性的影响
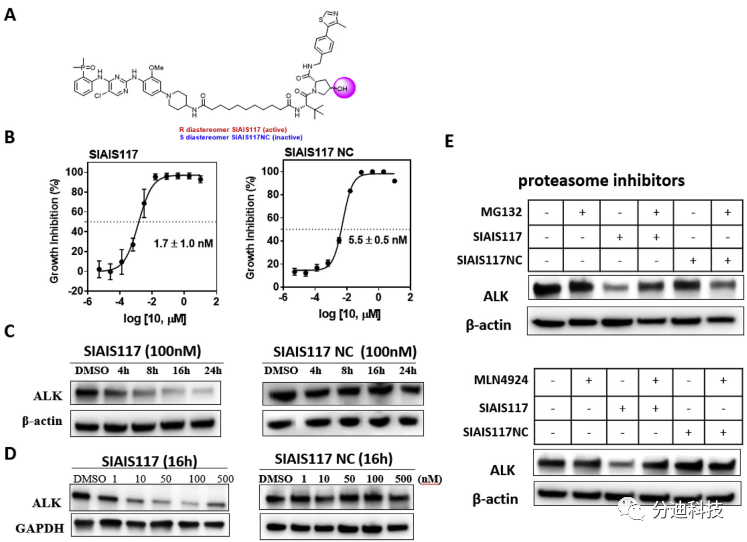
3.4 SIAIS117通过蛋白酶体途径降解ALK蛋白
为了测定SIAIS117降解ALK蛋白的速度,本文用100 nM的SIAIS117处理SR细胞系,之后在指定时间点检测ALK蛋白水平(图5C)。处理4小时后观察到ALK蛋白开始降解,24小时后ALK蛋白被完全降解。使用相同剂量的的阴性对照化合物38 SIAIS117NC处理SR细胞24小时后,未检测到任何ALK蛋白降解(图5C)。之后继续评估布加替尼在SR细胞系中的降解效果,发现即使浓度从30 nM增到300 uM,24小时内均不能观察到ALK蛋白的降解。因此,考虑到SIAIS117及SIAIS117NC对照具有相似的细胞渗透性和激酶结合亲和力,SIAIS117诱导的ALK蛋白降解对ALK突变型癌症具有更好的生长抑制作用(图5)。
图5 化合物SIAIS117诱导ALK降解机理
为了进一步确定降解是否通过蛋白酶体介导的途径起作用,本文使用蛋白酶体抑制剂MG132和MLN4924对细胞进行预处理(图5E),4 h后再用化合物SIAIS117或SIAIS117NC处理SR细胞系16小时。实验发现MG132预处理的细胞中SIAIS117对ALK蛋白降解能力大大减弱,使用MLN4924也观察到相同的效果,这进一步表明ALK PROTAC诱导的ALK蛋白降解是通过蛋白酶体途径进行的。
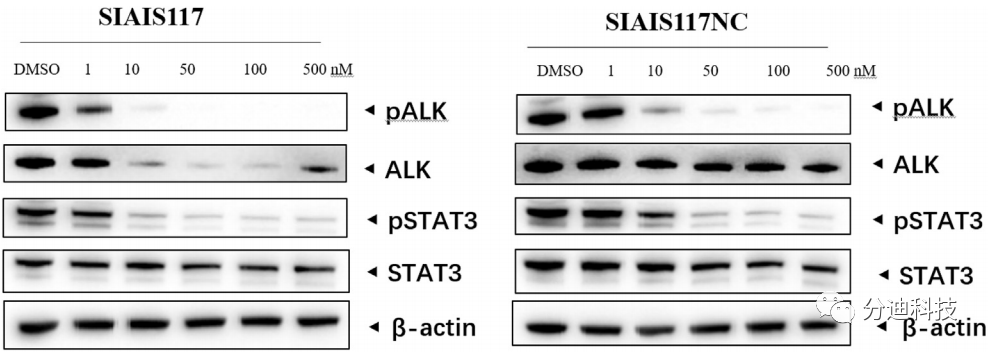
3.5 SIAIS117抑制ALK磷酸化并阻止下游信号传导
本文研究了SIAIS117对ALK蛋白磷酸化和下游信号传导的影响。化合物SIAIS117在10 nM时完全抑制了ALK的磷酸化(图6),相比之下化合物SIAIS117NC要大约50 nM才能完全抑制ALK的磷酸化。继续检查两种化合物对ALK介导的信号传导影响,化合物SIAIS117显示出比SIAIS117NC更好的pSTAT3抑制作用(图6)。此外,SR细胞中的蛋白质组学数据(已鉴定出7280种蛋白质)表明,除ALK融合蛋白外,没有其他靶向激酶被SIAIS117降解,包括EGFR突变、IGF-1R、FLT3和ROS1。此外,之前报道的被ALK PROTAC降解的某些激酶(如Aurora A)的蛋白水平也没有显著变化。以上结果说明了SIAIS117对SR细胞有较好的选择性。
图6 SIAIS117和阴性对照对SR细胞的降解活性研究
3.6 SIAIS117降解肺癌细胞中突变ALK蛋白并抑制其磷酸化
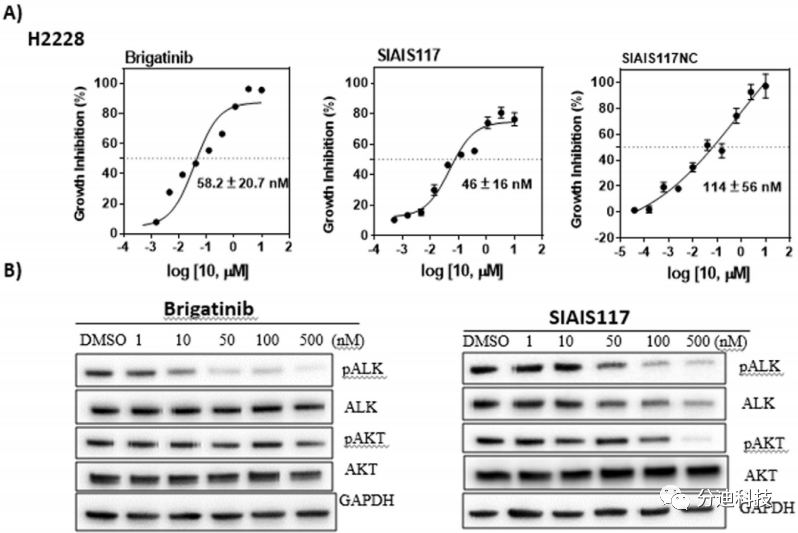
带有EML4-ALK融合基因的NSCLC细胞系H2228对ALK抑制剂敏感。用SIAIS117处理细胞72小时后,用CCK8试剂评估活细胞的活性(图7A)。布加替尼抑制H2228细胞增殖,IC50约为58 nM,SIAIS117的IC50约为46 nM,SIAIS117NC 的IC50约为114 nM。
图7 SIAIS117在H2228中的降解和抑制活性研究
接下来,本文研究了SIAIS117处理H2228细胞系后ALK蛋白的磷酸化和降解能力。尽管布加替尼本身不诱导ALK蛋白降解,但化合物SIAIS117从50 nM开始便可观察到ALK蛋白的降解(图7B)。
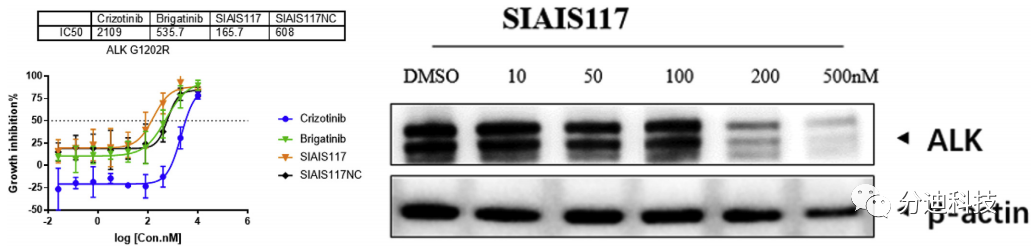
3.7 SIAIS117能抑制G1202R突变ALK细胞生长
克唑替尼相关的耐药性点突变包括G1202R、G1269A、C1156Y和L1196M等,其中G1202R突变是一种高度难治的突变,对克唑替尼、色瑞替尼和布加替尼等ALK抑制剂均具有耐药性。为了进一步研究SIAIS117抑制和降解临床相关同工型突变的能力,本研究在293T细胞系中外源表达了具有G1202R突变的EML4-ALK(图8)。研究结果显示SIAIS117比布加替尼和SIAIS117NC有更好的生长抑制作用。在表达ALK突变体的细胞系中,布加替尼或SIAIS117NC的IC50值比SIAIS117高约3倍(图8)。由于SIAIS117对克唑替尼耐药细胞系具有有效的抑制作用(IC50 146.4 nM)和降解能力(DC50 <200 nM),因此SIAIS117提供了一种克服G1202R介导的ALK靶向治疗耐药性的策略。
图8 SIAIS117降解 G1202R突变ALK蛋白研究
3.8 SIAIS117对小细胞肺癌的抗增殖研究
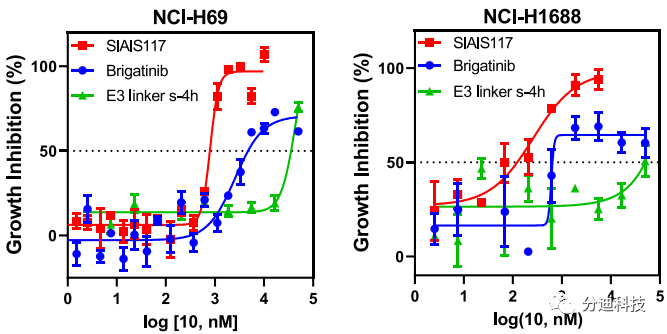
转化为小细胞肺癌是ALK和EGFR靶向治疗的耐药机制之一。小细胞肺癌(SCLC)是最致命的肺癌类型。鉴于SIAIS117可以有效降解ALK蛋白,本文研究了SIAIS117在某些SCLC细胞系中的作用。尽管它们的增殖并不依赖于ALK蛋白的表达,但研究发现SIAIS117对小细胞肺癌细胞系具有一定的杀伤作用(图9)。用SIAIS117和布加替尼处理后,布加替尼几乎不具有抑制NCI-H69细胞系生长的能力,IC50约为2.6 µM(图9),但SIAIS117对这种细胞系表现出更强的生长抑制作用,IC50约为799 nM。为了排除E3配体的影响,本文选择了与SIAIS117具有相同长度的阴性对照E3连接物(s-4h),发现它没有抑制NCI-H69生长的能力(IC50 > 40 µM)。在另一个小细胞肺癌细胞系NCI-H1688中,SIAIS117显示出比布加替尼(IC50 = 691 nM)和E3连接物s-4h(IC50> 45 µM)更强的抗增殖能力(IC50 = 259 nM)(图9),在小细胞肺癌细胞系NCI-H446中,也观察到类似的情况。
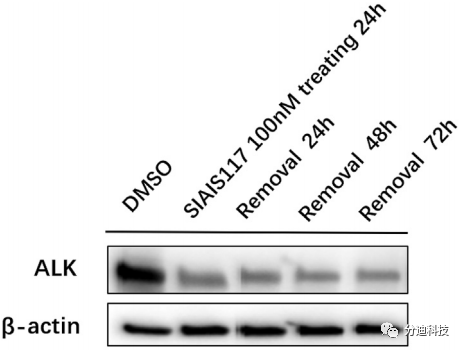
最后,本文研究了SIAIS117的长期降解活性。在用100 nM SIAIS117处理SR细胞24小时后,从培养基中除去SIAIS117,并在去除后24h、48h和72h评估ALK蛋白水平。研究结果显示SIAIS117会导致SR细胞中ALK蛋白的持续降解(图10),这表明ALK PROTAC比ALK抑制剂可以维持更长久的细胞活性。
图10 SIAIS117诱导ALK蛋白持续降解的研究
四
讨论
本文成功开发了一种降解ALK的PROTAC分子SIAIS117,它能降解非小细胞肺癌H2228细胞和ALCL细胞系SR细胞中致癌性ALK蛋白,且该化合物在抑制表达G1202R突变ALK蛋白的细胞系生长和降解G1202R突变蛋白方面显示出明显的优势。这是新报道的可以抑制小细胞肺癌生长的PROTAC分子,为进一步扩大在其他ALK阳性癌症的应用奠定了基础。
https://doi.org/10.1016/j.ejmech.2020.112190
扫描上面二维码在移动端打开阅读