5月14日,来自德国杜塞尔多夫大学医学院的两位专家在 Nature Biomedical Engineering 上发表文章探讨了芝加哥大学Jeffrey Hubbell等人之前的一项研究,即静脉注射能与小鼠“冷”肿瘤(肿瘤浸润T细胞密度低的肿瘤)中胶原蛋白结合的经过修饰的IL-12制剂,可在降低免疫相关副作用的同时有效清除“冷”肿瘤,特别是与免疫检查点阻断疗法结合使用时 [1]。
图片来源:Nature Biomedical Engineering [1]
与“冷肿瘤”相对的“热肿瘤”中含有高水平的肿瘤浸润淋巴细胞,这些免疫细胞通过抗原依赖机制靶向并杀死肿瘤细胞。然而,长期的抗原暴露会导致T细胞耗竭,也就是说,T细胞会变得功能低下,失去其扩增潜能。此外,肿瘤会减少免疫显性抗原的表达以避免被淋巴细胞识别,以及肿瘤细胞增强共抑制分子的表达(通过激活免疫细胞中的抑制性受体,如PD-1,引起T细胞耗竭)也使得免疫系统更难对抗肿瘤。
先前已有大量研究揭示,在感染和癌症的背景下,免疫检查点通路会触发T细胞耗竭,而免疫检查点阻断被证明是在多种肿瘤中恢复T细胞功能的一种策略。不过,虽然阻断肿瘤患者的PD-L1或CTLA-4可恢复肿瘤微环境中的免疫细胞反应性,但在所谓的“冷”肿瘤中效果有限。
其他一些替代方法可以增强肿瘤的局部免疫反应。尤其是诸如IL-12等细胞因子的应用,它能激活细胞毒性淋巴细胞和NK细胞,并促进肿瘤特异性免疫反应。然而,尽管IL-12可以增加NK细胞和T细胞中IFN-γ的产生,但IFN-γ或IL-12的全身给药都不足以支持抗肿瘤T细胞的反应,并可能引起严重的免疫相关副作用,如细胞因子风暴综合征和肝损伤。因此,全身给药未经修饰的IL-12具有明显的局限性,但这些局限性可以通过将IL-12靶向于仅支持其有益作用的特定细胞或器官来解决。
Jeffrey Hubbell和同事们于4月13日在 Nature Biomedical Engineering 杂志上发表的研究显示,IL-12与靶向肿瘤中暴露胶原蛋白的血管性血友病因子(VWF,一种可与胶原蛋白结合的血液蛋白)的胶原蛋白结合域(CBD)融合(简称CBD–IL-12),能有效促进局部免疫激活,同时免疫相关副作用减少且没有广泛的系统效应。在小鼠肿瘤模型中静脉注射CBD–IL-12可促使对免疫检查点阻断耐药的乳腺肿瘤完全消退,并与免疫检查点阻断产生协同作用,根除已形成的大型黑色素瘤 [2]。
图片来源:Nature Biomedical Engineering [2]
Hubbell领导的这项研究实际上是利用了肿瘤细胞外基质和快速生长肿瘤细胞新生血管中异常高的胶原蛋白暴露。为了实现IL-12的肿瘤胶原蛋白靶向性,IL-12通过G3S(一种柔性肽连接物)与VWF的A3结构域的CBD结合在一起,从而使IL-12在局部发挥作用。
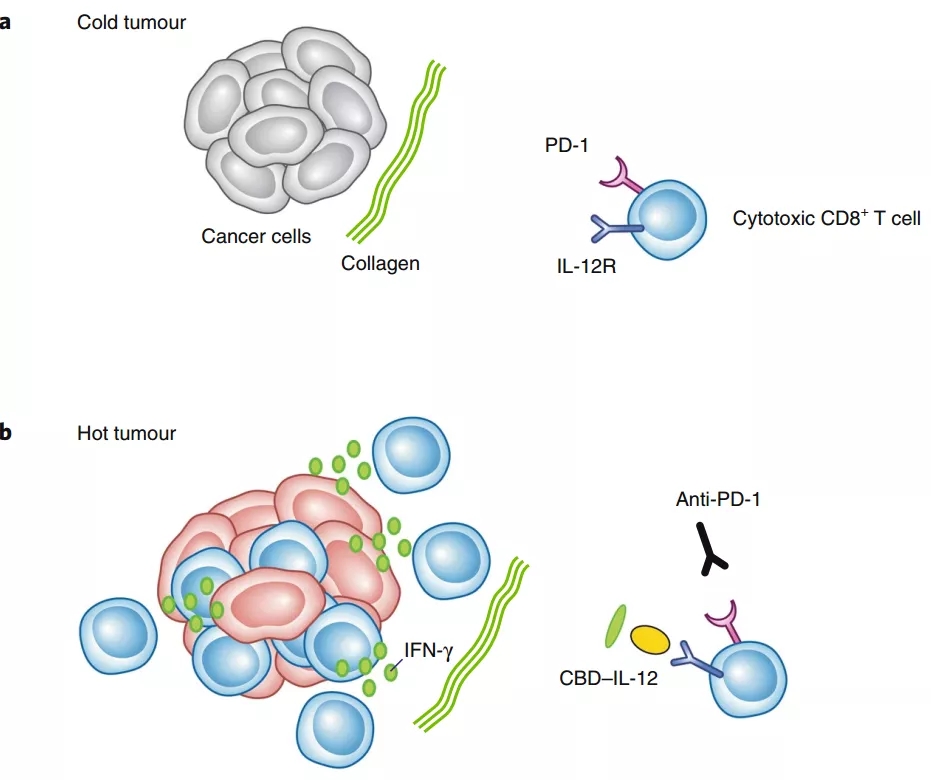
研究表明,CBD–IL-12融合蛋白保留了与胶原蛋白的结合能力和IL-12的生物活性,并且与未经修饰的IL-12相比,治疗蛋白的血清半衰期较低。值得注意的是,CBD–IL-12在肿瘤组织中富集,并诱导肿瘤特异性产生IFN-γ,而IFN-γ是IL-12抗肿瘤活性的关键介质(下图)。
CBD−IL-12增强冷肿瘤的免疫原性。a)冷肿瘤的浸润免疫细胞数少。这可能是细胞毒性CD8+T细胞活化不良或耗竭的结果,可能涉及免疫抑制PD-L1/PD-1通路。IL-12R = IL-12受体。b)当免疫检查点阻断释放抑制免疫反应时(如使用抗PD-1抗体),肿瘤中以暴露的胶原蛋白为靶点的CBD–IL-12产生的IL-12信号导致细胞毒性CD8+T细胞的激活和增殖。肿瘤浸润细胞毒性CD8+T细胞释放IFN-γ等免疫介质。(图片来源:Nature Biomedical Engineering [1])
他们还观察到,在黑色素瘤或乳腺癌小鼠模型中单独注射CBD–IL-12,或在黑色素瘤小鼠模型中联合注射CBD–IL-12和抗PD-1抗体后,免疫“冷”肿瘤显著消退。具体如下:
在B16F10小鼠黑色素瘤模型中,单次静脉注射CBD–IL-12可使15只接受治疗的小鼠中有10只完全缓解(67%),与未经修饰的IL-12相比减轻了肿瘤负荷。在免疫原性较差的EMT6小鼠乳腺癌模型(典型的冷肿瘤)中,CBD–IL-12给药导致浸润到肿瘤基质中的CD8+细胞毒性T细胞增加,这使IFN-γ和其他典型IL-12靶因子(如CXCL10和IL-1β)的产生增加。15只接受治疗小鼠中13只完全缓解(87%),而未经修饰的IL-12只导致15只接受治疗小鼠中的6只得到临床缓解(40%)。
研究人员还利用CBD–IL-12和免疫检查点阻断联合治疗B16F10或BrafV600E Ptenfl/fl黑色素瘤小鼠。尽管单用免疫检查点抑制剂或CBD–IL-12对已建立的肿瘤没有持续作用,但两种药物的联合使用可改善肿瘤控制。
CBD–IL-12诱导的免疫激活局限于肿瘤,全身性副作用有限,因为注射CBD–IL-12后小鼠体内循环IFN-γ(导致免疫相关副作用的主要因素)的水平低于注射未经修饰的IL-12。CBD–IL-12没有导致治疗小鼠的体重减轻,也没有明显的肺、肝或肾组织损伤的迹象。值得注意的是,与瘤内注射相关的胶原蛋白靶向IL-12融合蛋白(Lumican–IL-12)相比,全身应用CBD–IL-12具有更高的靶向转移肿瘤部位的潜力。
CBD–IL-12的疗效取决于肿瘤组织中暴露的胶原蛋白的存在。因此,CBD–IL-12疗法对人类癌症的适用性需要进一步研究,以确定胶原蛋白结合的情况是否可复制。此外,还应深入研究CBD–IL-12的生物分布,以防止T细胞和抗原提呈细胞在可能有胶原蛋白的健康组织中的募集(可能还有活化),这可能导致自身免疫。
由于CBD–IL-12的靶向性,静脉注射应用的好处显而易见,特别是当靶向其他无法接近的肿瘤时。并且,在对免疫检查点阻断低敏感的肿瘤中,CBD–IL-12与免疫检查点抑制剂的协同作用可显著拓宽该策略的应用范围。
德国杜塞尔多夫大学医学院的两位专家表示,Hubbell和同事们展示了注射CBD–IL-12后趋化因子的上调,未来的工作应该阐明CBD–IL-12如何促进T细胞向肿瘤的募集,并描述参与其治疗效果的主要免疫细胞亚群。
由于免疫靶向治疗对癌症患者中很大一部分是无效的,因此逆转“冷”肿瘤中的免疫抑制微环境的能力将对临床产生重大影响。Hubbell和同事们的胶原蛋白靶向策略可能成为免疫疗法的一个重要补充。
扫描上面二维码在移动端打开阅读