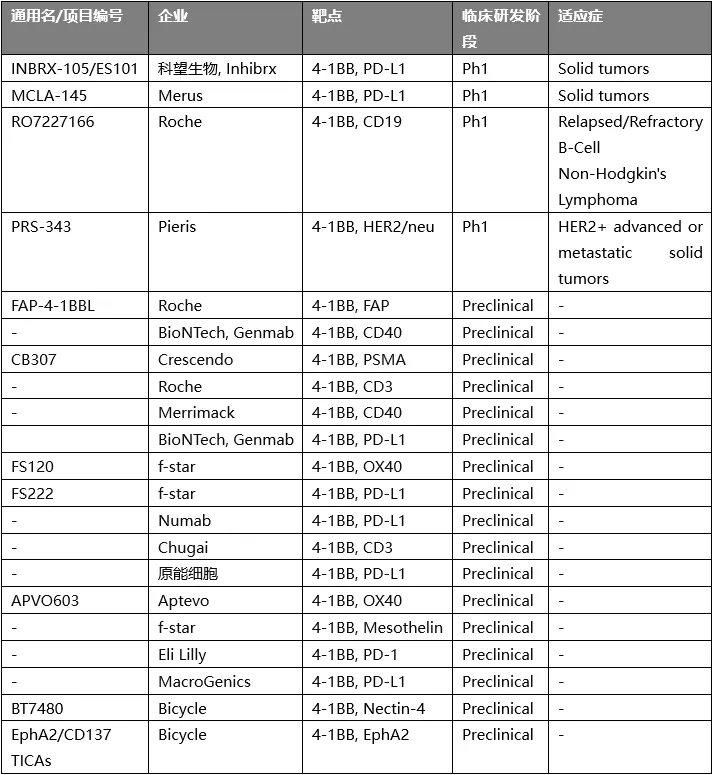
4-1BB属于TNFR家族的成员,在CD8+ T细胞和NK细胞被激活后高表达,是一个重要的共刺激因子。诸多实验证明,4-1BB能够向活化后的CTL和记忆T细胞传递促进增殖和存活的信号,有助于促进CTL的抗肿瘤作用。因此,它在过去十几年中逐渐成为肿瘤免疫领域中的一个被寄予厚望的靶点。多家大小公司正在开发4-1BB激动剂。
较为领先的项目是辉瑞的utomilumab和BMS的urelumab,但过往的临床试验结果显示了这类靶点的药物开发并不简单:urelumab单药对实体瘤显示一定的响应,但具有明显的肝毒性,而为了安全调低剂量后,单药效果又不显著;utomilumab安全性更好,但治疗效果欠佳。
因此, 4-1BB靶向性药物开发的核心问题是如何合适地调控4-1BB的活性。针对urelumab,开发者的调整策略是降低剂量,并与其他药物联用;而utomilumab活性较低,必须尝试联用。而另外一种主流策略就是开发双特异性的药物(包括抗体和其他类型的分子)。小编能够检索的相关项目如下,包括临床阶段和临床前阶段的项目,可以一窥整体的开发思路。
从靶点的选择来看,这些药物分子可以分为两类:靶向4-1BB及肿瘤相关抗原(TAA)的T cell engager和靶向4-1BB及T细胞上另一种免疫检查点的双激动剂。目前,前者占多数,其中TAA又以PD-L1为主要选择。
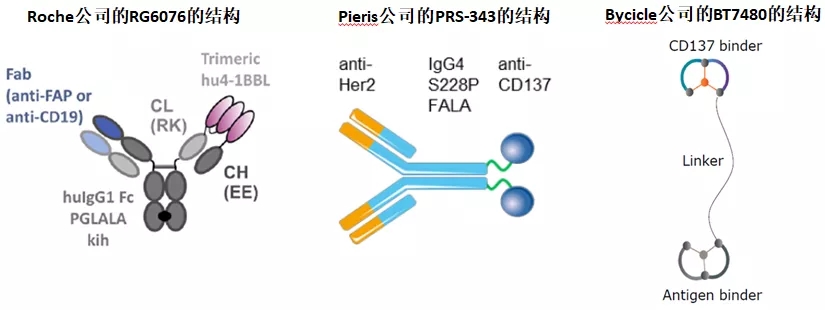
对于靶向4-1BB/TAA的药物分子类型,各公司尝试设计了多种分子类型和结构。分子的整体结构有融合蛋白,也有合成多肽;融合蛋白中有双特异性抗体,也有抗体与4-1BBL的融合蛋白。
靶向4-1BB/TAA的药物与其他的T cell engager类似,能够实现在肿瘤部位局部地激活T细胞,最大程度地降低药物的副作用;除此之外,这类分子还包含TAA以药物分子为媒介促进4-1BB成簇和活化的作用,即利用TAA的表达丰度控制4-1BB的活化,能够精妙的调控4-1BB的活化。
总结
靶向4-1BB和另一种免疫检查点这样的策略理论上能够进一步增强T细胞的活化,但可能的过度激活以及对人体内T细胞的整体激活有可能导致较大的副作用,在给药剂量上需要非常谨慎。
而靶向4-1BB/TAA的药物从设计理念上看能够精妙的调控4-1BB的活化,但也有其明显的弊端,即无法避免TAA下调导致药物对4-1BB的促成簇作用迅速被解除的后果,这使得药物对4-1BB的激活效果很快丧失。
无论是联用还是研发双特异性药物,最终的可行性还是要看临床效果。
扫描上面二维码在移动端打开阅读