1
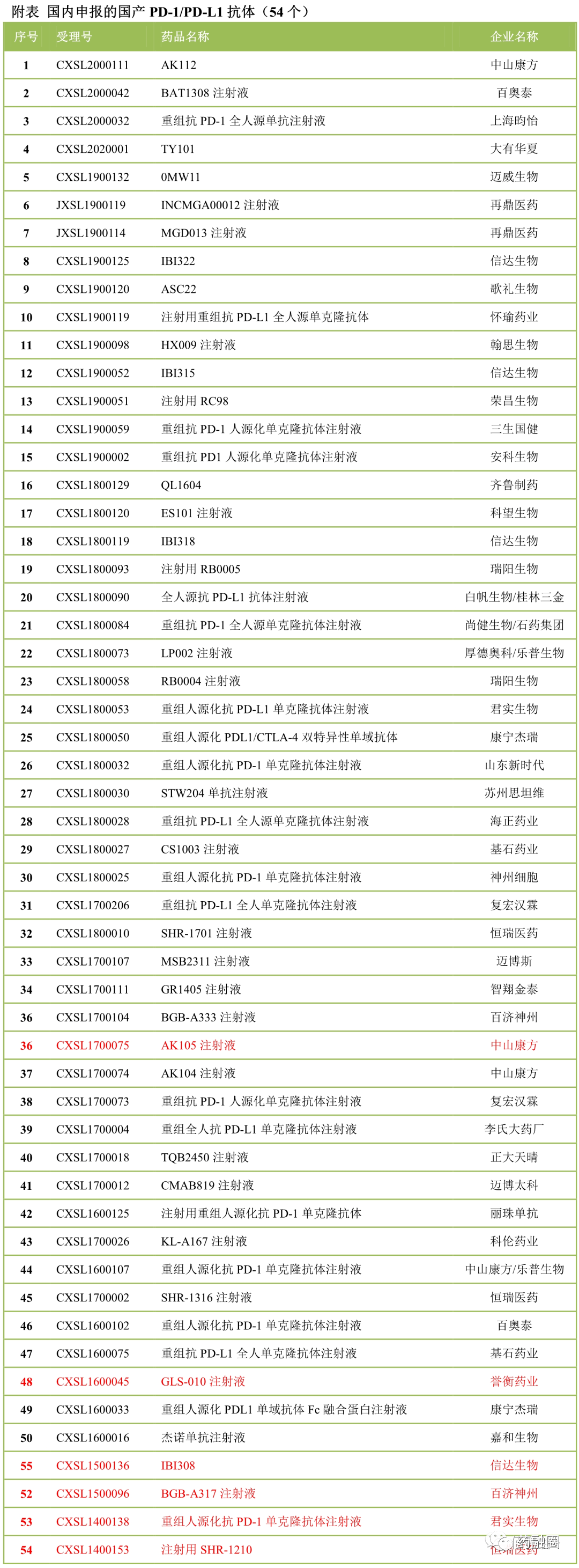
港股康方生物于2020年5月底,向NMPA/CDE申报了国际首创的PD-1/VEGF双抗(AK112)。至此国内药企申报的PD-1/PD-L1类抗体累计已达55款;其中单抗42款、双抗13款。
AK112基于Tetrabody双抗平台,自主研发出的双抗产品,2019年7月已在美国获准临床。康方生物此前表示:抗血管生成药物和免疫治疗药物联合使用,可在一定时间内重塑肿瘤生长的微环境,使其变成免疫治疗友好型环境。PD-1抗体和抗血管生成药物可以产生协同抗肿瘤作用。多项临床研究显示,在一些PD-1单药治疗效果不是很理想的瘤种,包括肝癌、胃癌、和微卫星稳定的结直肠癌等,PD-1抗体和抗血管生成药物联用都取得了令人鼓舞的进展。PD-1和VEGF在肿瘤微环境同时富集,相对于联合用药,更有利于双特异抗体药物药效和安全性。
2
2020年5月26日,科创板百奥泰的BAT1308获得NMPA/CDE批准进行临床试验。BAT1308自主研发的一种单抗药物,其活性成分是一种由中国仓鼠卵巢细胞表达的靶向人程序性细胞死亡蛋白1(PD-1)的抗体,属于免疫球蛋白 IgG4κ 亚型,能够以高亲和力特异性地结合人 PD-1,从而阻断 PD-1 与其配体 PD-L1、PD-L2 的相互作用。BAT 1308 能够与 T 细胞表面的 PD-1 结合,解除 PD-1 通路对 T 细胞的抑制作用,从而恢复和提 高 T 细胞的免疫杀伤功能,抑制肿瘤生长。本品为百奥泰的第2款PD-1。
百奥泰另一款 PD-1 单抗 BAT 1306 目前在国内开展:EBV相关性胃癌的 II 期临床和实体瘤的 I 期临床。为何立项开发两款PD-1,不得而知。
图片来源:生物制药小编/Armstrong
3
(1)2014年首个国产PD-1抗体SHR-1210申报临床,2015年1月获CDE受理,来自于恒瑞医药。
(2)2018年12月17日,君实生物的特瑞普利单抗注射液(CXSS1800006)获国家药品监督管理局(NMPA)批准,用于治疗既往接受全身系统治疗失败后的不可切除或转移性黑色素瘤患者,本品为第一家国产上市的PD-1。
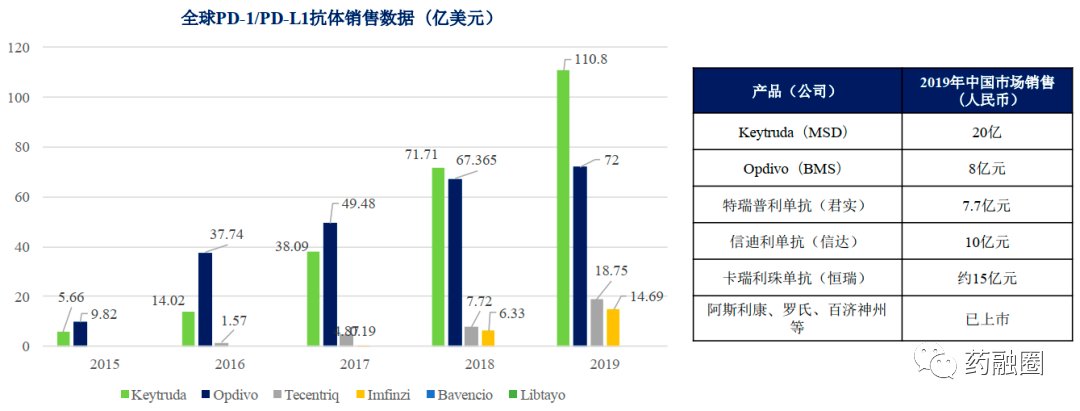
(3)国产销售:
2019年,信达生物信迪利单抗注射液自2019年3月上市后销售带来的收入为10.159亿元人民币。
2019年,君实生物特瑞普利单抗销售额7.74亿元人民币。
2019年,恒瑞医药的卡瑞利珠单抗销售约15亿元人民币。
(4)百济神州,替雷利珠单抗注射液自2020年3月在中国商业发布以来的产品收入为2053万美元。
(5)其他申报上市的国产PD-1:
2020年5月,中国生物制药与康方生物科技共同开发及商业化的抗PD-1单抗药物安尼可(通用名:派安普利,研发代号:AK105)的新药上市申请,已获中国国家药品监督管理局受理,用于治疗复发或难治性经典型霍奇金淋巴瘤患者。
2020年2月,广州誉衡生物科技有限公司(誉衡生物)宣布, 国家药品监督管理局(NMPA)已正式受理其在研重组全人抗PD-1单克隆抗体——赛帕利单抗注射液(原名GLS-010注射液)的新药上市申请(NDA),治疗二线以上复发或难治性经典型霍奇金淋巴瘤(r/r cHL)患者。
4
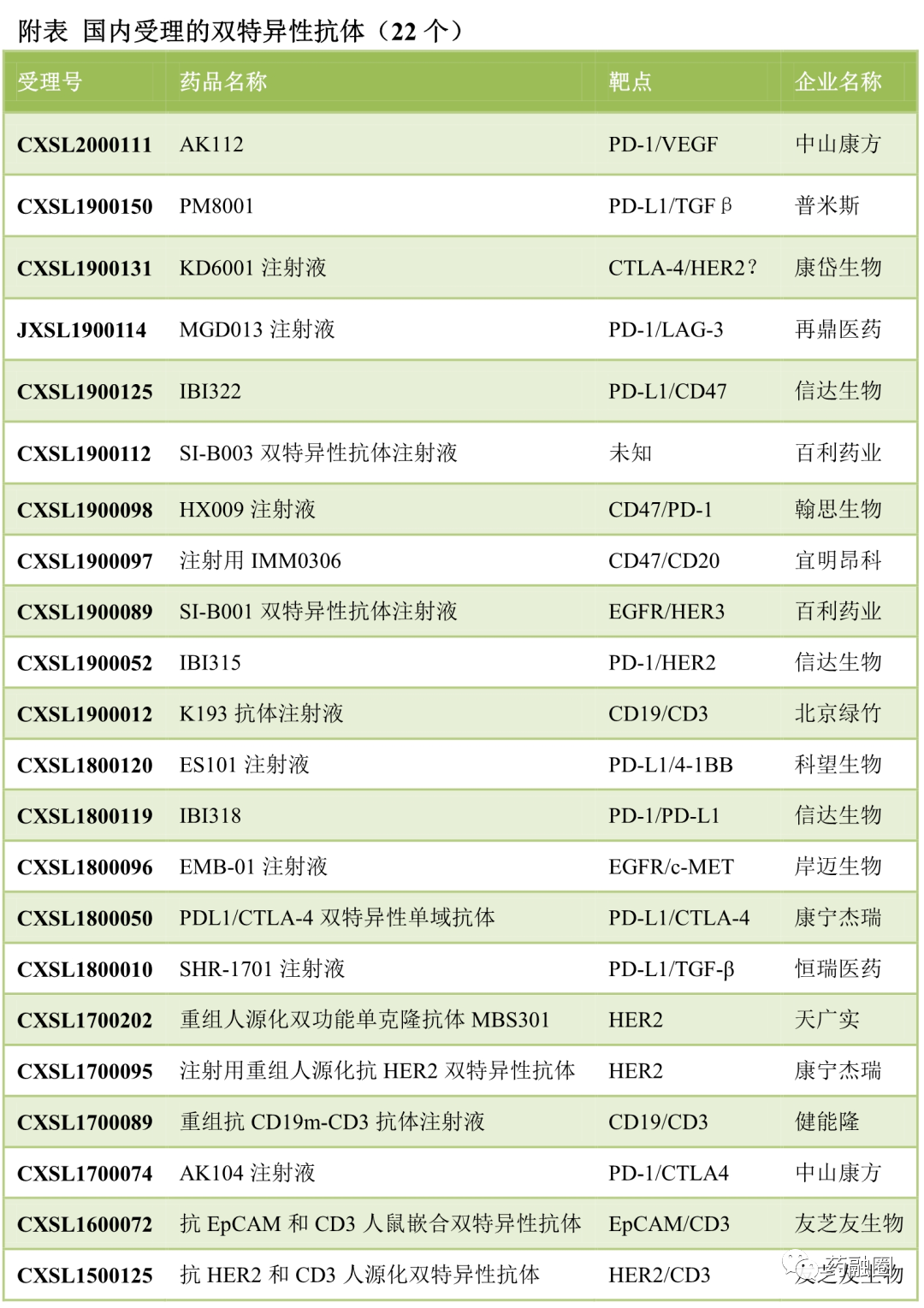
国内部分受理的双特异抗体
图片来源:生物制药小编(其中百利的未知靶点双抗可能为PD-1/PD-L1类)
生物制药小编预计:尽管PD-1/PD-L1单抗申报速度已经明显减缓,但仍不排除有新的药企进入。可以预见的是,以PD-1/PD-L1为基础的双抗将进入又一个激烈竞争的阶段,未来仍将快速增加。
药融圈数据观察:不少企业的PD-1/PD-L1抗体来自于外部合作研发或者收购;小分子新药企业或肿瘤药销售端的企业等等都想进入这个领域。合作,将是生物医药行业永恒旋律。
参考:
NMPA/CDE;
药融圈数据;
生物制药小编;佰傲谷;
FDA/EMA/PMDA;
相关公司公开披露;等等。
扫描上面二维码在移动端打开阅读