免疫疗法是人类攻克癌症历史上的一个里程碑式进展,以PD-1/PD-L1、CAR-T疗法等为代表的免疫疗法改变了很多癌症患者的生活。但不是每个患者都能从中受益,仍有许多癌症患者急需新的选择。为了解决这个问题,科学家们也一直在孜孜不倦地追求新的免疫疗法,个体化癌症疫苗就是其中的一种。
事实上,个体化癌症疫苗已成为近年来癌症免疫疗法研究领域的一颗新星,并被人类寄予厚望。2019年,《麻省理工科技评论》已将癌症疫苗评选为年度“十大突破性技术”之一。随着个体化癌症疫苗取得的进展和突破,它已被誉为继免疫检查点抑制剂和CAR-T疗法之后,癌症免疫领域或将会出现的第三大突破。
那么个体化癌症疫苗究竟是什么?它因何而被寄予厚望?目前的在研个体化癌症疫苗又主要治疗哪些疾病呢?
用疫苗治疗癌症的理念并不算新,早在100多年前,人们就意识到体细胞的突变可以带来新的免疫原性—— 基因突变会影响蛋白序列,蛋白序列的改变则会带来新的抗原表位。虽然这一理念简单易懂,但癌症疫苗一直没有得到有效的开发。在过去的几十年里,随着科学的进步和技术手段的发展,尤其是下一代测序(NGS)等技术的普及,这一创新疫苗的研发才取得了进步。
实际上,个体化癌症疫苗的开发是基于人体对癌症抗原的免疫反应。从肿瘤中释放的抗原会被像树突状细胞这样的抗原呈递细胞吞噬,经过处理后与主要组织相容性复合体相结合,呈现在细胞的表面。然后,这些呈现癌症抗原的细胞会迁移到淋巴结中,通过与T细胞表面的T细胞受体(TCR)结合,激活T细胞并促进它们的增殖。激活后的T细胞可以迁移到肿瘤附近,对肿瘤进行攻击。

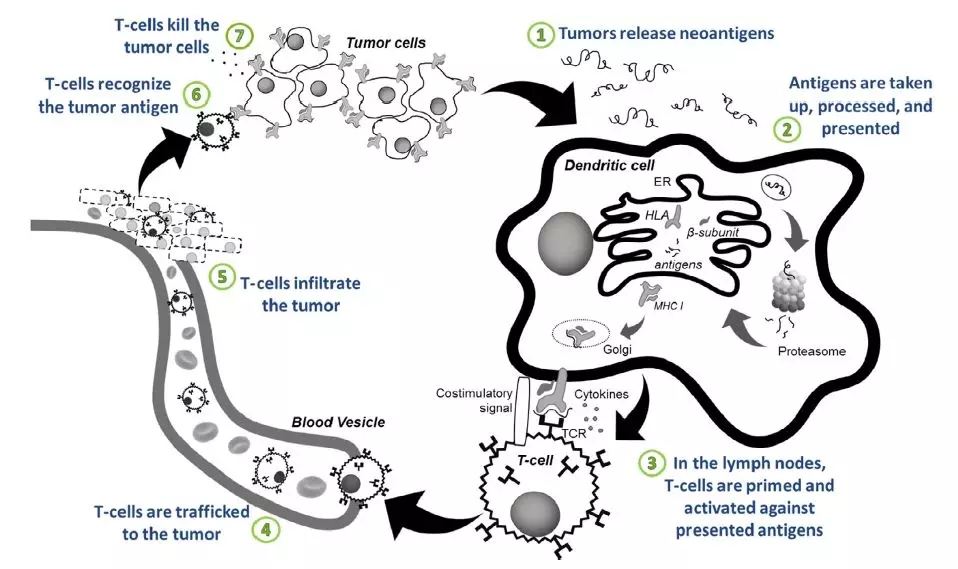
▲癌症免疫力产生的图示(图片来源:参考资料[1])
癌细胞常常具有基因突变,因此会产生新抗原(neoantigen)。由于这类新抗原通常只存在于癌细胞中,正常细胞中并没有,使它们成为了开发癌症疫苗的理想抗原。个体化癌症疫苗的开发策略就是,通过基因测序从癌症患者中找到因基因突变而在癌细胞中特异性表达的新抗原,然后利用这些新抗原来构建相应的癌症疫苗,输回体内激活免疫细胞,并杀灭带有上述抗原的癌细胞。
因为这些新抗原只在癌细胞中表达,个体化癌症疫苗可以实现更好的精准治疗,在消灭癌细胞的同时不伤害健康组织,降低毒副作用。正因为此,个体化癌症疫苗已被研究人员视为继免疫检查点抑制剂和CAR-T疗法之后,癌症免疫疗法领域或将出现的第三个大突破。
目前已有很多个体化癌症疫苗进入临床试验阶段。按照递送方式,这些疫苗可以被分为三大类:合成长多肽、RNA/DNA、和树突状细胞。这三种递送方式有着各自的利弊。
合成长多肽是最常见的递送个体化癌症疫苗的方式。多肽疫苗的优势在于由于是人工合成,它们的生产可以扩大化,而且多肽疫苗中可以包含多个新抗原表位,从而确保免疫细胞对疫苗产生免疫反应。长多肽片段与短多肽片段相比,除了激活CD8+ T细胞以外,还可以激活CD4+ T细胞,从而更好地激发免疫反应。不过,随着多肽链长度和多肽数目的增加,制造成本也随之提升。多肽链长度越长,人工合成时出现的错误率越高,从而限制了合成过程的产量。这些因素可能限制这类个体化疫苗未来的推广。
与长多肽类疫苗相比,使用DNA/RNA编码新抗原从制造工艺上来看更为简便,产品的质量检测也可以通过简单的测序来进行(多肽类疫苗的质量检测需要质谱技术)。它们可以编码多个新抗原表型,提高免疫系统产生免疫反应的机率。这类疫苗面临的最大挑战是如何将编码新抗原的DNA/RNA序列成功导入到细胞中,让它们能够被翻译成多肽片段。
上述两类癌症疫苗均需要在体内被树突状细胞或其它抗原呈递细胞吞噬并且处理才可能生效。与它们不同,基于树突状细胞的疫苗在体外就可以完成这一步骤,因为树突状细胞在免疫系统中的功能就是呈递抗原,所以这类癌症疫苗在激发免疫反应方面非常有效。不过,基于树突状细胞的疫苗合成需要对从血液中获取的免疫细胞进行谨慎的培养。在GMP环境下完成原先在实验室中进行的步骤,并且扩大树突状细胞疫苗的生产,需要对复杂制造工艺的大量优化。
目前,Moderna、BioNTech、Gritstone等公司都在在开发个体化癌症疫苗,许多临床试验也正在进行,以评估这些在研疫疫苗治疗不同癌症的安全性和疗效。以下我们分享几家专注这一创新疗法开发的公司,带大家了解下个体化癌症疫苗的研究进展以及它们针对的适应症。
Moderna目前有3个癌症疫苗研发项目。mRNA-4157是一种基于mRNA的新抗原肿瘤疫苗,可以编码高达34种新抗原。mRNA进入细胞后可翻译产生新抗原蛋白,这些新抗原可增强B细胞、T细胞的免疫应答,从而达到治疗的效果。目前该在研疫苗已进入2期临床阶段。同时,Moderna还在与默沙东(MSD)合作,探索mRNA-4157与Keytruda联用治疗实体瘤患者的疗效。
此外,Moderna还与默沙东合作开发了一款靶向KRAS突变体的mRNA KRAS疫苗。这款疫苗编码KRAS G12D,G12V,G13D,和G12C四种突变体,它们占KRAS突变的80-90%。目前,这款疫苗还在1期临床试验中接受检验。
2、BioNTech US(前身为Neon Therapeutics)
理论上,肿瘤细胞表面的特异性新抗原可以刺激免疫系统生成更多T细胞,从而达到杀伤表达这些新抗原的肿瘤细胞的目的。然而,很多新抗原由于表达水平或免疫原性较低,不足以激发足够的免疫反应。
BioNTech子公司BioNTech US 开发的新抗原疫苗旨在帮助募集更多的T细胞。该公司的技术平台首先对患者的肿瘤细胞进行基因组测序,发现能够产生新抗原的基因突变,然后通过生物信息学技术平台选择多达20种新抗原多肽片段进行人工合成。生成的新抗原疫苗再被注射回患者体内,激发T细胞的免疫反应。
该公司开发的NEO-PV-01是一种“量身定制”的个体化新抗原疫苗。在被BioNTech收购前,Neon已与百时美施贵宝(BMS)、默沙东(MSD)达成合作,探索癌症疫苗与抗PD-1疗法联合治疗癌症的效果。在一项针对晚期或转移性黑色素瘤、吸烟相关的非小细胞肺癌(NSCLC)、和膀胱癌患者的多中心1b期临床试验中,NEO-PV-01联合Opdivo(nivolumab)显着延长了患者的无进展生存期。
Gritstone公司主要利用其专有人工智能平台EDGETM和肿瘤HLA肽序列来开发RNA癌症疫苗,引导免疫系统对癌细胞展开精准攻击。在肿瘤细胞中,只有少量DNA突变会转化为新抗原,而EDGETM可以帮助研究人员从海量的人类肿瘤数据中挖掘出存在于患者体内的肿瘤特异性新抗原(TSNA)。
依托EDGETM平台,Gritstone已经打造出了两款候选免疫疗法产品:一款名为GRANITE-001,这是一款个体化癌症疫苗,已经获得美国FDA快速通道资格,用于治疗微卫星稳定型转移性结直肠癌患者;另一款为SLATE-001,是一种即用型癌症疫苗,主要针对具有常见肿瘤新抗原的特定患者亚群。
根据Gritstone在2019年ESMO大会上发布的数据,这两款候选疫苗在1期临床试验中取得了积极的免疫原活性和安全性数据。在低剂量患者组中获得的初步结果表明,两款在研疫苗不但具有良好的耐受性和安全性,还可以快速、稳定地激活新抗原特异性CD8阳性T细胞,并且扩增已有的T细胞。
Transgene公司也在进行癌症治疗性疫苗的开发。该公司的个体化免疫治疗平台——myvac™技术,旨在利用患者自身的癌症特异性基因突变来刺激患者的免疫系统,从而识别并消灭肿瘤。目前,基于myvac™技术平台设计的免疫疗法TG4050已进入1期临床。
TG4050是一款基于MVA病毒载体的治疗性疫苗,该载体已被证明具有生物活性并具有引发针对肿瘤抗原的免疫应答的能力。TG4050表达利用NEC公司的人工智能(AI)算法选择的肿瘤新抗原,NEC公司的AI新抗原预测系统可以识别和选择患者的特异性突变,TG4050表达的30多种肿瘤新抗原均由NEC的AI系统选择。
目前,TG4050进入两项1期临床试验,这两项研究将分别在接受手术和一线化疗后的卵巢癌患者,以及经手术及辅助治疗后的头颈癌患者中,评估TG4050的安全性和免疫原性,并为与其它疗法联合用药做铺垫。
Tedopi是OSE Immunotherapeutics公司开发的一种癌症疫苗,它的设计非常有特点——从5个肿瘤相关抗原中筛选出10个最佳新抗原表位(neo-epitope),再进行组合,刺激T淋巴细胞识别和攻击癌细胞。早期研究证明,Tedopi可激发细胞毒性T细胞对癌细胞的特异性反应和相关的辅助型T细胞反应,这些癌细胞表达了至少一种肿瘤相关抗原。
目前,OSE Immunotherapeutics公司正在非小细胞肺癌(NSCLC)、胰腺癌等多种癌种中探索Tedopi的疗效。在一项针对IIIB期和IV期NSCLC患者2期临床研究中,接受Tedopi治疗的晚期SCLC患者,与预期生存期相比,中位总生存期(mOS)有一定增长。此外,该公司还在探索Tedopi与PD-1抑制剂等联合用药的抗癌效果。
Genocea Biosciences成立于2007年,是一家致力于设计和提供癌症靶向疫苗和免疫疗法的生物医药公司,拥有专利技术平台ATLAS™,该公司主要的新抗原癌症疫苗GEN-009用于治疗黑色素瘤、肺癌,目前已进入1/2a期临床试验阶段。
根据该公司在ASCO上公布的最新数据,在中位随访时间超过1年的情况下,8名接受GEN-009辅助治疗的患者中,有7名患者没有出现疾病进展,而且疫苗的耐受性良好。
Elicio公司开发了一款靶向“不可成药”靶点KRAS的癌症疫苗ELI-002。ELI-002包含7个KRAS突变体(mKRAS)肽段,接种后产生的免疫应答能够产生对KRAS蛋白突变体的强力免疫反应。该疫苗不但可以激活CD8阳性T细胞,还可以激发CD4阳性T细胞的反应。在体外用mKRAS特异性多肽再刺激时,可产生高水平的Th1辅助细胞因子。在体内,通过疫苗免疫应答产生的T细胞对表达mKRAS的靶细胞具有强大细胞裂解功能。
据介绍,ELI-002可覆盖99%携带KRAS基因突变的肿瘤。临床前试验数据表明:ELI-002能够引发对KRAS蛋白突变体的强力免疫反应,导致T细胞对表达KRAS突变体的靶细胞产生强大的细胞裂解功能。
除了上述癌症疫苗外,还有一些公司在开发靶向MUC1、WT1等靶点的癌症疫苗。MUC1是一种高度糖基化的跨膜蛋白。MUC1高度表达和糖基化异常在包括三阴性乳腺癌等多种实体瘤中出现,因此成为靶向免疫疗法的新靶点。目前有多款基于MUC1的癌症疫苗处于临床研发阶段。
WT1是威尔姆斯瘤1基因(Wilms' tumor1, WT1)编码的转录因子。已有研究显示,它可能在白血病、乳腺癌、卵巢癌等血液癌症和实体瘤中起到致癌作用。目前,靶向这一靶点的免疫疗法类型主要为癌症疫苗。
已有的癌症疫苗研究表明,获得强力免疫反应需要三个因素:多个具有免疫原性的抗原,有效的递送载体,和克服免疫抑制环境的有效方法。因此,与抗PD-1抗体等免疫检查点抑制剂联用可能是个体化癌症疫苗充分发挥其潜力的有效方法。此外,开发验证疫苗效力的生物标志物将帮助对疫苗进行检测和筛选,从而最大化疫苗的效果。
我们期待,在生态圈所有成员的努力下,个体化癌症疫苗研究能够快速发展,充分发挥它的潜力,成为继免疫检查点抑制剂和CAR-T疗法之后癌症免疫领域的第三个突破!
参考资料
[1] The New Personalized Cancer Treatment: Why Neoantigen Vaccines Could Be The Next Big Immunotherapy Breakthrough. Retrieved Aug. 9, 2019, from https://www.cbinsights.com/research/report/what-are-neoantigen-vaccines- personalized-cancer-treatment/
[2]个体化癌症疫苗,如何才能成为癌症免疫疗法的第三大突破?Retrieved Aug. 14, 2019, from https://mp.weixin.qq.com/s?__biz=MzAwMDA5NTIxNQ==&mid=2649986098&idx=1&sn=84b8d20c29e364c697b77aa113a9f416
[3]大幅度提高新抗原特异性T细胞水平,RNA癌症疫苗获得积极数据. Retrieved Dec. 16, 2019, from https://mp.weixin.qq.com/s?__biz=MzAwMDA5NTIxNQ==&mid= 2649989827&idx=5&sn=b75b435ee79f563d4fb79e48b03adf55
[4]Transgene and NEC Start Two Clinical Trials with TG4050, an Individualized AI-Powered Cancer Vaccine for Ovarian and Head & Neck Cancers Retrieved Jan 8, 2020 from https://www.businesswire.com/news/home/20200106005860/en
[5]这种创新癌症疫苗,是否会成为肺癌的“终结者”?Retrieved Oct. 30, 2020 from https://mp.weixin.qq.com/s?__biz=MzAwMDA5NTIxNQ==&mid=2649988315&idx=2&sn=c6f4c5a913068dde3f4f92c4c4ca1b83
[6] 各公司官网及公开信息。

扫描上面二维码在移动端打开阅读






