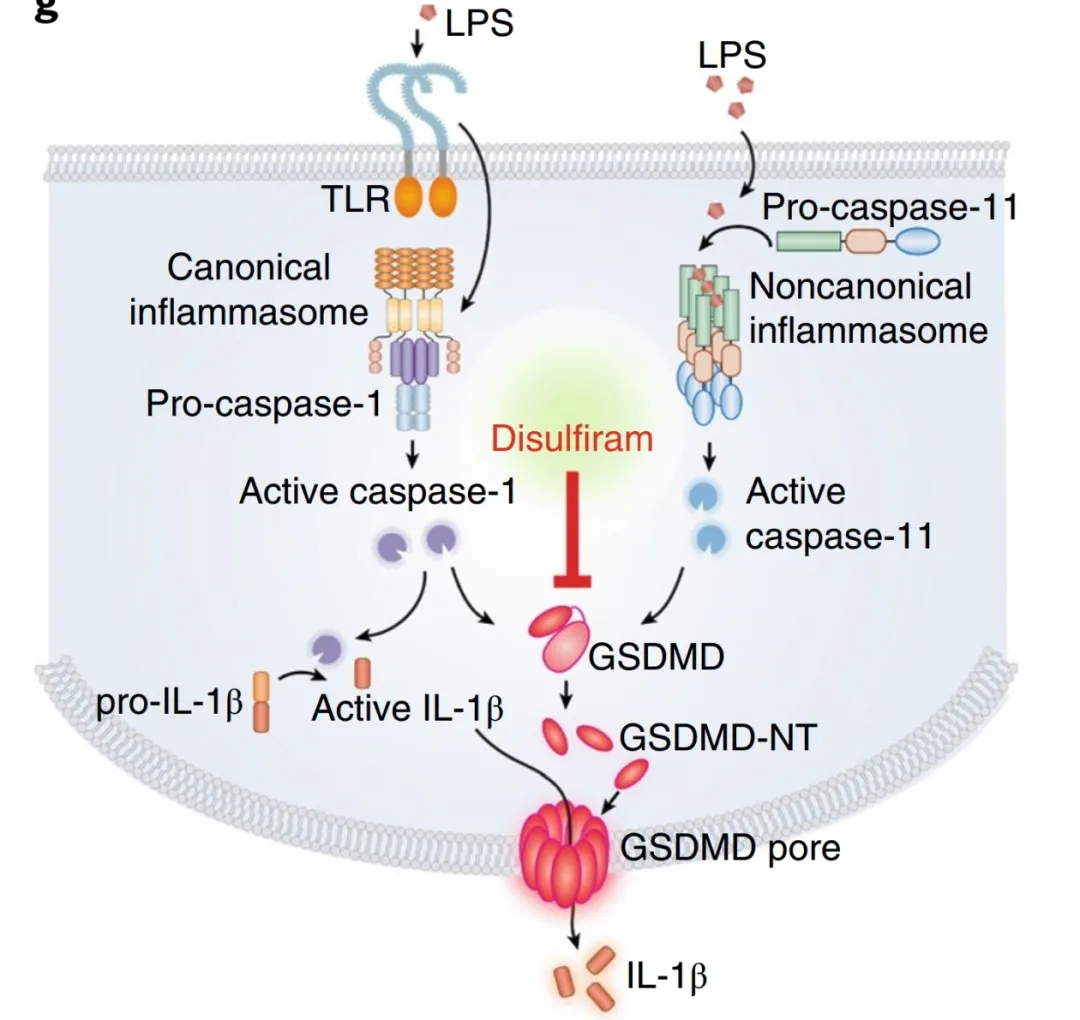
背景:
GSDMD作为炎性小体激活下游的最终共同效应因子,在N末端结构域(GSDMD-NT)和自抑制C末端结构域(GSDMD-CT)交界处被炎性caspases裂解。GSDMD-NT与质膜内叶的酸性磷脂结合,低聚形成孔隙,破坏质膜的完整性,既能释放由caspase-1处理的促炎细胞因子IL-1β蛋白和IL-18,并诱导炎性细胞死亡。
目前,脓毒症的治疗仅限于抗生素和支持治疗。包括抑制炎症细胞因子和凝血因子在内的数百项临床试验都未能提高脓毒症患者的存活率。炎症细胞因子和凝血因子是脓毒症下游的效应因子。有效地、特异性调节炎症小体激活、细胞因子成熟和焦亡的药物可能是治疗脓毒症和炎症的有价值的治疗药物,但目前还没有。虽然许多传感器和介质都能触发焦亡作用,但GSDMD-NT等GSDM家族成员的成孔是一个很有前景的药物靶点,因为形成孔是病原菌或危险信号引起的焦亡和炎性细胞因子释放的常见的最后一步。
简介:
2020年1月30日,来自美国波士顿儿童医院的Program in Cellular and Molecular Medicine的Xing Liu、Judy Lieberman 和Hao Wu教授课题组在Nature Immunology(IF: 23.53)杂志上发表题为“”的文章[1]。该研究表明双硫仑可阻断细胞的焦亡和细胞因子的释放,并可阻断脂多糖诱导的小鼠的败血性死亡。双硫仑抑制GSDMD的作用为该药物安全用于对抗炎症提供了新的治疗指征。
主要结果:
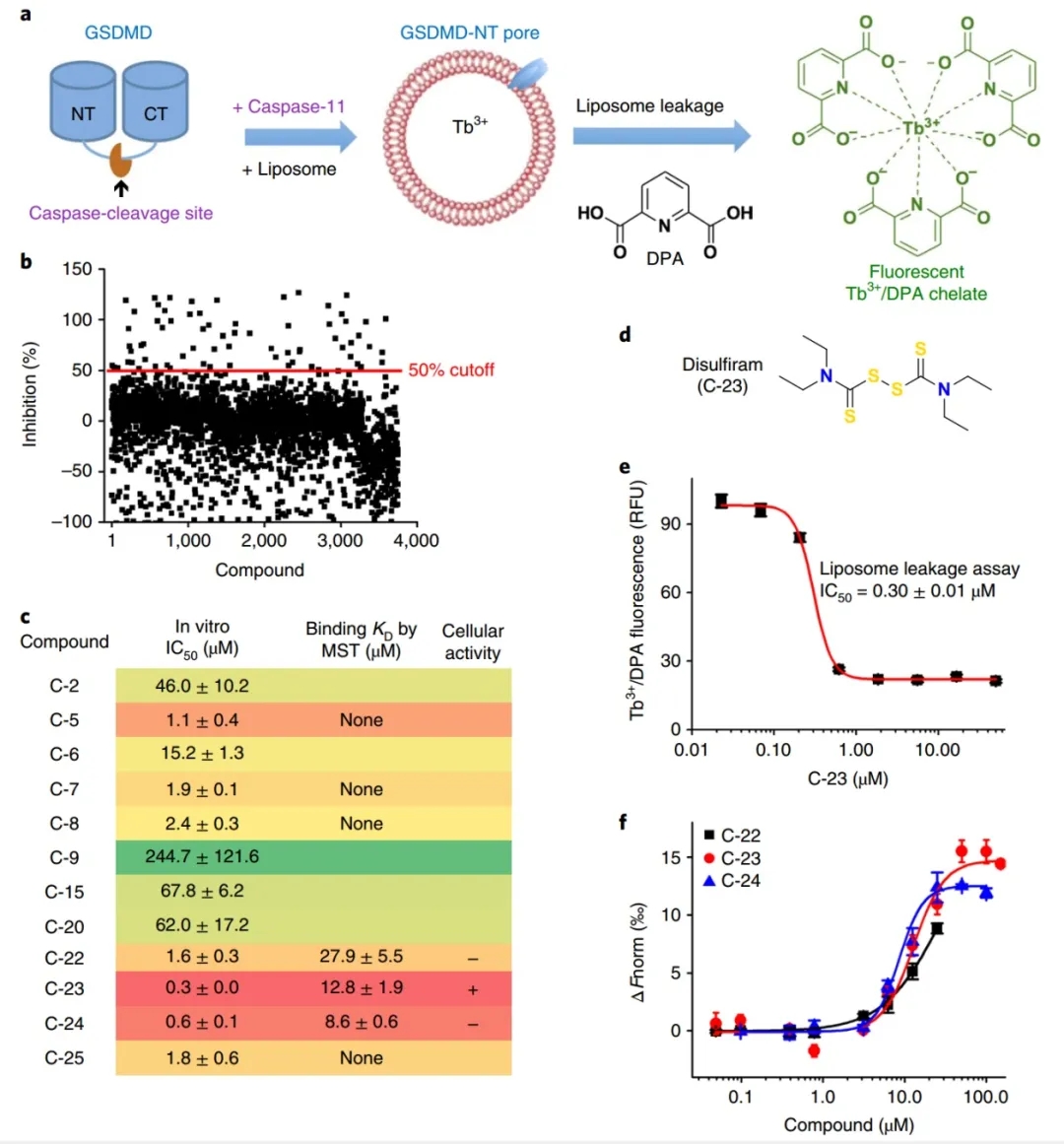
高通量筛选发现双硫仑是GSDMD诱导的脂质体渗漏的有效抑制剂。
研究人员通过荧光脂质体渗漏试验进行了高通量筛选以发现GSDMD的抑制剂,该试验检测了装载铽(Tb3+)的脂质体与GSDMD和caspase-11孵凝后的泄漏Tb3+。最初从哈佛大学ICCB-Longwood收集的3752个小分子中筛选,寻找能抑制脂质体渗漏的至少50个化合物。在排除了与许多生物靶标和GSDMD无关的荧光猝灭剂发生非特异性反应的泛分析干扰化合物后,作者鉴定出了22种活性化合物(命中率为0.6%),并测量了它们的最大半抑制浓度(IC50)值。最有效的抑制剂是C-23,其IC50为0.30±0.01uM。C-22、-23和-24的IC50值均较低,并通过微尺度热泳(MST)直接与GSDMD结合,一种通过检测样品温度变化时荧光变化来定量结合的技术。
图1:高通量筛选鉴定双硫仑作为GSDMD孔形成的抑制剂。
双硫仑抑制细胞焦亡。
为评估C-22, -23和-24是否抑制焦亡,在利用尼日利亚菌素激活经典的NLRP3炎症小体之前,研究人员添加了这些化合物到PMA分化和LPS-致敏的人类THP-1细胞,或在LPS电穿孔激活非经典的炎症小体之前添加到小鼠永生化骨髓来源的巨噬细胞(iBMDMs)。只有C-23在典型的人类和非典型的小鼠炎症小体通路中阻止焦亡。抑制表现为细胞存活率,通过CellTiter-Glo ATP发光来评估;膜透性,通过吸收膜渗透性染料SYTOX green来评估。此外,双硫仑可以抑制THP-1中尼日利亚菌素诱导的IL-1β分泌,也可以抑制LPS转染诱导iBMDM的IL-1β分泌,其效力与泛caspase抑制剂z-VAD-fmk相当。相反,双硫仑对TNF、线粒体衍生的caspases模拟激活剂(SMAC)和z-VAD-fmk诱导的HT-29细胞坏死无影响。这些数据表明,双硫仑可抑制由典型和非典型炎性小体引起的人和小鼠细胞的焦亡,但不能抑制坏死性凋亡。
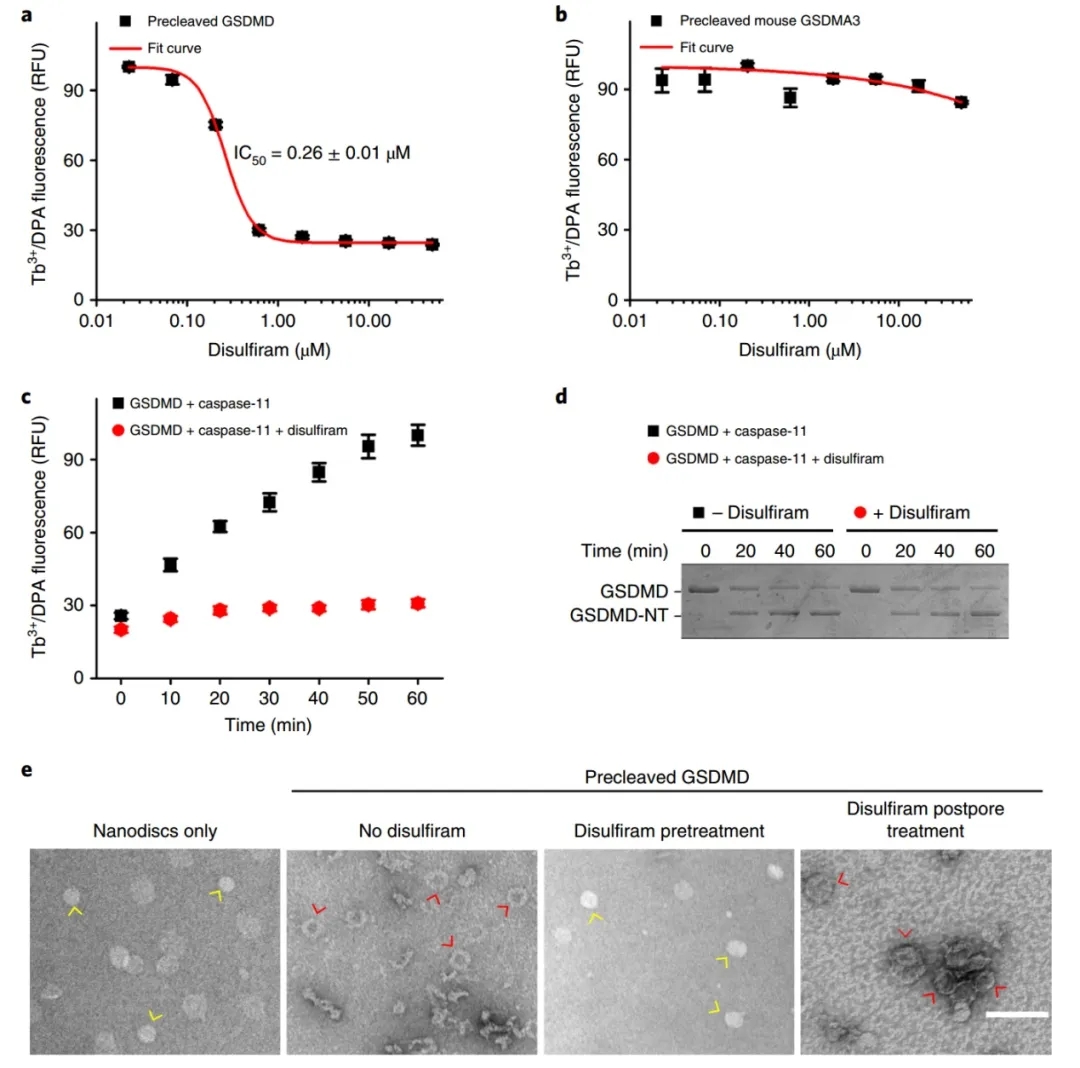
脂质体渗漏抑制主要是通过直接形成GSDMD孔介导的。
为了分离caspase-11和GSDMD抑制对小孔形成的相对贡献,研究人员首先通过预先裂解的GSDMD检测脂质体渗漏。双硫仑通过预先裂解的GSDMD抑制脂质体渗漏,其IC50为0.26±0.01 uM,这与其抑制全长GSDMD+caspase-11的IC50为0.30±0.01 uM相当。双硫仑不抑制预裂GSDMA3的成孔,说明二双硫仑不抑制整个GSDM家族。然后,在双硫仑(50uM)存在或不存在的情况下,作者进行了脂质体渗漏和caspase-11裂解GSDMD的时间过程。双硫仑对caspase-11处理的GSDMD没有影响,但如果双硫仑存在时,处理后的GSDMD-NT不会引起脂质体渗漏。并发现,双硫仑抑制小孔的形成,但不分解已经形成的小孔。
图2:双硫仑对脂质体渗漏的抑制主要是通过直接抑制GSDMD孔的形成来介导的。
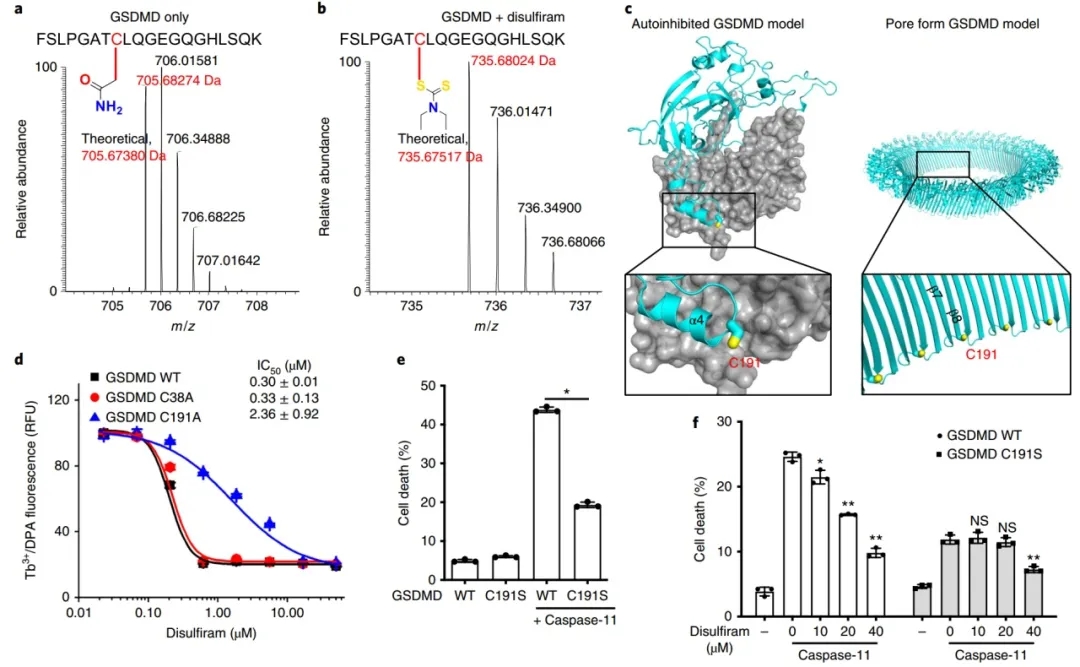
双硫仑对人的GSDMD靶向Cys191。
为了探讨双硫仑抑制GSDMD的机制,研究人员采用纳米液相色谱串联质谱(nano-LC-MS/MS)分析了双硫仑对人GSDMD的抑制作用。胰蛋白酶片段显示Cys191的二硫代二乙基氨基甲酰加合物,其中一半对称的二硫脲分子附着在硫醇上。事实上,Cys191对于细胞中GSDMD孔的形成是重要的,因为小鼠GSDMD中相应的Cys192的Ala突变抑制了寡聚化。该Cys残基在GSDMD中保守,但在其他GSDM家族成员中不保守,在全长自抑制结构和基于小鼠GSDMA3结构生成的N端孔形态模型中均可获得。为了证实双硫仑作用于Cys191,作者首先比较了野生型、C38A对照或C191A人GSDMD + caspase-11处理脂质体的成孔情况。双硫仑作用于C191A GSDMD的IC 50大约是野生型GSDMD的8倍,而C38A的活性与野生型GSDMD相似,这证实了Cys191对双硫仑活性的重要性。虽然单独野生型和C191S突变GSDMD并不影响细胞的存活,但野生型GSDMD和caspase-11共同作用导致大量细胞死亡,而C191S突变GSDMD和caspase-11的细胞死亡降低。
为了进一步证实双硫仑作用于Cys191,作者接下来评估了双硫仑对表达caspase-11和野生型或C191S GSDMD的HEK293T细胞中LDH释放的抑制作用。如预期的那样,双硫仑从最低测试浓度开始,以剂量依赖的方式明显抑制野生型GSDMD诱导的细胞死亡,但只有加入四倍的双硫仑,才能抑制caspase-11和C191S GSDMD表达引起细胞死亡的减少。这些数据表明双硫仑主要通过共价修饰Cys191来抑制GSDMD孔的形成。进一步发现,GSDMD孔的形成,而不是它的裂解或炎症小体途径中的其他早期事件,是双硫仑的主要靶点。
图3:双硫仑共价性调节GSDMD Cys191。
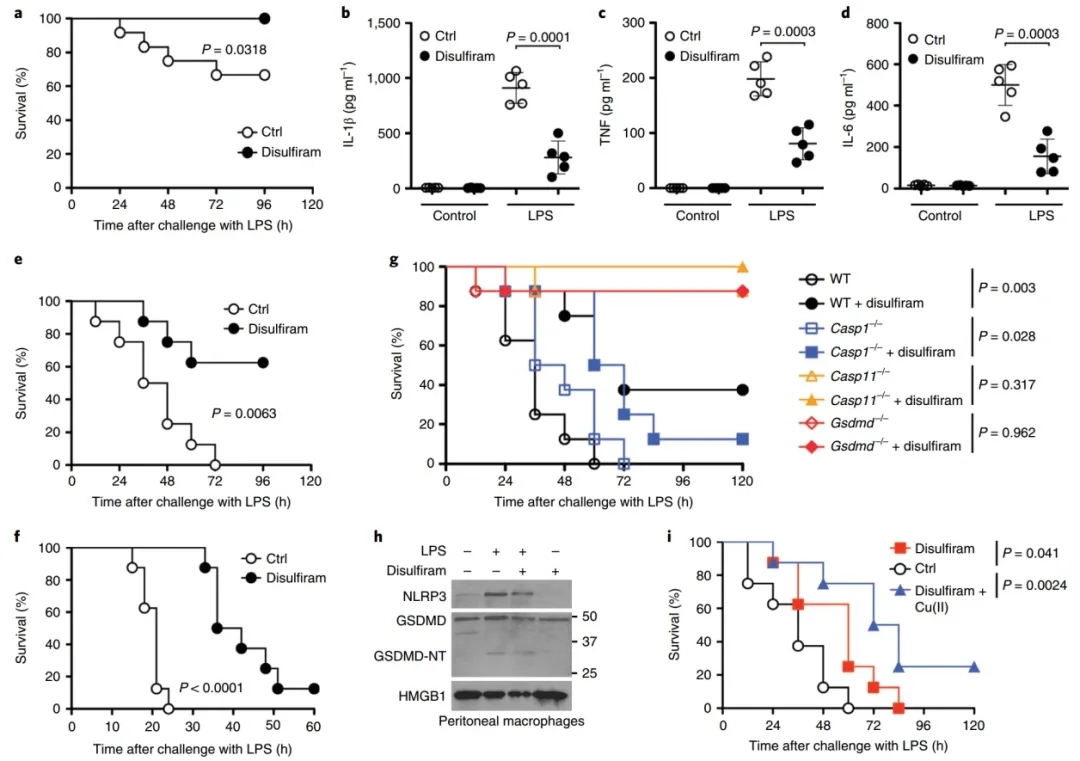
双硫仑抑制脂多糖诱导的小鼠败血症。
为研究双硫仑在体内的作用,研究人员在C57BL/6J小鼠中检测了脂多糖诱导的脓毒症。最低浓度的LPS (15 mg kg-1)在96小时后杀死8只对照组小鼠中的3只,但所有经双硫仑处理的小鼠均存活(P=0.0318)。所有小鼠均存活12小时后,血清IL-1、TNF和IL-6浓度显著降低。在最高LPS刺激下(50 mg k g-1),虽然所有的对照组小鼠在一天内死亡,但经过双硫仑处理大大延迟了死亡,8只小鼠中有1只存活。在LPS处理后双硫仑治疗可明显延迟死亡。为了确定Cu(II)是否能改善对脓毒症的保护,作者还研究了Cu(II)的补充是否能增强LPS后给予双硫仑的有效性。与模拟处理的对照组小鼠相比,葡萄糖酸铜预处理并在LPS刺激后给予双硫仑提高了存活率。尽管所有的对照组小鼠和仅用双硫仑治疗的小鼠都死亡,但在8只同时使用Cu(II)和双硫仑的小鼠中,有2只存活了下来。
图4:双硫仑对LPS诱导的脓毒症有保护作用。
其他报道的GSDMD抑制剂并没有直接抑制GSDMD孔的形成。
据报道,Cys反应性坏死性凋亡抑制剂NSA和Bay 11-7082分别抑制GSDMD介导的炎性反应和NLRP3炎性反应。为阐明双硫仑是否不同于其他Cys-reactive化合物如富马酸二甲酯(DMF,用于治疗牛皮癣和多发性硬化的药物),afatinib(一种抑制表皮生长因子受体家族激酶的药物)和ibrutinib(一种抑制布鲁顿酪氨酸激酶的药物),作则研究了影响GSDMD和caspase-11-mediated脂质体渗漏。发现并不是所有的Cys反应性化合物都对GSDMD有活性,双硫仑是目前为止唯一直接有效的GSDMD抑制剂。
结论:
本文数据表明,双硫仑在几个方面对GSDMD具有选择性。首先,在炎性小体途径的步骤中,双硫仑主要阻断GSDMD孔的形成,但对早期步骤的影响不大。第二,许多FDA批准的Cys修饰药物,包括用于治疗多发性硬化症的高反应性DMF,对GSDMD没有表现出活性,这表明Cys反应基团的存在本身不足以改变GSDMD和阻碍孔的形成。第三,尽管双硫仑也可能由于其Cys反应性质而修饰细胞中的其他蛋白,但这些修饰的结果对炎症小体途径并不重要,也不具有细胞毒性。考虑到目前炎症治疗的不足,将这一古老的药物用于治疗炎症性疾病是值得探索的。
原文链接:https://www.nature.com/articles/s41590-020-0669-6
参考文献:
1. Hu JJ, Liu X, Xia S, Zhang Z, Zhang Y, Zhao J, Ruan J, Luo X, Lou X, Bai Y et al: FDA-approved disulfiram inhibits pyroptosis by blocking gasdermin D pore formation. Nat Immunol 2020.
扫描上面二维码在移动端打开阅读