中性粒细胞是一种免疫细胞,它为人体提供抵御感染的第一道防线。然而,在许多情况下,中性粒细胞也有促进癌细胞转移的能力。6月11日,最新发表在Nature杂志上的一篇论文中,来自中山大学孙逸仙纪念医院的科学家团队解释了中性粒细胞是如何帮助这一致命过程的。
来源:Nature
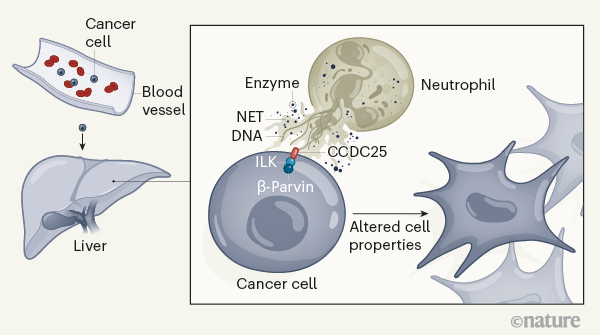
中性粒细胞的一个关键特征是它们能够将一种被称为中性粒细胞胞外陷阱(neutrophil extracellular trap,NET)的结构挤压到周围环境中。NET是一种由被有毒性的酶覆盖的DNA组成的网状结构,正常情况下能够捕获并杀死入侵的微生物。然而,越来越多的证据表明,NET介导了癌细胞侵袭特性的发展和增强,但它们是如何促进癌细胞转移的很大程度上仍是未知的。
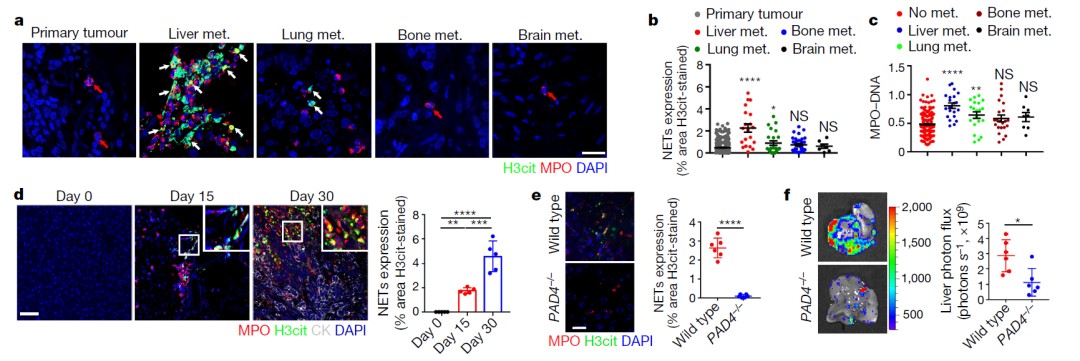
在这项新研究中,科学家们首先评估了544例乳腺癌患者原发性和转移性肿瘤中的NET。结果显示,原发性肿瘤中很少有NET,但是在肝转移(乳腺癌扩散的一个常见部位)部分有大量NET。更重要的是,研究人员还发现,早期乳腺癌患者血液中的NET DNA水平较高与之后癌症向肝脏转移有关。这表明监测血样中的NET DNA可能是一种评估疾病预后的方法。
为了调查NET和癌细胞的关系,研究者们将人源或鼠源的乳腺癌细胞移植到小鼠体内,并分析转移性肿瘤细胞。结果显示,NET在两种小鼠模型的肝脏中都有积累。这一发现与来自患者的分析结果一致。
研究报告称,在小鼠模型中,在转移性细胞可被在肝脏中检测到之前,NET就已经在那里“出现”了。研究发现,癌细胞转移到肝脏中的能力依赖于NET,因为在当移除NET后(通过DNA降解酶DNase I,或小鼠被基因改造使缺乏NET形成所需要的一种酶),转移大大受损。
尽管先前有研究提出观点,认为NET依赖性肝转移的发生是通过“NET捕获了过路癌细胞”这种间接机制发生的,但新研究揭示,在体外测试中,NET DNA直接刺激了人类乳腺癌细胞的迁移。
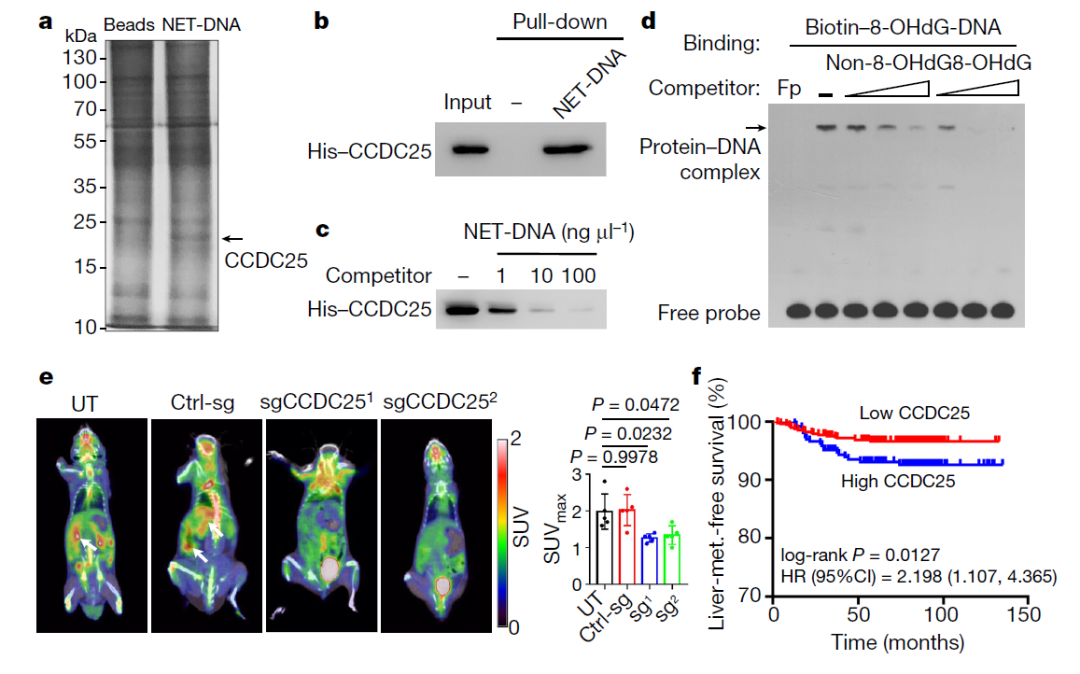
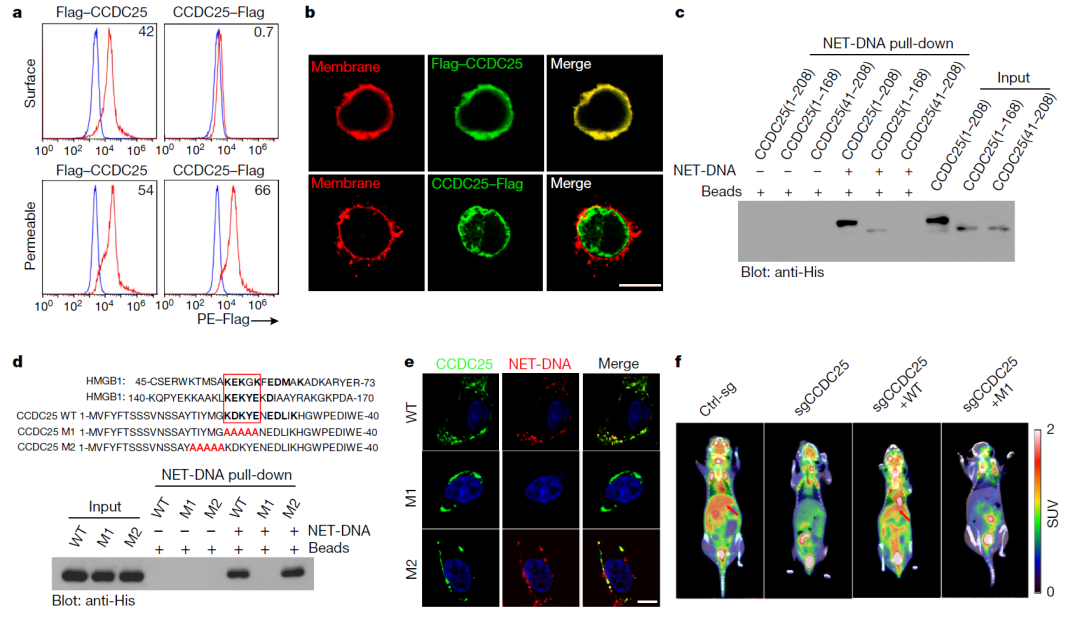
研究进一步调查了这种迁移行为是如何被诱导的。通过添加一个标签到NET DNA上,研究人员希望找到与其互相作用的蛋白。最终,他们发现,一个被称为CCDC25的受体会与NET DNA结合。CCDC25存在于癌细胞的表面,可以高特异性和亲和性与NET DNA结合,使癌细胞能够感知NET。令人印象深刻的是,研究者们还鉴定出了CCDC25与NET DNA结合的特定细胞外部分。
研究证实,NET介导的癌细胞迁移刺激是由CCDC25驱动的。因为,当从体外培养的人类乳腺癌细胞或患者的原代乳腺癌细胞样本中去除CCDC25,在体外测试中,癌细胞的迁移大大下降。与CCDC25仍然存在的小鼠相比,将CCDC25从小鼠癌细胞表面去除,显著减少了肝脏转移的形成,同时还减少了脂多糖处理后肺转移(之前有报道称,LPS触发肺转移的作用与NET有关)。
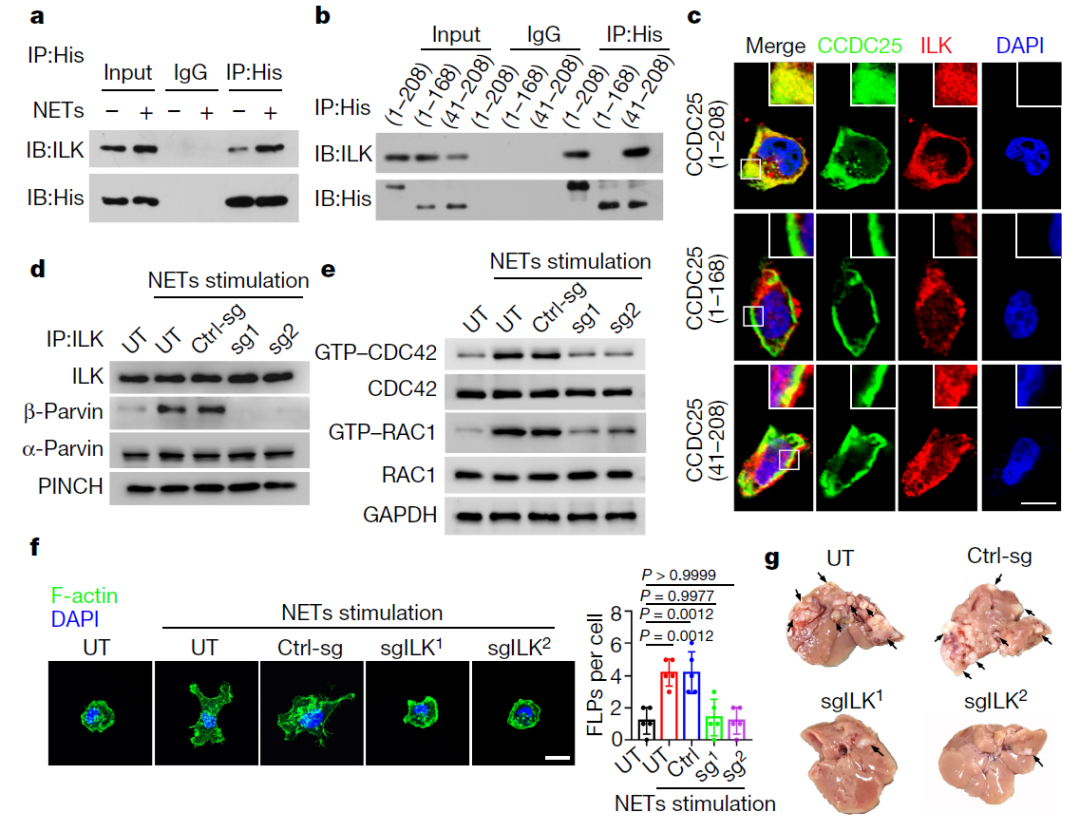
最后,科学家们揭示了肿瘤细胞是如何从NET与CCDC25的互相作用中获益的。他们找到了癌细胞中与CCDC25相互作用的蛋白质——整合素连接激酶(integrin-linked kinase, ILK),一种调节细胞迁移和增殖等过程的酶。当ILK或其下游信号伙伴被移除,蛋白质β-parvin会失去功能,癌细胞在体内的生长和运动会严重受损,在小鼠中,肝转移会减少。这些结果表明,NET DNA与CCDC25的结合通过激活一个ILK介导的信号级联增强了癌细胞的侵袭性行为。
研究另一个重要发现是,NET DNA促进肝转移的能力并不是乳腺癌特异性的。在结肠癌患者的肝脏转移和注射了人类结肠癌细胞的小鼠肝脏肿瘤中也观察到了NET。如果人类乳腺癌和结肠癌细胞被改造以增加CCDC25的水平,这有助于促进注射了这些癌细胞小鼠的肝转移。
此外,至关重要的是,科学家们发现了原发性肿瘤中CCDC25的高丰度与多种癌症类型患者较短的长期生存期之间的相关性,这表明监测CCDC25的表达可能有助于预测预后。
图5 一个促进癌细胞扩散的过程(图片来源:Nature)
未来的研究需要评估靶向CCDC25用于抗癌治疗的可行性。CCDC25在不同类型细胞中的表达及在正常细胞中的可能功能也有待调查。由于研究已经鉴定出了CCDC25与NET DNA相互作用的精确细胞外部分,有可能开发特定的抑制剂来阻止这种相互作用。
Nature杂志配发的评论文章指出,来自中山大学孙逸仙纪念医院的这项新成果代表了抑制癌症扩散方面的一个关键进展,并可能会带来一种全新的抗癌疗法。
相关论文:
[1] Linbin Yang et al. DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25. Nature(2020).
参考资料:
1# Neutrophil ‘safety net’ causes cancer cells to metastasize and proliferate(来源:Nature)
扫描上面二维码在移动端打开阅读