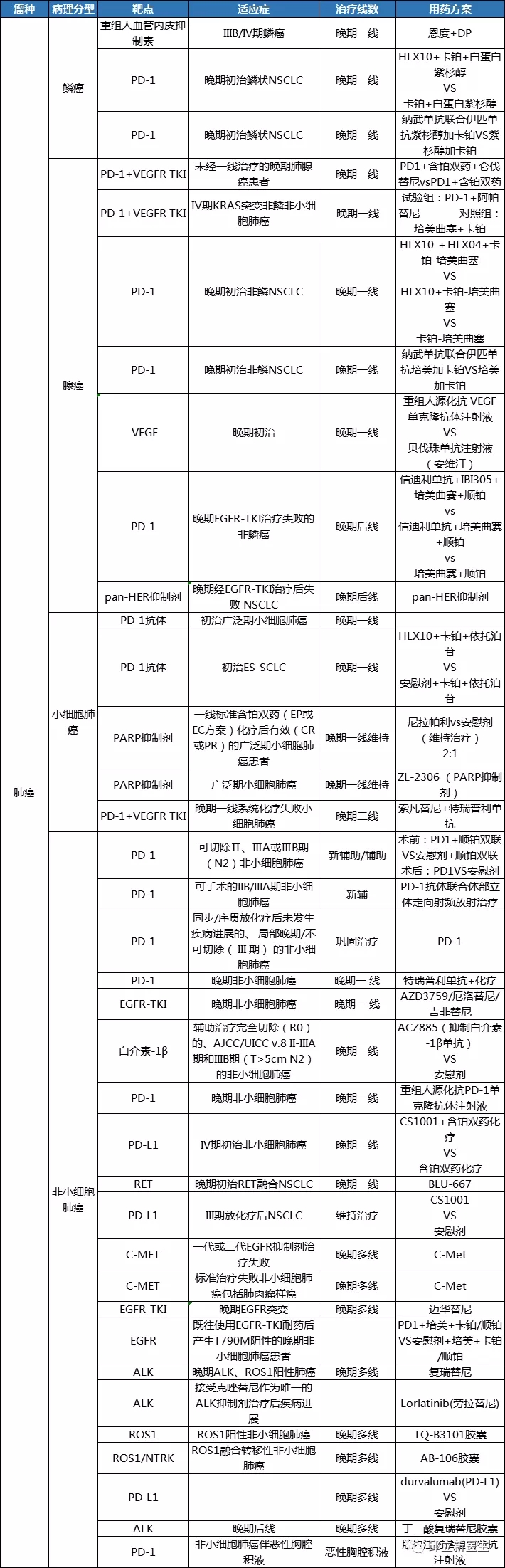
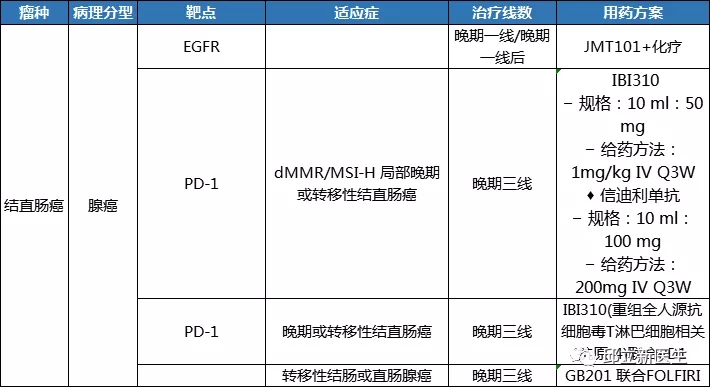
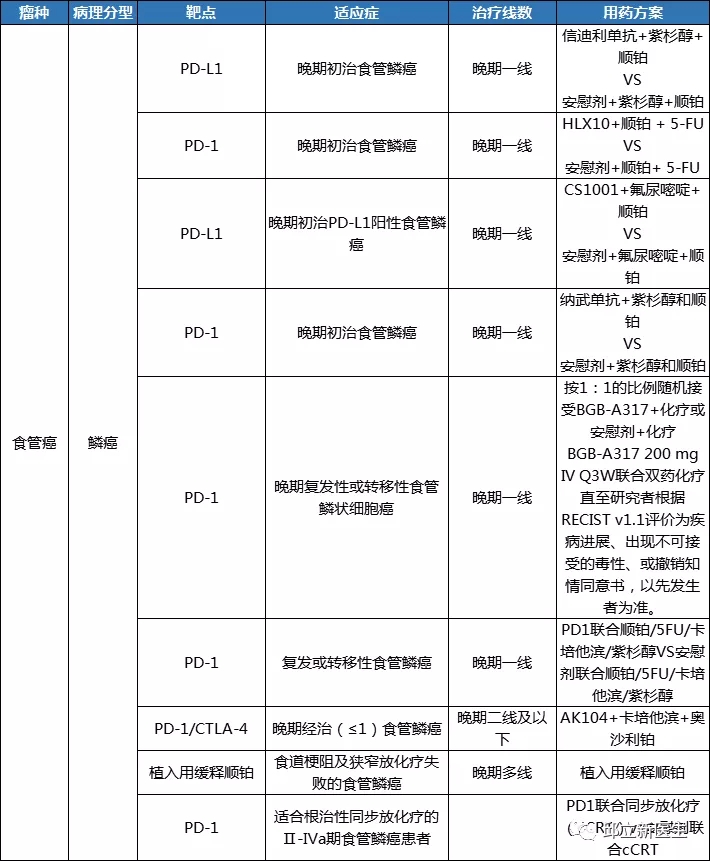
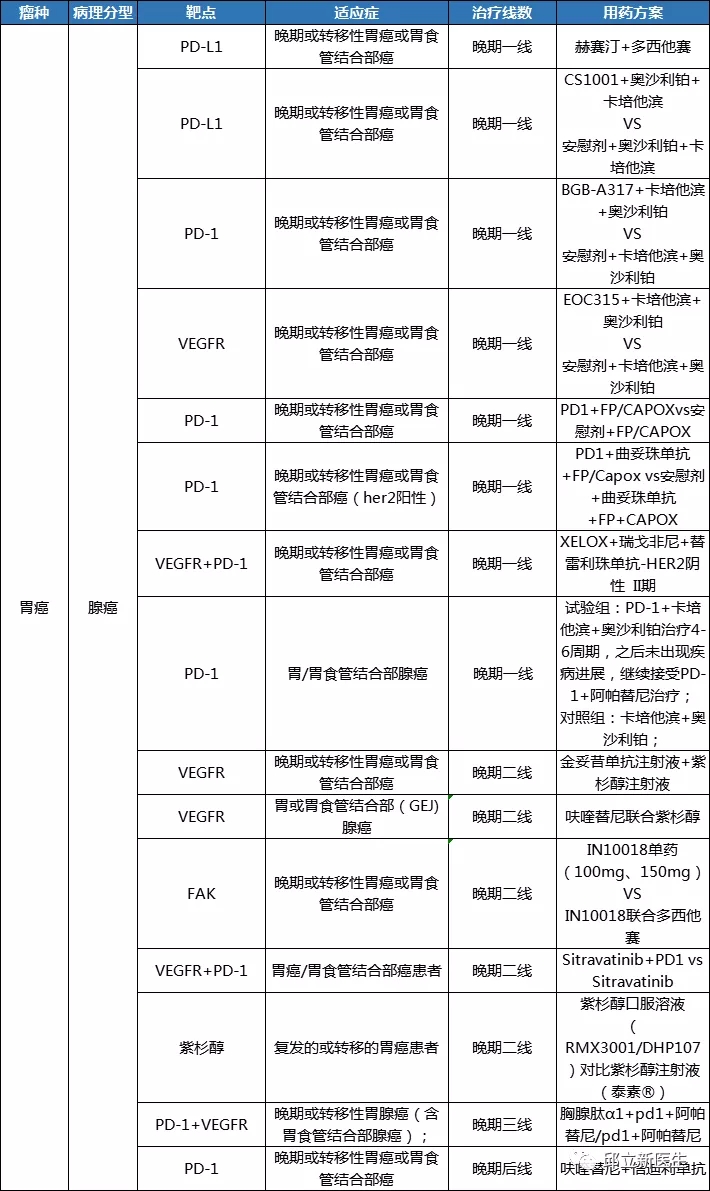
靶向治疗是目前抗癌药物研究的热点,它所代表的是高端精准治疗的医疗理念。靶向治疗通过应用患者的基因突变信息,进而达到精准的防、治肿瘤的目的,是一种高效而又安全的治疗肿瘤的方法。相信通过前段时间邱医生的介绍,大家对靶向治疗都有了一定的认识,今天呢,邱医生再来帮各位小小的总结一下,提炼提炼靶向治疗重点内容。
现在国内外获批的靶向药物有很多,按照作用靶点可以归为以下的这几类:
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 | 价格(每月) 报销前 |
| 吉非替尼 | 易瑞沙 | 美国2003年 中国2007年 |
阿斯利康 | 是 | 6840元 |
| 厄洛替尼 | 特罗凯 | 美国2004年 中国2012年 |
罗氏 | 是 | 5467元 |
| 埃克替尼 | 凯美纳 | 中国2011年 | 贝达药业 | 是 | 5300元 |
| 阿法替尼 | 吉泰瑞 | 美国2013年 中国2017年 |
勃林格英格翰 | 是 | 6000元 |
| 达可替尼 | Vizimpro | 美国2018年 中国2019年 |
辉瑞 | 否 | 15000元 |
| 奥西替尼 | 泰瑞沙 | 美国2015年 中国2016年 |
阿斯利康 | 是 | 15000元 |
试验标题:
9291类似药YK-029A片对经既往EGFR-TKI治疗后由T790M基因突变获得性耐药和疾病进展的晚期非小细胞肺癌的I期临床研究
对经既往EGFR-TKI治疗后由T790M基因突变获得性耐药和疾病进展的晚期非小细胞肺癌
试验目的:
主要目的是评估9291类似药YK-029A片的安全性和耐受性
试验信息
试验分类 安全性和有效性
试验分期 I期
设计类型 单臂试验
随机化 非随机化
盲法 开放
试验范围 国内试验
主要入选标准
1.18-65岁,EOCG 0-1
2.第一代或二代EGFR抑制剂(如吉非替尼、厄洛替尼等)半年以上,目前药物已经失效,T790M阳性的患者
3.有可测量病灶(病灶>1cm或淋巴结短径>1.5cm)
需提供资料:病理检查报告,基因检测,CT报告单(用药期间有缓解),出院记录,购药记录,查血单子等。
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 | 价格(每月) 报销前 |
| 克唑替尼 | 赛可瑞 | 美国2011年 中国2017年 |
辉瑞 | 是 | 15600元 |
| 色瑞替尼 | 赞可达 | 美国2014年 中国2018年 |
诺华 | 是 | 29700元 |
| 阿来替尼 | 安圣莎 | 美国2015年 中国2018年 |
罗氏 | 否 | 50000元 |
| 布加替尼 | Briganix | 美国2017年 | Ariad | 否 | |
| 劳拉替尼 | LORBRENA | 美国2018年 | 辉瑞 | 否 |
目前免的靶向药物临床研究
(可入组)
实验标题
X-396 用于克唑替尼耐药ALK阳性NSCLC患者的II期研究
适应症
ALK阳性NSCLC患者,既往接受克唑替尼持续治疗后疾病进展
实验目的
评价X-396胶囊在克唑替尼耐药的ALK阳性NSCLC患者中的有效性和安全性。
试验信息
试验分类: 安全性和有效性
试验分期: II期
设计类型: 单臂试验
随机化: 非随机化
盲法: 开放
试验范围: 国内试验
目标入组人数:国内试验144人
主要入选标准
1组织学或细胞学证实为局部晚期或转移性非小细胞肺癌患者(NSCLC)
2三级甲等医院书面报告证实为ALK阳性
3既往接受克唑替尼持续治疗后疾病进展(按照RECIST 1.1标准)
4性别:男女均可;年龄:≥18岁
5美国东部肿瘤协作组(ECOG)体力状态评分为0分-2分
6具有一定的器官系统功能(检测前14天内未进行输血或使用成分血),定义如下:中性粒细胞绝对计数≥1.5×109/L ;血小板≥100×109/L ;血红蛋白≥9 g/dL ;总胆红素≤1.5倍正常上限 ;若无肝转移,丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)≤2.5×ULN,肝转移时,二者≤5×ULN ;肌酐≤1.5×ULN。若肌酐>1.5×ULN,以Cockcroft-Gault公式法计算得肌酐清除率≥50 mL/min,或测得24小时尿肌酐清除率≥50 mL/min,则患者仍然可以入选
7不需要使用类固醇或抗惊厥药物治疗的无症状CNS转移
8患者必须有RECIST1.1标准可测量病灶
9除脱发外的药物相关毒性反应均应缓解至2级或以下
Ensartinib(X-396)
X-396是由美国Xcovery研发的第二代ALK抑制剂,浙江贝达药业获得Ensartinib项目在中国市场的所有权益。
2016年ASCO会议报道了Ensartinib II期临床部分数据,研究结果表明,未用克唑替尼的患者总有效率为88%,PFS最长已经超过32个月,进展的一名患者为Met扩增。克唑替尼耐药的患者总有效率为77%(10/13),PFS最长的为29个月。克唑替尼和色瑞替尼耐药的患者总有效率为29%。
药物服用方式:225mg,qd(II期临床剂量),空腹给药(饭前1小时或饭后2小时)。胃溶胶囊。
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 | 价格(每月) 报销前 |
| 克唑替尼 | 赛可瑞 | 美国2016年 中国2019年 |
辉瑞 | 是 | 15600元 |
| 色瑞替尼 | 赞可达 | 研究中 | 诺华 | 否 | |
| 阿来替尼 | 安圣莎 | 研究中 | 罗氏 | 否 | |
| 布加替尼 | Briganix | 研究中 | Ariad | 否 | |
| 劳拉替尼 | LORBRENA | 研究中 | 辉瑞 | 否 |
目前免费的靶向药物临床研究
(可入组)
试验标题
X-396胶囊治疗ROS1阳性非小细胞肺癌的临床研究
适应症
组织学或细胞学证实为局部晚期或转移性ROS1阳性非小细胞肺癌患者
试验目的
评价X-396胶囊在ROS1阳性NSCLC患者的有效性和安全性,主要疗效指标为客观缓解率(ORR)。
试验信息
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
目标入组人数:国内试验59人
主要入选标准
1性别:男女均可;年龄:≥18岁。
2组织学或细胞学证实为局部晚期或转移性NSCLC(依据TNM分期系统2016第八版)。
3既往经三级甲等医院或其它合法医疗机构书面报告为ROS1阳性,且在入组之前提供诊断时/后获取的肿瘤组织学标本(包括细胞蜡块)或者活检组织标本送中心实验室进行ROS1检测(Amoy RT-PCR检验),确认为ROS1阳性;以探索性研究为目的纳入的克唑替尼复治患者必须在耐药后进行活检并将组织样本送中心实验室检测,确定为ROS1阳性。
4初治或化疗复治病人,且前次化疗结束距离X-396首次用药间隔至少3周。
5除脱发外的药物相关毒性反应均应缓解至1级或以下(依据CTCAE 4.03标准)。
6患者必须至少有一个未经过放射治疗的依照RECIST v1.1标准可测量的肿瘤病灶。
7具有一定的器官系统功能。
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 | 价格(每月) 报销前 |
| 克唑替尼 | 赛可瑞 | 美国2016年 中国2019年 |
辉瑞 | 是 | 15600元 |
| 卡博替尼 | Cabometyx | 未上市 | Exelixis | 否 |
目前免费的靶向药物临床研究
(可入组)
试验标题
沃利替尼对MET 外显子14突变的局部晚期或转移性肺癌的临床研究
适应症
MET 外显子14突变的局部晚期或转移性肺癌患者
药物介绍
沃利替尼是一种小分子新型靶向治疗药物,是c-Met受体酪氨酸激酶的高选择性抑制剂,在一系列临床前疾病模型中已证明其可有效地抑制肿瘤生长,尤其是对于c-Met基因扩增或c-Met 蛋白过度表达等c-Met 信号传导异常的肿瘤具有明显的抑制作用。
试验信息
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
主要入选标准
1.18岁及以上,ECOG 0-1
2.晚期肺肉瘤样癌或其他非小细胞肺,基因检测有MET外显子14突变且没有EGFR、ALK、ROS1突变,不能耐受含铂类药物治疗或含铂类药物治疗失败的患者
3.有可测量病灶(病灶>1cm或淋巴结短径>1.5cm)
需提供资料:病理检查报告,基因检测报告,CT报告单,出院记录,查血单子等
主要排除标准
研究治疗开始前 3周内进行过抗肿瘤治疗,包括化疗,激素治疗,生物治疗或免疫治疗,或者研究治疗开始前 2周内接受过小分子酪氨酸激酶抑制剂(例如EGFR-TKI)治疗;
研究治疗开始前 4周内接受广泛放射治疗(包括放射性核素治疗如锶-89)或研究治疗开始前 1周内接受过姑息性局部放疗或上述放疗不良反应未恢复;
研究治疗开始前 4周内接受过大手术或研究治疗开始前1周内接受过小手术(静脉置管术除外);
曾经接受过或正在接受任何针对 c-Met的治疗(例如:克唑替尼,Onartuzumab等);
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 | 价格(每月) 报销前 |
| Ado-曲妥珠单抗 | T-DM1 | 美国2013年 | 基因泰克 | 否 | |
| 吡咯替尼 | 艾瑞妮 | 中国2018年 | 恒瑞 | 否 | 25000元 |
| 波奇替尼 | 研究中 |
目前免费的靶向药物临床研究
(可入组)
试验标题
TAK-788治疗EGFR 20号外显子插入突变的转移性非小细胞肺癌的研究
适应症
携带EGFR 20号外显子插入突变的转移性非小细胞肺癌
试验信息
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
主要入选标准
1、经组织学或细胞学证实为局部晚期(并且不是针对性治疗的候选人)或转移性疾病(IIIB或IV期)的NSCLC。
2、必须有足够的肿瘤组织进行分析(具体要求见《实验室手册》),首选在最近一次既往治疗期间进展后获得的肿瘤组织。
3、必须有根据RECIST v1.1确定的可测量的疾病。
4、年龄≥18岁的男性或女性患者。对于日本患者,年龄应≥20岁。
5、美国东部肿瘤协作组(ECOG)体能状态评分为0至1分。
6、预期最短寿命≥3个月
7、肾功能和肝功能良好,定义标准如下:a. 血清总胆红素≤1.5×正常值上限(ULN)(对于Gilbert综合征患者或者如果肝功能异常是基础恶性肿瘤所致,则可接受≤3.0×ULN);b. 丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)≤2.5×ULN(如果肝功能异常由基础恶性肿瘤所致,则可接受≤5×ULN);c. 肌酐清除率估计值≥30 mL/min(使用Cockcroft-Gault公式进行计算);d. 血清白蛋白≥2 g/dL;e. 血清脂肪酶/淀粉酶≤1.5×ULN。
8、骨髓功能良好,定义标准如下:a. 中性粒细胞绝对计数(ANC)≥1.5 × 109/L;b. 血小板计数≥75×109/L;c. 血红蛋白≥9.0 g/dL。
9、筛选时心电图(ECG)的QT间期正常,定义为QTcF≤450 ms(男性)或≤470 ms(女性)。
10、在TAK-788首次给药时,既往治疗导致的所有毒性均已消退至≤1级[根据美国国家癌症研究所不良事件通用术语标准(NCI CTCAE v5.0[18]),或已消退至基线水平。注:如果认为不可逆,允许存在与治疗相关的>1级脱发或与治疗相关的2级周围神经病变。
11、女性患者:在筛选访视前绝经至少1年,或手术绝育,或如果其具有生育能力,必须同意自签署知情同意书至研究药物末次给药后30天内同时使用1种高效的非激素避孕方法和另外1种有效的(屏障)避孕方法,或同意实施真正的禁欲,该方法应与受试者首选及一般生活方式一致。(周期性禁欲[例如,女性伴侣月经周期表记载法、安全期避孕法、症状体温法避孕、或排卵后方法]、体外射精、仅使用杀精剂以及哺乳期闭经避孕法是不可接受的避孕方法。女性和男性避孕套不可一起使用。)。男性患者,即使已接受过手术绝育(即,输精管切除术后状态):同意在整个研究期间至研究药物末次给药后30天内使用有效的屏障避孕法,或同意实施真正的禁欲,该方法应与受试者首选及一般生活方式一致。(周期性禁欲[例如,女性伴侣月经周期表记载法、安全期避孕法、症状体温法避孕、或排卵后方法]、体外射精、仅使用杀精剂以及哺乳期闭经避孕法是不可接受的避孕方法。女性和男性避孕套不可一起使用。)
12、已签署知情同意书并注明日期,表明受试者已知晓研究的所有相关方面。
13、愿意和能够遵守预定的访视和研究程序。
14、记录了通过本地测试证实的EGFR框内20号外显子插入(包括A763_Y764insFQEA、V769_D770insASV、D770_N771insNPG、D770_N771insSVD、H773_V774insNPH,或者任何其他框内20号外显子插入突变),并且有足够的肿瘤组织可用于中心实验室分析(参见《实验室手册》)。EGFR 20号外显子插入突变可以是单独突变或合并其他EGFR或HER2突变。注意:患者入组无需得到中心实验室确认。
15、脑转移患者符合以下标准可以纳入:接受过手术和/或放射治疗,并且在TAK-788首次给药前7天内无需皮质类固醇来控制症状即可达到稳定状态。
16、必须至少接受过局部晚期或转移性疾病的1线治疗并且不超过2种局部晚期或转移性疾病全身抗癌化疗方案的治疗。注:如果已给药至少1个周期,则将计入全身性抗癌化疗方案。用作维持治疗的新抗肿瘤化疗将被计入新的治疗方案。如果在入组前<12个月完成(新)辅助治疗,则新辅助或辅助全身性抗癌化疗将被计入既往治疗方案。允许入组接受过EGFR TKI既往治疗的患者,但在既往TKI治疗期间被研究者或治疗医师评价为客观缓解并随后进展的患者除外。
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 | 价格(每月) 报销前 |
| 曲妥珠单抗 | 赫赛汀 | 美国1998年 中国2001年 |
罗氏 | 是 | 7600元(大概) |
| 帕妥珠单抗 | Perjeta | 美国2012年 中国2018年 |
基因泰克 | 否 | 首次36000元 以后18000元 |
| 吡咯替尼 | 艾瑞妮 | 中国2018年 | 恒瑞 | 否 | 25000元 |
| 拉帕替尼 | 泰立沙 | 美国2007年 中国2013年 |
诺华 | 是 | 5000元 |
| 来那替尼 | Nerlynx | 美国2017年 | Puma | 否 | |
| Ado-曲妥 珠单抗 |
T-DM1 | 美国2013年 | 基因泰克 | 否 |
目前免费的靶向药物临床研究
(可入组)
试验标题
对比吡咯替尼或安慰剂联合曲妥珠单抗加多西他赛一线治疗HER2阳性复发/转移性乳腺癌患者的有效性和安全性
适应症
HER2阳性复发/转移性乳腺癌
试验信息
试验分类:安全性和有效性
试验分期:III期
随机化:随机化
盲法:双盲
试验范围:国内多中心试验
主要入选标准
1、年龄≥18岁,≤75岁的女性。
2、病理检测证实的HER2表达阳性浸润性乳腺癌。
3、至少有一个可测量病灶存在。
4、ECOG评分为0-1分。
5、经基线检查证实有足够的骨髓和器官功能。
6、自愿加入本研究,签署知情同意书,有良好的依从性并愿意配合随访。
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 | 价格(每月) 报销前 |
| 威罗菲尼 | ZELBORA | 美国2011年 | 罗氏 | 否 | |
| 达拉菲尼 | Tafinlar | 美国2013年 | 葛兰素 | 否 | |
| Encorafenib | BRAFTOVI | 美国2018年 | 德国Pierre Fabre Pharma GmbH公司 |
否 |
目前招募未开始,后期邱医生会在公众号公布开始时间!
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 | 价格(每月) 报销前 |
| 奥拉帕尼 | Lynparza | 美国2014年 中国2018年 |
阿斯利康 | 否 | 50000元 |
| 鲁卡帕尼 | Rubraca | 美国2016年 | 克洛维斯肿瘤 | 否 | |
| 尼拉帕尼 | Zejula | 美国2017年 | TESARO | 否 |
目前免费的靶向药物临床研究
(可入组)
试验标题
IMP4297治疗晚期卵巢癌、输卵管癌或原发性腹膜癌
适应症
携带种系和/或体系BRCA1/2突变,既往接受过至少2线标准系统治疗的由组织学或细胞学确诊的晚期非粘液性卵巢上皮癌,输卵管癌或者原发性腹膜癌
试验目的
主要目的:受试者的客观缓解率。次要目的:客观缓解率、疾病控制率、临床获益率、无进展生存期、总体生存期、缓解持续时间;探索性目的:探索性描述IMP4297的PK特征。评估药物暴露情况与疗效和AE之间的关系,评估给药后的生物标志物变化及其与药物暴露和疗效终点的相关性,探索同源重组修复缺失、杂合性丢失与疗效的关系。
试验信息
试验分类: 其他
试验分期: II期
设计类型: 单臂试验
随机化: 非随机化
盲法: 开放
试验范围: 国内试验
目标入组人数:国内试验100人
主要入选标准
1 所有受试者在开始研究相关操作前均需签署ICF;
2 ≥18岁由组织学或细胞学确诊的晚期非粘液性卵巢上皮癌,输卵管癌或者原发性腹膜癌的女性受试者;
3 由中心实验室确诊为胚系和/或体系BRCA1/2突变;
4 既往接受过不少于2线含铂化疗出现疾病复发或进展;
5 最近一次含铂方案治疗结束后≤6个自然月未出现疾病复发或进展(基于临床,CA125或者影像学判断);
6 根据RECIST v1.1标准,经独立的中心影像确认至少有一处可测量的病灶;
7 美国东部肿瘤协作组织体力状态(Eastern Cooperative Oncology Group Performance Status,ECOG PS)评分0-1分;
| 药物 | 国内售价 | 用法用量 | 赠药政策 | 赠药后的年治疗 |
| (剂量/元) | 费用(万元) | |||
| O药 | 100mg/9260 | 3mg/kg | 买3赠3 | 22.13 |
| 40mg/4591 | 1次/2周 | |||
| K药 | 100mg/17918 | 2mg/kg | 买6赠8 | 19.35 |
| 1次/3周 |
目前免费的临床研究
(可入组)
试验标题
HX008 注射剂治疗MSI-H 实体瘤的研究
适应症
MSI-H 实体瘤
试验信息
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内多中心试验
主要入选标准
1.18-70岁,EOCG 0-1
2.MSI-H 或 dMMR(微卫星不稳定)的实体瘤(如妇科肿瘤,肺癌,消化道肿瘤等)
3.含铂方案治疗失败或者不能耐受,没有用过PD-1/PD-L1药物治疗
4.有可测量病灶(病灶>1cm或淋巴结短径>1.5cm)
5.没有脑转移
需提供资料:病理检查报告,CT报告单,出院记录,基因检测报告,查血单子等
目前无药物上市。
目前免费的靶向药物临床研究
试验题目
HL-085联合多西他赛治疗KRAS突变的晚期非小细胞肺癌
适应症
KRAS突变的晚期非小细胞肺癌
试验目的
评价HL-085联合多西他赛治疗KRAS突变的晚期NSCLC的安全性和耐受性、确定最大耐受剂量(MTD)/推荐的Ⅱ期临床试验剂量(RP2D)和剂量限制性毒性(DLT)。
试验设计
试验分类: 安全性和有效性
试验分期: I期
设计类型: 单臂试验
随机化: 非随机化
盲法: 开放
试验范围: 国内试验
目标入组人数:27-39人
入组条件
1 根据 AJCC 第8版肺癌TNM分期标准,经组织学或细胞学确诊的、无法手术切除或转移性的Ⅲb-Ⅳ期非小细胞肺癌(NSCLC);
2 经标准治疗失败、不能耐受标准治疗或拒绝标准治疗的晚期NSCLC;
3 基线时能够提供足够的组织学标本进行基因突变检测并确定为KRAS突变;
4 根据实体瘤疗效评价标准(RECIST v1.1版)有可测量的病灶;
5 在研究药物给药治疗前,既往化疗、免疫疗法或放疗必须已完成至少4周,并且在研究药物给药前,所有相关毒性反应(除脱发)均已得到恢复(恢复至≤1级或基线水平);
6 用药前至少14天内未接受任何大手 研究治疗首次术(基线肿瘤活检除外)或发生严重创伤;
7 ECOG评分为0-1分;
目前无药物上市。
目前免费的靶向药物临床研究
试验题目
Ipatasertib 联合紫杉醇治疗 PIK3CA/AKT1/PTEN-基因改变的局部晚期或转移性,三阴性乳腺癌或激素受体阳性、HER2 阴性乳腺癌三期临床研究
适应症
试验目的
评价ipatasertib联合紫杉醇(ipatasertib+紫杉醇)相比安慰剂联合紫杉醇(安慰剂+紫杉醇)在PIK3CA/AKT1/PTEN-基因改变肿瘤患者中的安全性、疗效和药代动力学。
试验设计
试验分类: 安全性和有效性
试验分期: III期
设计类型: 平行分组
随机化: 随机化
盲法: 双盲
试验范围: 国际多中心试验
目标入组人数: 总体450人, 中国13人
入选标准(部分)
1 年龄≥18 岁的女性或男性
2 东部肿瘤协作组体能状态为0 或1
3 周期1 第1 天首次研究治疗前14 日内血液和器官功能充分,采用以下定义标准:中性粒细胞(ANC≥1500/μL);血红蛋白≥9 g/dL;血小板计数≥100,000/μL;血清白蛋白≥3 g/dL;总胆红素≤1.5倍正常值上限(ULN),以下情况除外:血清胆红素水平≤3 倍ULN 的已知吉尔伯特病患者可入选研究。AST 和ALT≤2.5 倍ULN,以下情况除外:记录证明肝或骨转移的患者的AST 和ALT 可≤5 倍ULN。ALP≤2 倍ULN,以下情况除外:已知累及肝脏的患者ALP≤5 倍ULN;已知累及骨骼的患者ALP≤7 倍ULN;PTT(或aPTT)和INR≤1.5 倍ULN(接受抗凝治疗的患者除外);接受肝素治疗的患者的PTT(或aPTT)应在1.5 和2.5 倍ULN(或开始肝素治疗之前的患者数值)之间。接受香豆素衍生物治疗的患者间隔1 至4 天的2 个连续测得INR应在2.0 和3.0 之间;血清肌酐<1.5 倍ULN 或肌酐清除率≥50 mL/min,基于Cockcroft-Gault 肾小球滤过率估算; 空腹总葡萄糖≤150 mg/dL 且HbA1C≤7.5%
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 | 价格(每月) 报销前 |
| 贝伐珠单抗 | 安维汀 | 美国2004年 中国2017年 |
基因泰克 | 是否纳入医保 | 10000元 |
| 雷莫芦单抗 | Cyramza | 美国2014年 | 礼来 | 否 | |
| 安罗替尼 | 福可维 | 中国2018年 | 正大天晴 | 是 | 6800元 |
| 呋喹替尼 | 爱优特 | 中国2018年 | 和记黄埔 | 否 | 210000元 |
| 阿帕替尼 | 艾坦 | 中国2014年 | 恒瑞 | 是 | 8160元 |
| 瑞戈非尼 | 拜万戈 | 美国2012年 中国2017年 |
拜耳 | 是 | 30000元 |
| 索拉菲尼 | 多吉美 | 美国2005年 中国2006年 |
拜耳 | 否 | |
| 舒尼替尼 | 索坦 | 美国2006年 中国2007年 |
辉瑞 | 是 | |
| 帕唑帕尼 | 维全特 | 美国2009年 中国2017年 |
诺华 | 否 |
目前免费的临床研究
(可入组)
试验标题
随机双盲平行比较试验药和安维汀在健康男性受试者中单次给药药代动力学、安全性及免疫原性的Ⅰ期临床研究
适应症
试验信息
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:随机化
盲法:双盲
试验范围:国内多中心试验
主要入选标准
1.年龄18~45周岁(含两端界值)
2.体重不低于50 kg,体重指数19~26kg/m2之间(含两端界值);3.健康状况良好,无中枢神经系统、心血管系统、肾脏、肝脏、消化系统、呼吸系统、代谢系统的病史或其他疾病;健康状况良好,无中枢神经系统、心血管系统、肾脏、肝脏、消化系统、呼吸系统、代谢系统的病史或其他疾病;
4.体格检查、血常规、尿常规、血生化、12导联心电图及胸片检查等正常,或检查结果异常经研究者判断无临床意义(无临床意义的检查结果异常包括但不限于:12导联心电图存在的轻度电轴左偏、电轴右偏、左束支传导阻滞、右束支传导阻滞);
5.受试者或其配偶同意在试验期间及给药后的6个月内采取有效的避孕措施,如禁欲、口服避孕药、宫内节育器和双重屏障法(例如避孕套加避孕隔膜)等。
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 |
| 西妥昔单抗 | 爱必妥 | 美国2004年 中国2013年 |
默克 | 是 |
| 耐昔妥珠单抗 | Portraza | 美国2015年 | 礼来 | 否 |
| 尼妥珠单抗 | 泰欣生 | 中国2008年 | 百泰生物 | 否 |
目前免费的临床研究
(可入组)
试验标题
适应症
与伊立替康联合用药治疗表达EGFR、KRAS野生型、经含伊立替康治疗失败的转移性结直肠癌患者
试验信息
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:随机化
盲法:双盲
试验范围:国内多中心试验
主要入选标准
1.18-75周岁男性
3.ECOG体力评分0-2分
4.预计生存时间3个月以上
5.至少有一个可评估的病灶
目前招募未开始,后期邱医生会在公众号公布开始时间!
目前无药物上市!
试验题目
晚期实体瘤或原发性中枢神经系统肿瘤儿童患者口服TRK抑制剂larotrectinib I/II期研究(研究药物在NTRK阳性儿童受试者的有效性和安全性)
适应症
NTRK融合基因阳性实体肿瘤
试验目的
本研究是验证Larotretinib在儿童肿瘤患者中的安全性。该肿瘤必须存在特定(NTRK)基因改变。研究药物限制肿瘤细胞中NTRK基因的活性而治疗肿瘤。研究的第一部分(I期)验证儿童受试者中,剂量的安全性,药物在体内的吸收和改变,对于肿瘤的作用。第二部分(II期)主要目的是药物治疗的作用及其时长。
试验设计
试验分类:安全性和有效性
试验分期:其它
设计类型:单臂试验
随机化:随机化
盲法:开放
试验范围:国际多中心试验
入选标准
1 I期:在C1D1,患者从出生至21岁间,有局部晚期或转移性实体瘤或原发性CNS肿瘤,且肿瘤复发、进展或对现有治疗无应答,没有标准的或可用的系统性治愈性疗法;或:刚出生及更大的婴儿,被诊断为恶性肿瘤且已有记录证实NTRK融合基因,肿瘤已进展或对现有疗法无应答,且无标准的或可用的治愈性疗法。或:研究者认为通过损伤外形手术或截肢才能实现完整手术切除的局部晚期IFS患者。
2 I期剂量递增队列已完成入组。
3 期剂量扩展:除上述入选标准外,有资格入组本队列的患者必须是有记录证实NTRK融合基因的恶性肿瘤患者,IFS、CMN或SBC患者除外。入组本队列的IFS、CMN或SBC患者需有通过FISH或RT-PCR检测出ETV6重排或通过NGS检测出NTRK融合的证据。
4 II期:-C1D1时刚出生及更大的患有局部晚期或转移性IFS的婴儿患者,局部晚期IFS患者需经研究者判断后认为通过损伤外形手术或截肢方可达到完整的手术切除。或:C1D1时刚出生至21岁的局部晚期或转移性实体瘤或原发性CNS肿瘤患者,肿瘤已复发、已进展或对现有疗法无应答,并且无标准的或可用的全系统性治愈性疗法,已证实NTRK融合基因(或为IFS、CMN或SBC时有通过FISH或RT-PCR证实ETV6重排或通过NGS证实NTRK融合基因)(通过CLIA或其他类似认证实验室常规进行的分子检测确定)。NTRK融合基因阳性良性肿瘤患者也有入组资格。或:(包括扩展阶段)肿瘤诊断为儿童患者的典型组织学类型和NTRK融合基因的21岁以上的潜在患者,在当地研究中心的研究者与申办者的医学监查员进行讨论后可考虑入组。
5 原发性CNS肿瘤或脑转移患者
6 Karnofsky(≥16岁)或Lansky(<16岁)体力状态评分至少为50
7 具有足够的血液学功能
8 肝肾功能正常
目前无药物上市!
试验题目
TL118胶囊治疗NTRK基因融合的晚期恶性实体瘤患者I期临床研究
适应症
NTRK基因融合的晚期恶性实体瘤
试验目的
评价TL118胶囊在NTRK基因融合的晚期恶性实体瘤患者的安全性和耐受性,探索最大耐受剂量(MTD),并确定Ⅱ期临床试验推荐剂量(RP2D)。2.次要研究目的:(1)评价TL118胶囊单药治疗的药代动力学特征。(2)初步评价TL118胶囊的抗肿瘤疗效。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
入选标准
1. 年龄≥18周岁,性别不限;
2. 经病理组织学和/或细胞学确诊的局部晚期或转移性恶性实体瘤患者,经标准治疗失败,或无标准治疗,或现阶段不适用标准治疗;
3. 既往检测存在NTRK基因融合突变;
4. 有生育能力的合格患者(男性和女性)必须同意在试验期间和末次用药后至少12周内与其伴侣一起使用可靠的避孕方法(激素或屏障法或禁欲);育龄期的女性患者在入选前7天内的血妊娠试验必须为阴性。
目前无药物上市。
目前招募未开始,后期邱医生会在公众号公布开始时间!
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 | 价格(每月) 报销前 |
| 依维莫司 | 飞尼妥 | 美国2009年 中国2013年 |
诺华 | 是 | 7500元 |
| 坦西莫司 | Torisel | 美国2007年 | PF PRISM | 否 |
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 |
| 奥拉帕利 | 利普卓 | 美国2014年 中国2018年 |
阿斯利康 | 否 |
| 他拉唑帕尼 | Talzenna | 美国2018年 | 辉瑞 | 否 |
| 卢卡帕尼 | Rubraca | 美国2016年 | Clovis | 否 |
| 尼拉帕尼 | Zejula | 美国2017年 | Tesaro | 否 |
目前免费的临床研究
(可入组)
试验标题
HWH340 片 I 期耐受性和药代动力学研究
适应症
单独或联合治疗 BRCA 突变或缺失以及 PARP 酶过度表达的恶性实体瘤
试验信息
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:双盲
试验范围:国内多中心试验
主要入选标准
1.18-70周岁患者;
2.经组织学和/或细胞学确诊的晚期的实体瘤患者
3.经常规治疗无效或缺乏有效治疗的晚期实体瘤患者
4.无严重的造血功能异常,心、肺、肝、肾等器官和骨髓功能基本正常,入选 前 14 天内,实验室数值在下列范围内(未使用生长因子或输血的状态下):血常规:中性粒细胞绝对数( ANC) ≥1.5×109/L,血小板( PLT) ≥100×109/L, 血红蛋白( Hb) ≥100 g/L;肾功能:血清肌酐( Cr) ≤1.5×ULN;肝功能:血清总胆红素≤1.5×ULN,谷丙转氨酶( AST)及谷草转氨酶( ALT) ≤2.5×ULN(如果肿瘤有肝脏转移,则≤5×ULN);电解质:检测值(钠、钾、钙)在正常值范围内;凝血功能:国际标准化比率( INR)≤1.5,活化部分凝血活酶时间( APTT)≤ 1.5×ULN
5.参加连续给药试验受试者必须至少有一个根据 RECIST V1.1 版标准定义的 可测量的病灶
6.参加连续给药试验受试者肿瘤协作组评分 ECOG 评分≤2
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 |
| 帕博西尼 | Ibrance | 美国2015年 | 辉瑞 | 否 |
| 瑞博西尼 | Kisqali | 美国2017年 | 诺华 | 否 |
| 玻玛西尼 | Verzeni | 美国2017年 | 礼来 | 否 |
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 |
| 伊马替尼 | 格列卫 | 美国2001年 中国2002年 |
诺华 | 是 |
| 达沙替尼 | 施达赛 | 美国2006年 中国2011年 |
百时美 施贵宝 |
是 |
| 尼洛替尼 | 达希纳 | 美国2007年 中国2009年 |
诺华 | 是 |
| 靶向药名称 | 商品名 | 上市时间 | 厂家 | 是否纳入医保 |
| 利妥昔单抗 | 美罗华 | 美国1997年 中国2008年 |
基因泰克 | 是 |
| 奥滨尤妥珠 单抗 |
Gazyva | 美国2014年 | 安进 | 否 |
| 奥法木单抗 | Arzerra | 美国2009年 | Glaxo | 否 |
给肿瘤患者曙光的新药
但是癌细胞很聪明,很多癌细胞表面也能表达PD-L1,试图逃过免疫细胞T细胞对其的杀伤作用。而我们用的免疫治疗正是利用这个特点,注入抗PD1/抗PD-L1抗体,结合肿瘤细胞表面的PD-L1.使其能够被人体的免疫系统T细胞识别,而达到杀伤肿瘤的作用。但是PD-1抑制剂有效率并不高,仅有约20%的患者能对PD-1抑制剂的治疗产生应答,实现长久控制。科学家们又发现了新的治疗肿瘤的办法,就是M7824,它是PD-1的升级版。M7824同时阻断免疫逃逸的PDL1和TGF-β途径,这些途径是独立但互补的,对自适应和先天免疫系统均有影响,多通路抑制免疫逃逸,联合抗肿瘤。
目前免费的药物临床研究
(可入组)
实验标题
在一线化疗治疗失败或无法耐受的胆管癌中考察M7824单药治疗有效性的II期研究
适应症
一线化疗治疗失败或无法耐受的胆管癌
实验目的
基于客观缓解率评价M7824的临床有效性。
试验信息
试验分类: 安全性和有效性
试验分期: II期
设计类型: 单臂试验
随机化: 非随机化
盲法: 开放
试验范围: 国际多试验
目标入组人数:总体141人,中国50人
主要入选标准
1 在签署知情同意书时≥18岁。在日本,如果受试者≥18岁但<20岁,则除了受试者书面知情同意书外,还应提供其父母或监护人的书面知情同意书。
2 受试者具有组织学或细胞学证实的局部晚期或转移性BTC。
3 强制要求在首次研究干预前28天内采集肿瘤(原发性或转移性)存档样本或新鲜活检组织。细针抽吸活检、经导管抽吸或细胞块不可接受。可接受内镜逆行胆管造影或导管内超声辅助活检,首选细针或切除活检,或切除组织。根据实验室手册,肿瘤活检和肿瘤存档样本必须适用于生物标志物评估。
4 患有BTC的受试者必须对于铂类药物为基础的1L全身化疗不能耐受或者治疗失败。接受铂类药物为基础的辅助化疗并在辅助治疗结束后6个月内有疾病复发证据的受试者也具有研究资格。如果辅助化疗期间或其后6个月内复发,则将铂类药物为基础的辅助化疗计为1L化疗。
5 疾病必须可测量,且至少存在一个单维可测量病灶(根据RECIST 1.1),并由独立审查委员会(IRC)独立进行确认。
6 入组研究和M7824治疗第1天时,美国东部肿瘤协作组(ECOG PS)为0至1。
7 根据研究者判断预期寿命≥ 12周。
8 接受根治性治疗且>3年无复发的癌症,或者接受根治性治疗的早期癌症,包括宫颈原位癌,浅表性、非侵入性膀胱癌,基底细胞或鳞状细胞原位癌。内窥镜下切除局限在粘膜层(食道、胃部和结肠直肠)的早期胃肠道(GI)癌症,且>1年内未复发的受试者允许参加研究。排除其他既往和/或并发癌症。
9 具有充分的造血功能,定义为白细胞(WBC)计数≥计3 × 109/L,中性粒细胞绝对计数(ANC)≥1.5 × 109/L,淋巴细胞计数≥ 0.5 × 109/L,血小板计数≥75 × 109/L和血红蛋白(Hgb)≥9 g/dL(在没有输血的情况下)。
10 具有充分的肝脏功能,定义为总胆红素水平≤ 1.5 ×正常值范围上限(ULN)、天冬氨酸氨基转移酶(AST)水平≤2.5 × ULN和丙氨酸氨基转移酶(ALT)水平≤ 2.5 × ULN。对于肿瘤累及肝脏的受试者,可接受AST ≤ 5.0 ×ULN,ALT ≤ 5.0 × ULN。
11 具有充分的凝血功能,定义为凝血酶原时间(PT)或国际标准化比值(INR)≤ 1.5 x ULN,除非受试者接受抗凝药治疗。
12 白蛋白≥ 3.0 g/dL。
13 乙型肝炎病毒(HBV)脱氧核糖核酸(DNA)阳性受试者必须接受治疗且在入选研究时抗病毒药物剂量稳定(例如,恩替卡韦、替诺福韦或拉米夫定;不允许接受阿德福韦或干扰素治疗),并根据适当的说明书指南执行拟定监测和管理(包括基线HBV DNA含量)。接受活动性病毒性丙型肝炎(HCV)治疗的受试者必须在入组研究时接受稳定剂量的药物治疗,并根据适当的获批抗病毒药物说明书指南执行计划的监测和管理。
14 具有充分的肾脏功能,定义为按照Cockcroft-Gault公式,或者采用采集的24小时尿液测定的肌酐清除率(CCr),肌酐≤ 1.5 x ULN或估算的CCr> 40 mL/min。a. CCrl(mL/min) = (140-年龄) x 体重(kg)/(72 x 血清Cr jaffe)b. 如果是女性,×0.85 c.如果采用酶法测量Cr,则增加0.2,并用作Crjaffe = 0.2 +Crenzume。
15 若男性受试者同意在干预期间以及研究干预末次给药后至少4个月内遵守以下要求,则有资格参与研究:a. 不得捐献精子并且:b. 不得与女性发生性交或 c. 使用男用避孕套:d.与当前未怀孕的WOCBP女性发生性交时使用男用避孕套,并建议女性伴侣使用高效避孕方法(附录3中详述的年失败率<1%的方法),因为避孕套可能会破损或渗漏 e.参加任何导致精液暴露的活动。
16 对于非妊娠或哺乳期的女性受试者,如果符合以下至少一种条件,即有资格参加本研究:a.非WOCBP 或 b. 如果为WOCBP,应在以下期间使用高效避孕方法(即附录3中描述的年失败率<1%的方法,首选使用者依赖性较低的方法):c. 首次研究干预给药前,如果使用激素避孕法:d. 需完成至少一个4周口服避孕药丸给药周期,并且已开始月经周期或 e.使用长效避孕药或延长周期口服避孕药达至少28天,并且高灵敏度测定结果记录为妊娠阴性。f. 处于干预期间g .研究干预期后(即末次研究干预给药后),距离末次研究干预给药至少2个月。对于致畸药物,如果会与激素类避孕药产生DDI,从而导致避孕效果不可靠,则必须使用年失败率< 1%的替代方法。研究者应在首次研究干预给药前评价避孕方法的效果。首次研究干预给药前24小时内,血清或高灵敏度尿妊娠试验(按当地法规要求)结果为阴性。如果尿妊娠试验不能确认为阴性(例如结果不确定),则需进行血清妊娠试验。
DS8201
DS8201是一个新型抗肿瘤药物——抗体偶联药物,简称ADC。它有两部分组成:将人源化HER2抗体与一种新型拓扑异构酶I抑制剂有效载荷连接。Ⅰ期研究(NCT02564900)纳入T-DM1治疗后的HER2+乳腺癌,曲妥珠单抗治疗后的HER2+胃癌,HER2低表达(IHC 1+或2+,ISH-)的乳腺癌和其他HER2(IHC≥1+)的实体瘤。结果 总体缓解率(ORR)为49.3%,86.3%的受试者在≥1次基线扫描出现肿瘤缩小。
目前招募未开始,后期邱医生会在公众号公布开始时间!
AMG510
安进公司小分子KRAS 不可逆抑制剂AMG510的I期
临床结果,29例KRAS G12C突变实体瘤可供评估,
其中10例NSCLC,19例肠癌等实体瘤。10例
NSCLC中有5例部分缓解,4例稳定,仅1例进展,
总有效率50%,疾病控制率90%。
目前招募未开始,后期邱医生会在公众号公布开始时间!
entrectinib(恩曲替尼)
美国FDA批准”广谱”抗癌药恩曲替尼上市,用于NTRK和ROS1阳性患者,有效率为57%和77%,脑转移患者疗效特别好。任何癌症患者,只要有NTRK基因融合,不管是肺癌、乳腺癌还是肠癌,都可以考虑使用,不限癌症类型,只看“基因特征”。
以上,是关于靶向治疗的小小总结,篇幅有限,所以很多东西都省略了,部分药物的靶点以及适应症等信息并不全面,在前面的表格中我只罗列了较为有代表性的一些。
因为,目前很多的靶向药覆盖的靶点不止一个,获批适应症也不止一个,国内外的获批也不一样。总的来说,很多国外原研的药物适应症获批这一块,还是走在中国前面的。不过,我们也正在逐步追赶国外的步伐,国内有很多临床试验正在做,包括外企原研的、国内原研的和国内仿制的都有。
大部分药物疗效都是确认的,这就是免费用药的好机会呢,对于国内的患者而言简直是打着灯笼都难找的好事。一旦等到药物在国内上市了,就错失了这样大好的机会,到时都是明码标价,只能花大价钱去买。
另外,不用我说,大家都知道,一般的靶向治疗药品才上市的时候,价格都比较贵,并且很多时候都是供不应求的,可能有钱也不一定能买到。
最后,邱医生还是要说,对于临床试验,大家不要有太大的心理负担,参加临床试验并不是小白鼠。有很多很多的患者是抢着想入组临床试验的。
早些时候免疫治疗比如“O药”纳武利尤单抗刚开始入组中国患者,想做上市前临床研究的时候,有很多患者听到消息都是主动来找我咨询,因为此前“O药”在国外的临床试验取得了非常好的疗效,但是去国外治疗花费太大,所以大家在听到这一消息的时候都很想在第一时间去尝试。最后患者由于自身一些原因没能成功入组,患者本人感觉到非常非常遗憾,认为错失了一个很好的治疗机会。后来,“O药”上市,患者家属第一时间要求使用,最后用下来发现疗效很不错。所以说,不要害怕尝试新事物,勇敢地迈出第一步,想必后面的每一步都会更顺利的。
| 药物 | 国内获批适应症 | 国内可以参加的临床试验 |
| O药 | 非小细胞肺癌 | 膀胱癌、晚期实体瘤、肝细胞癌、尿路上皮癌、食管癌或食管连接部癌、肾细胞癌、胸膜间皮瘤 |
| K药 | 黑色素瘤 | 非小细胞肺癌、食管癌 |
| 特瑞普利单抗 | 黑色素瘤 | 转移性尿路上皮癌、非小细胞肺癌、复发转移淋巴瘤、晚期或顽固性软组织肉瘤、晚期食管鳞状细胞癌、晚期胃腺癌、晚期鼻咽癌 |
| 信迪利单抗 | 霍奇金淋巴瘤 | 非鳞状非小细胞肺癌、实体瘤、晚期肝癌、胃及胃食管交界处腺癌、食管癌 |
| 卡瑞利珠单抗 | 霍奇金淋巴瘤 | 非小细胞肺癌、三阴性乳腺癌、胃癌或胃食管交界处癌、复发或转移性鼻咽癌、晚期实体瘤 |
-
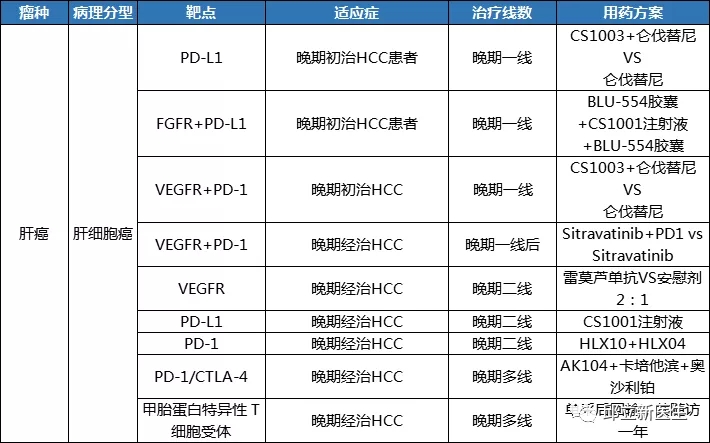
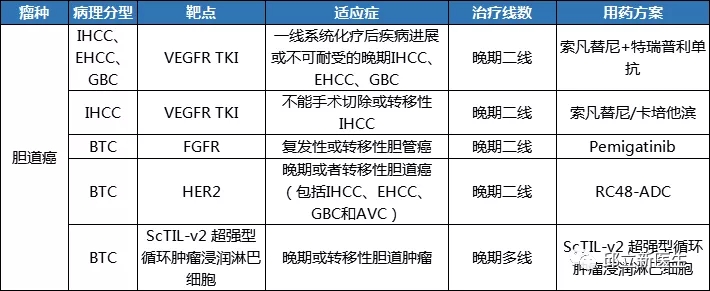
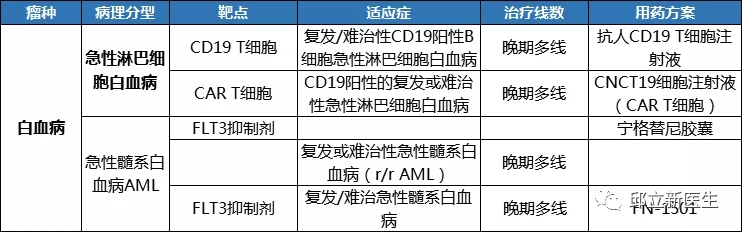
胆道癌
-
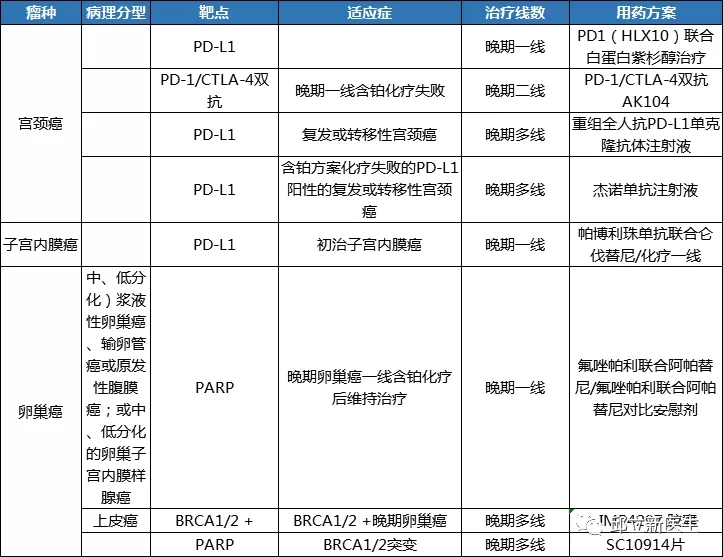
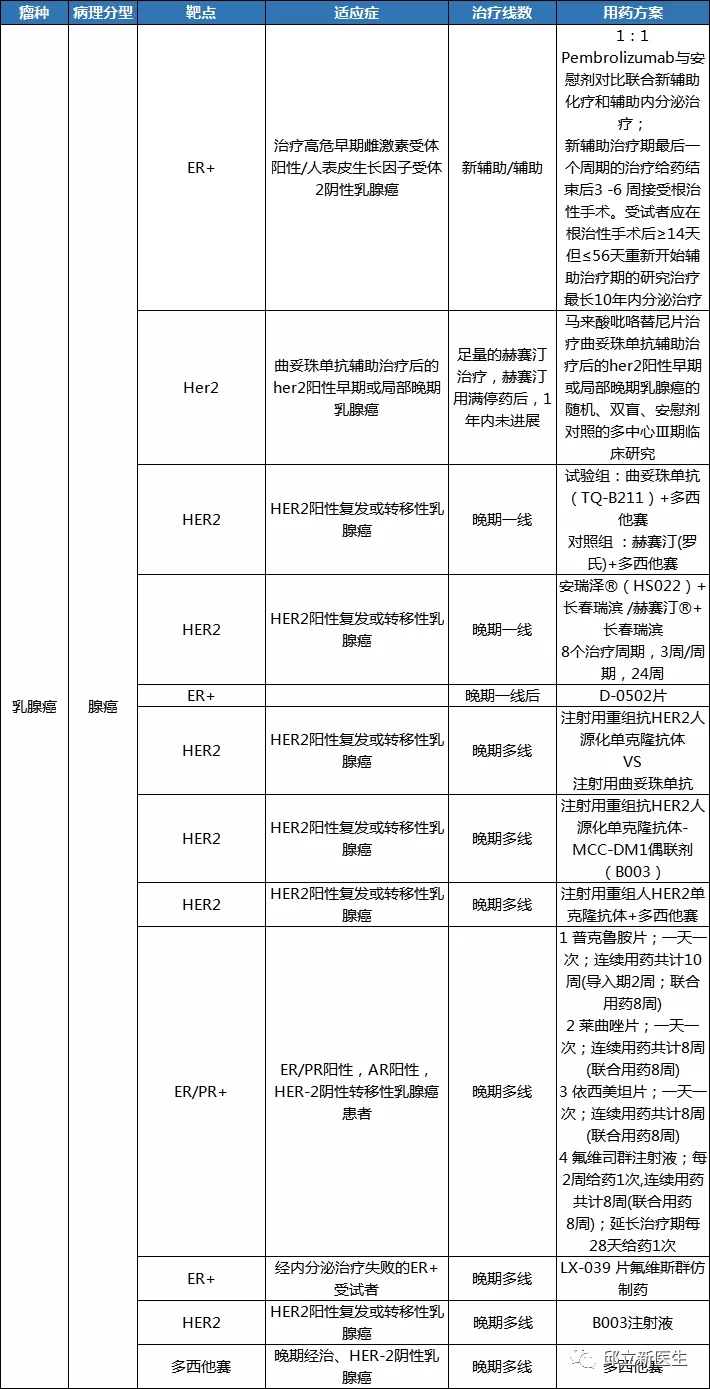
妇科肿瘤
-
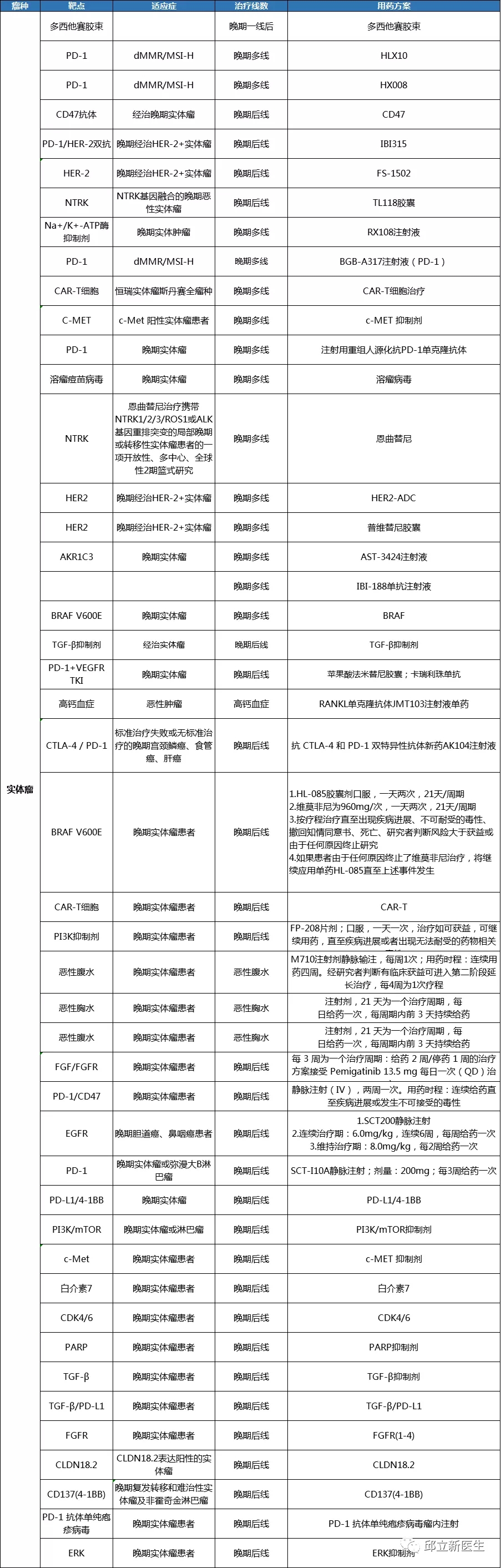
尿路上皮癌
-
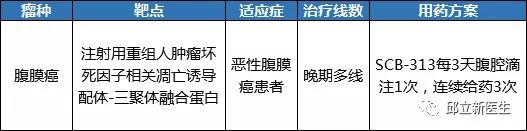
腹膜癌
-
实体瘤
扫描上面二维码在移动端打开阅读