目前抗肿瘤药物联合开发十分活跃。合理的联合治疗可以为肿瘤患者带来更好的治疗选择,但是不恰当的联合开发将增加受试者的风险、降低临床研发效率,浪费时间、财力和医疗资源,反而阻碍了真正有效的联合治疗药物开发。为此,建立科学合理的联合开发路径至关重要。
为切实鼓励创新,引导开展科学有序的抗肿瘤药联合治疗临床试验,药品审评中心组织撰写了《抗肿瘤药联合治疗临床试验技术指导原则(征求意见稿)》。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。
您的反馈意见请发到以下联系人的邮箱:
联系人:周明,唐凌
联系方式:zhoum@cde.org.cn,tangl@cde.org.cn
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2020年7月17日

附件1
抗肿瘤药联合治疗临床试验技术指导原则(征求意见稿)
抗肿瘤药是当前全球新药研发的热点之一,随着新药研发的进展,肿瘤治疗手段不断增多、总体疗效逐渐提高。由于肿瘤的复杂性,不同机制、不同靶点的药物联合治疗仍然是提高疗效和克服耐药的重要手段。目前抗肿瘤联合治疗的药物开发十分活跃,甚至有从早期临床试验阶段即进入了两个或多个创新药的联合开发。合理的联合治疗可以为肿瘤患者带来更好的治疗选择,但是不恰当的联合开发将增加受试者的风险、降低临床研发效率,浪费时间、财力和医疗资源,反而阻碍了真正有效的联合治疗药物开发。为此,建立科学合理的联合治疗开发路径至关重要。
美国食品药品监督管理局(Food and Durg Administration, FDA)于2013年发布了两种或两种以上新药联合应用的共同开发行业指南[1],对抗肿瘤药联合开发的临床试验设计提供了一般性的指导性意见。随着近年来我国在研抗肿瘤新药种类不断增多,研发环境日趋复杂,急需制定适合我国当前研发水平和监管环境的相关技术指导原则,明确抗肿瘤药联合开发的临床试验设计和获益考虑。
联合治疗的目的通常为提高疗效、降低不良反应,或提高治疗便利性。对于肿瘤治疗领域,联合治疗的核心目的主要是提高疗效。因此,本指导原则讨论的是以提高疗效为主要目标的抗肿瘤药联合治疗的临床试验设计。在开展抗肿瘤药的联合开发前,应首先具备充分的联合治疗合理性依据作为联合开发的理论基础,再根据各自单药的临床试验数据特征综合研判,基于科学证据开展联合治疗临床试验。
本指导原则将依据不同的联合治疗临床试验阶段,阐述抗肿瘤药联合开发的试验设计原则和获益评价,以期为抗肿瘤药联合开发提供参考,科学有序研发。
本指导原则仅代表药品监管部门当前的观点和认知。随着科学试验的进展,本指导原则中的相关内容将不断完善与更新。应用本指导原则设计和实施研究时,请同时参考药物临床试验质量管理规范(good clinical practice, GCP)、国际人用药品注册技术协调会(international conference on harmonizagtion, ICH)和其他国内已发布的相关指导原则。
在开展联合给药的探索性临床试验前,应具备联合开发的合理性依据,通常包括:(1)联合开发机制的合理性依据[2];(2)拟联合方案的单药临床数据[2]。
机制基础是抗肿瘤药联合开发的立题合理性依据。在联合开发前,申请人应在深入探索和研究单药作用机制的基础上,开展联合开发的机制研究,同时,鼓励积极探索预测联合治疗有效患者人群的生物标志物。
原则上,新药联合开发的合理性依据应来自于产品自身的非临床试验结果,如已有同靶点产品的临床试验结果支持其联合作用机制,也可作为参考依据。非临床研究数据的常规要求遵循ICH S9[3]及其Q&A。
获得相对充分的各自单药的临床数据,将为科学合理的联合用药剂量选择、给药时序拟定、安全性风险控制等设计提供依据。
在进入首次联合治疗前,应获得拟联合新药相对充分的单药临床药理学和安全有效性数据,包括人体药代动力学(pharmacokinetics, PK)参数、安全剂量范围、剂量-暴露量-效应关系,拟定的二期推荐剂量(recommended phase II dose,RP2D),以评估拟联合药物之间可能存在的药物相互作用(drug-drug interaction, DDI)、重要器官毒性叠加等风险。依据单药临床试验数据,考虑联合治疗的剂量递增设计和风险控制。
对于各单药均具有抗肿瘤活性的新药,在联合开发前,推荐在目标适应症获得初步的单药有效性数据,作为后续析因设计参考。
对于非临床研究结果表明不具备显著抗肿瘤活性,但与其他抗肿瘤药联合使用可能提高疗效的药物,在符合伦理和相关技术要求的情况下,可在健康受试者中开展单药的临床药理学研究,进一步支持在肿瘤受试者中开展联合治疗试验。
基于深入的机制研究数据、探索联合开发的临床优势,并最终确证临床价值是抗肿瘤药联合开发临床试验设计的总体原则。联合用药的探索性试验和确证性试验在研究目标和设计等方面存在不同关注。
抗肿瘤药联合开发的探索性试验阶段,目标是探索联合治疗剂量(包括用药时序)、潜在获益人群并探索联合治疗是否有效、是否增效,为确定进入确证性试验的联合治疗方案提供合理性依据。探索性研究中重点需关注联合爬坡设计、疗效析因和受试者的风险控制。
应依据已获得的单药临床药理学评估DDI风险,结合单药的安全性特征,设定联合治疗的起始剂量和剂量递增设计。对于新药A联合标准治疗(standard of care, SOC)的情形,通常可选择A药物单药RP2D以下剂量(如1/2 RP2D)作为起始剂量与SOC联合;对于两种新药A和B联合的模式,通常在两药各自的RP2D剂量下选择合适的起始剂量开展联合探索,根据两药不同的安全性特征和安全窗范围选择剂量递增策略,探索联合给药的合理剂量。
除联合剂量外,建议关注拟联合药物的作用机制、PK/PD及安全性特征,综合考虑给药时序的合理性。
联合治疗的核心评价点为联合用药的合理性,因此,疗效析因是联合开发评价的核心要素,析因设计的思路应贯穿抗肿瘤联合开发的始终。在早期探索性试验中就应特别关注联合治疗是否增效——可采用前瞻性小样本随机对照、历史数据对照或真实世界数据等多种方式比对析因,提供联合治疗增效的证据。
在探索性研究阶段进行充分的疗效析因研究将有助于简化确证性试验的方案设计。例如,目标适应症中A和B均为未上市新药,前期已有充分数据显示A和B的单药疗效均显著低于SOC,但联合治疗疗效可能优于SOC,可依据前期充分的疗效析因试验结果,在确证性试验中采用A+B vs SOC的设计,不设置A和/或B的单药治疗组。
早期研发中还应关注另一种情形:如计划开发A+B联合治疗模式,而A的同靶点产品单药在目标适应症已获批,则单药A应具备独立成药的能力,应当在探索性试验重点关注A的成药性以及联合B的临床价值,避免A因疗效原因无法单药成药(目标适应症的有效性劣于已上市的同靶点或同类多靶点品种)、需联合B才能优于SOC的情况。
任何可能情况下,均应关注联合治疗是否增效,高效率确定进入确证性试验的联合模式。
联合治疗会增加受试者的风险,需特别关注受试者的风险控制,建议针对联合治疗制定临床试验期间的风险控制计划。
依据拟联合药物的药效学机制、靶点毒性/不良反应机制、药物相互作用风险等背景,综合评估联合治疗的可能安全性风险。在方案设计的入排标准、重要的联合用药风险的预防、识别、监测和干预等细节予以考虑,明确风险管理措施,并根据前期获得的临床试验安全性数据不断完善风险控制计划。
抗肿瘤药联合开发的确证性试验阶段,目标是确证联合治疗对于目标患者人群的获益风险比显著大于单药治疗或者标准治疗。因此,应通过合理的研究设计确证联合治疗的合理性。在开展拟支持注册的联合用药关键研究前,申请人应首先评估前期临床试验数据是否充分。
在开展确证性试验前,应具有相对充分的探索性临床试验数据支持联合治疗的剂量选择、给药时序和安全性。任何可能情况下,应在目标适应症获得联合增效的临床试验数据,如A+SOC优于SOC,或A+B优于A同时优于B的证据。
对于不太可能在早期小样本探索性试验中获得联合用药增效依据时,可借鉴同一个瘤种晚期患者人群的获益证据,设计并开展相对早期患者人群的联合用药试验。例如,采用晚期非小细胞肺癌患者中获得的联合增效证据支持在可手术切除的非小细胞肺癌的辅助/新辅助治疗中进行联合研发。
经过评估,前期探索性临床试验数据支持进入确证性试验的联合治疗,将依据前期疗效析因试验结果、目标适应症的临床实践和同靶点药的研发注册进展,综合考虑确证性试验的方案设计,当前有A+SOC、A+B和A+B+SOC三种常规模式:
A+SOC是最常见的联合开发模式。此情况下,应在目标适应症普遍接受的临床终点(如OS)或广泛采用的替代研究终点(如PFS)对比SOC±安慰剂取得优效以证实临床获益。
采用A+B模式(A、B均非SOC时),根据目标适应症的前期疗效析因试验结果、单药疗效及同靶点产品的临床试验数据,综合考虑试验设计。通常有三种临床研发模式:
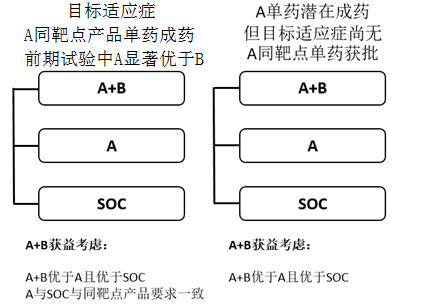
如果A在前期试验显示疗效显着优于B,且A药的同靶点产品在目标适应症已获批时,须考虑三臂设计:A+B vs A vs SOC。通常须证实A+B优于A,且A优效、等效或非劣于SOC以确证A+B的临床价值及处方合理性。A与SOC采用优效、等效或非劣设计取决于A的同靶点药品的注册试验结果(图1)。
如果A在前期试验显示具备单药成药潜力,但目标适应症尚无A的同靶点产品获批时,同样须考虑三臂设计:A+B vs A vs SOC。此时证实A+B优于A和SOC通常即可支持A+B的联合治疗合理性,此时可进行A和SOC的描述性统计比较,不进行严谨的统计学设计(图1)。
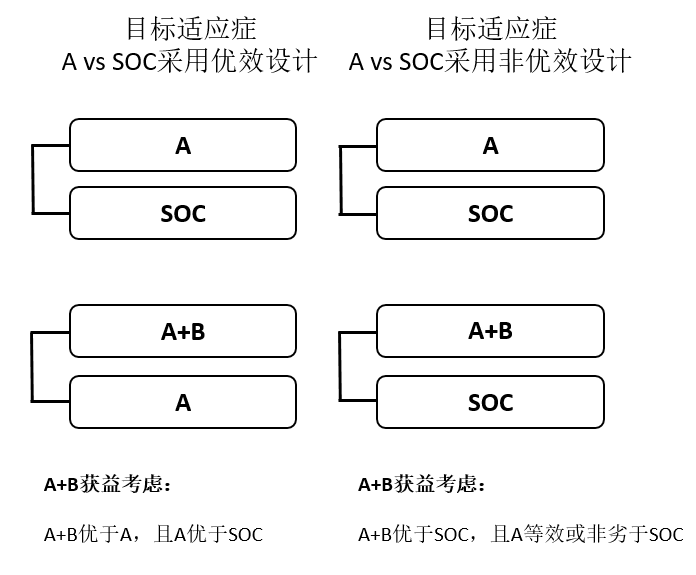
如果A在前期试验显示具备单药成药潜力,无论是否已有A的同靶点产品获批,均可考虑同期RCT设计。如开展A vs SOC和A+B vs A(当A可能优效于SOC时),或开展A vs SOC和A+B vs SOC(当A可能等效或非劣于SOC时)。此情况下,通常须证实A+B优于A或SOC,A优效、等效或非劣效于SOC以确证A+B的临床价值及处方合理性(图2)。
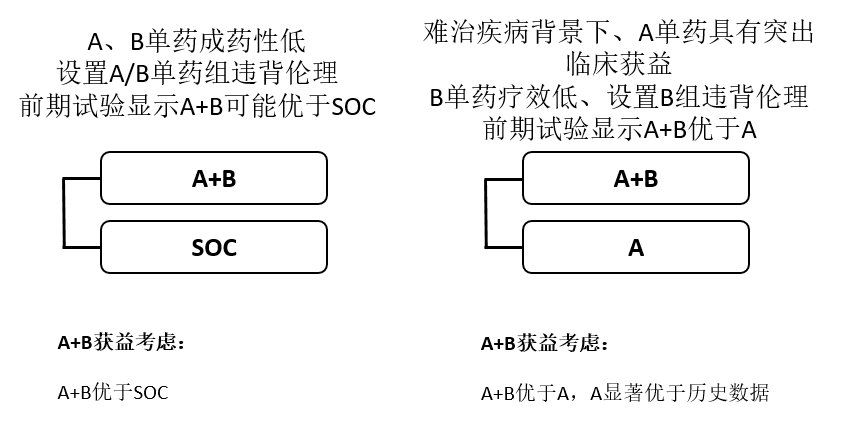
情形1、在前期析因证据显示A和B单药成药可能性均较低,即A单药和B单药均显着弱于SOC、且A+B优于SOC时,在目标适应症的确证性试验中设置A或B单药治疗组都将有损患者获益。因此,在前期析因充分的情况下,可考虑采用A+B对比SOC的对照设计进入确证性试验,须A+B优于SOC以支持联合治疗合理性(图3)。
情形2、在难治疾病背景下,前期析因证据显示A具有明确的单药成药性,而B单药成药可能性很低,且A单药有效性显着优于SOC、且A+B优于A单药时,在目标适应症的确证性试验中设置B将有损患者获益。因此,在前期析因充分的情况下,可考虑采用A+B对比A的优效性对照设计进入确证性试验(图3)。
通常情况下,三药联合的安全性风险大于两药联合,因此,对于多药联合的设计,通常建议在早期研究中探索针对疾病不同预后特征的患者人群选择不同的联合设计,选择确实能从更多药物联合治疗中获益的适合的患者人群开展更强方案组合的确证性研究。
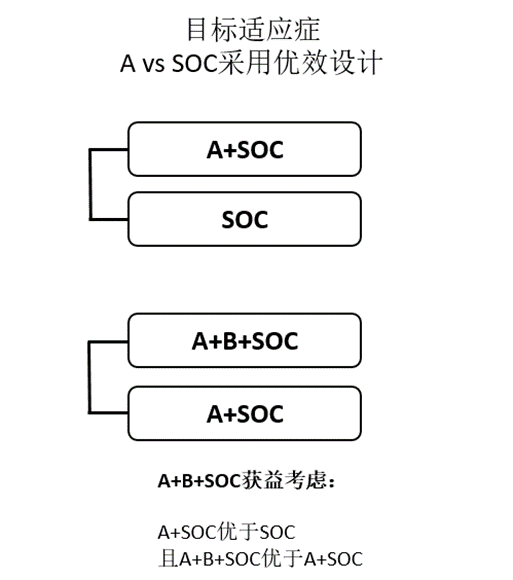
采用此种联合模式,应在探索性研究中首先确定A+B+SOC vs A+ SOC vs B+SOC vs SOC 之间的关系。通常有如下两种临床研发模式确证A+B+SOC的临床获益:
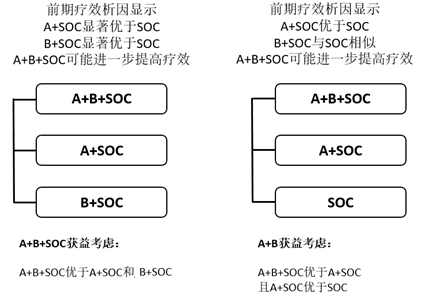
情形1、前期研究结果表明,A+SOC显着优于SOC;B+ SOC显着优于SOC,且A+B+SOC 可能更优于A+SOC和B+ SOC,表明A和B对SOC的疗效提升均有贡献,且联合治疗为强强联合模式。此时的确证性临床试验可考虑A+B+SOC vs A+ SOC vs B+SOC的模式,确定哪种组合最适合目标患者人群,通常A+B+SOC优于A+SOC和B+SOC可以支持联合治疗合理性(图4)。
情形2、前期研究结果表明,A+ SOC优于SOC;B+ SOC与SOC相似,而A+B+SOC 可能更优于A+ SOC时。即A为提高SOC疗效的主要贡献者,B的优势在于协同A。此时的确证性临床试验可考虑A+B+SOC vs A+ SOC vs SOC的三臂模式,通常A+B+SOC优于A+SOC,且A+SOC优于SOC可以支持联合治疗合理性(图4)。
图4、A+B+SOC模式确证性试验三臂设计及获益考虑
还可以考虑开展同期随机对照试验的方式,证实联合治疗的合理性,即同期或序贯开展A+SOC vs SOC(A为前期析因试验中主要的疗效贡献者),以及A+B+SOC vs A+SOC。此情况下,通常须证实A+SOC优于A,且A+B+SOC优于A+SOC以确证A+B+SOC的临床价值及处方合理性(图5)。
图5、A+B+SOC同期/序贯对照试验设计及获益考虑
设盲考虑:在联合治疗确证性试验的方案设计中,应参考试验药物的给药方式和目标适应症的临床试验,考虑在对照组是否设置安慰剂对照,提高试验设计的严谨性。
序贯检验考虑:涉及序贯检验时,申请人应合理设置检验顺序并控制试验的总体一类错误。
研究终点考虑:针对联合给药的探索性试验,可通过ORR等替代终点指标获得联合增效的证据。针对确证性试验,不论是多臂对照设计或是同期RCT等试验设计,原则上均应在目标肿瘤适应症普遍接受的临床终点(如OS)或广泛采用的替代研究终点(如PFS)证实优效。
SOC调整考虑:当A+SOC或A+B+SOC,对SOC进行调整时,包括删除SOC的某个化疗药物组方、减弱SOC治疗剂量或减少SOC的治疗周期等措施,通常将试验组减弱的SOC也视作标准SOC。
特殊情况考虑:当目标适应症为罕见恶性肿瘤或恶性肿瘤的罕见亚型,且现有治疗疗效有限时,可综合前期析因结果和实际临床需求,考虑确证性试验的析因设计和终点考虑。通常情况下,联合治疗关键研究不接受单臂试验设计。
联合治疗是提高抗肿瘤疗效和克服耐药的重要手段。当前我国抗肿瘤新药研发密集、同靶点产品临床研发竞争集中,需要有临床试验设计相关技术指导原则以规范和促进研发。注重析因是本技术指导原则的核心之一,也是切实鼓励强强联合、为患者提供具有临床价值的联合治疗的重要措施。对发生率低且现有治疗获益有限的恶性肿瘤,将基于联合治疗的临床获益,综合临床需求考虑析因设计要求。对于本指导原则尚未涵盖的抗肿瘤药物联合开发的复杂情形,鼓励申请人与药品审评中心沟通交流,共同促进抗肿瘤药物开展科学有序的联合开发。
[1] CDER,FOOD AND DRUG ADMINISTRATION. Guidance for Industry Codevelopment of Two or More Unmarketed Investigational Drugs for Use in Combination (DRAFT GUIDANCE), 2013 June.
[2] 邹丽敏,唐凌,杨志敏等. 抗肿瘤药物申报联合用药早期临床试验的考虑. 中国新药杂志2020,29(6):625-628.
[3] ICH指导原则S9:抗肿瘤药物非临床评价(第四阶段版本,2009年10月29日).
附件2
抗肿瘤药联合治疗临床试验技术指导原则(征求意见稿)起草说明
为鼓励创新,引导抗肿瘤药联合治疗临床试验科学有序地开展,药品审评中心组织撰写了《抗肿瘤药联合治疗临床试验技术指导原则(征求意见稿)》。现将有关情况说明如下:
一、背景和目的
抗肿瘤药是当前全球新药研发的热点之一。不同机制、不同靶点的药物联合治疗仍然是提高疗效和克服耐药的重要手段。目前抗肿瘤联合治疗的药物开发十分活跃,甚至有从早期临床试验阶段即进入了两个或多个创新药的联合开发。合理的联合治疗可以为肿瘤患者带来更好的治疗选择,但是不恰当的联合开发将增加受试者的风险、降低临床研发效率,浪费时间、财力和医疗资源,反而阻碍了真正有效的联合治疗药物开发。为此,建立科学合理的联合开发路径至关重要。
为切实鼓励创新,引导开展科学有序的抗肿瘤药联合治疗临床试验,药品审评中心组织撰写了《抗肿瘤药联合治疗临床试验技术指导原则(征求意见稿)》。
二、起草过程
本指导原则由化药临床一部牵头,自2020年4月启动,2020年6月形成初稿,经药审中心内部讨论,技术委员会审核,形成征求意见稿。
三、主要内容与说明
本指导原则的前言和背景,介绍了撰写背景和目的。联合开发依据部分,介绍了在开展联合给药的探索性临床试验前,应具备的合理性依据。在临床试验设计部分,阐述了不同阶段抗肿瘤药联合开发的试验设计原则和对获益评价的考虑,以及对试验设计中其它问题,包括设盲、序贯检验、研究终点、标准治疗调整和其他特殊情况的考虑。
本指导原则仅代表药品监管部门当前的观点和认知。未来,我们也会根据审评实际和研发的发展,不断丰富和完善本指导原则。


扫描上面二维码在移动端打开阅读