抑制由致癌突变激活的信号通路可引发治疗反应,然而,在晚期癌症中,由于继发性突变可恢复通过药物抑制的信号转导,因此耐药性实际上是不可避免的。人们认为,针对靶向癌症药物的耐药性是由于高剂量药物产生的选择性压力所致。
之前的研究表明,在 BRAF 突变型黑色素瘤和非小细胞肺癌(NSCLC)中,抑制同一致癌通路的两个组分(BRAF+MEK),比只抑制BRAF展现出更持续的临床益处。最近的一些临床试验何临床前研究发现,抑制同一致癌通路的三种组分可进一步提高治疗效果。
在这些情况下,通常以最大耐受剂量(MTD)给药。然而,组合使用药物数量的增加通常伴随毒性的增加,但迄今为止,几乎没有任何研究评估使用低于最大耐受剂量(MTD)的药物组合的疗效。
使用多重低剂量(MLD)药物组合的策略,能否在有效治疗的基础上,减少因高剂量用药导致的耐药性产生呢?
近日,荷兰癌症研究所 René Bernards 等人在 Nature 子刊 Nature Communications 杂志发表了题为:Multiple low dose therapy as an effective strategy to treat EGFR inhibitor-resistant NSCLC tumours 的研究论文。
该研究使用了EGFR突变型非小细胞肺癌模型对多重低剂量(MLD)治疗进行测试,实验结果表明,使用三重低剂量(RAF+MEK+ERK)和或四重低剂量
(EGFR+RAF+MEK+ERK)时,低至20%的单独有效药物剂量足以完全阻断MAPK信号转导和癌细胞增殖。
更重要的是,用多重低剂量(MLD)治疗EGFR突变非小细胞肺癌细胞没有产生耐药性,使用几种动物模型发现多重低剂量(MLD)治疗具有持久性,且无相关毒性。
人们认为,针对靶向癌症药物的耐药性是由于高剂量药物产生的选择性压力所致。同一致癌信号通路中多个组分的部分抑制,叠加在一起足以完全抑制整个通路,同时还会降低每个组分上的选择性压力,以减少获得性抗性突变。
为了验证上述猜想,研究团队在EGFR突变型非小细胞肺癌(NSCLC)中对多重低剂量(MLD)治疗模型进行测试。
试验结果表明,使用三重低剂量(RAF+MEK+ERK)和或四重低剂量(EGFR+RAF+MEK+ERK)时,低至20%的单独有效药物剂量足以完全阻断MAPK信号转导和癌细胞增殖。
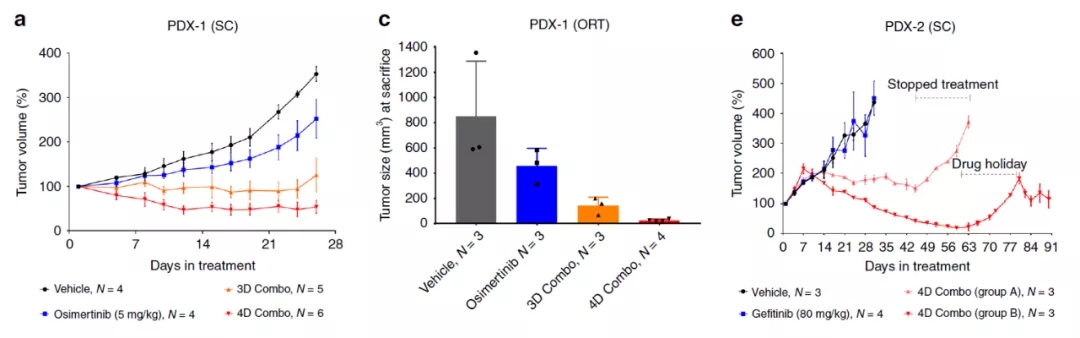
更重要的是,用多重低剂量(MLD)治疗EGFR突变非小细胞肺癌细胞没有产生耐药性,使用几种动物模型发现多重低剂量(MLD)治疗具有持久性,且无相关毒性。
实验数据表明,即使那些对第三代EGFR抑制剂治疗产生耐药性的患者,多重低剂量(MLD)治疗也可以带来临床益处。
在这项研究中,在多个节点上对致癌通路的抑制,降低了每个节点上发生突变的选择性压力,从而增加了癌症治疗的有效响应时间。
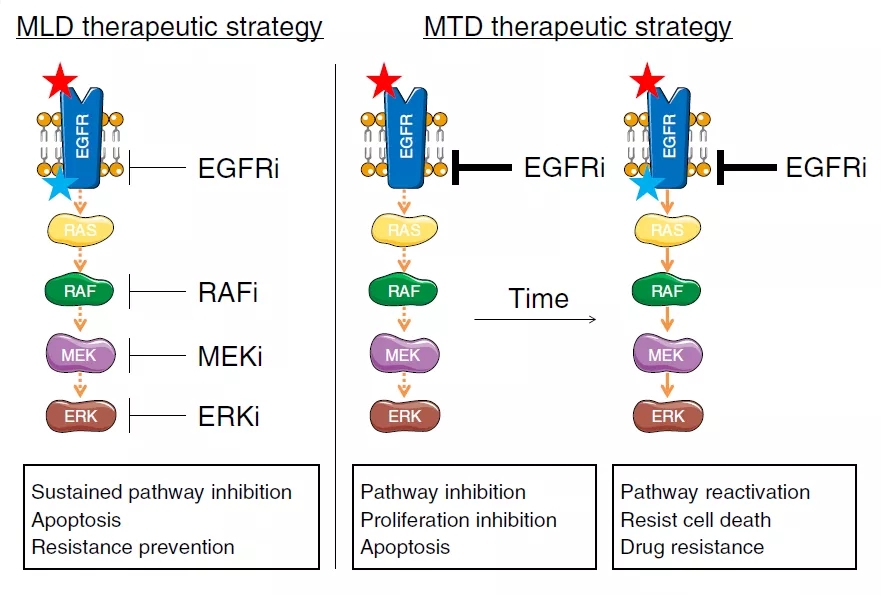
虽然这项研究是针对EGFR突变型非小细胞肺癌的研究,但多重低剂量(MLD)治疗策略对其他类型的肿瘤也可能有效。
总的来说,用多重低剂量(MLD)治疗EGFR突变非小细胞肺癌(NSCLC),有效抑制了耐药性的产生,而没有相关的毒性。这项研究挑战了使用最大耐受剂量(MTD)治疗患者的通用方式,使用低剂量靶向致癌激活通路的多种药物组合,可能更有益处。
https://www.nature.com/articles/s41467-020-16952-9

扫描上面二维码在移动端打开阅读