近日(2020年6月30日),Y-mAbs公司向FDA滚动提交其靶向B7-H3特异性抗体---Omburtamab的生物制剂许可申请(BLA),其非临床模块和CMC模块已在于6月内提交,此次滚动式BLA提交内容包括Omburtamab的hase1研究03-133和Phase2/3阶段101的集合数据,提交工作将在接下来的四到六周内完成。
Omburtamab是一种靶向B7-H3研究性单克隆抗体,由靶向B7-H3抗原的鼠IgG1抗体和碘131组成,正在开发用以治疗小儿中枢神经系统/闭锁转移瘤(CNS/LM),这是神经母细胞瘤的一种罕见且通常是致命的并发症。Omburtamab此前已被FDA授予突破性治疗称号。

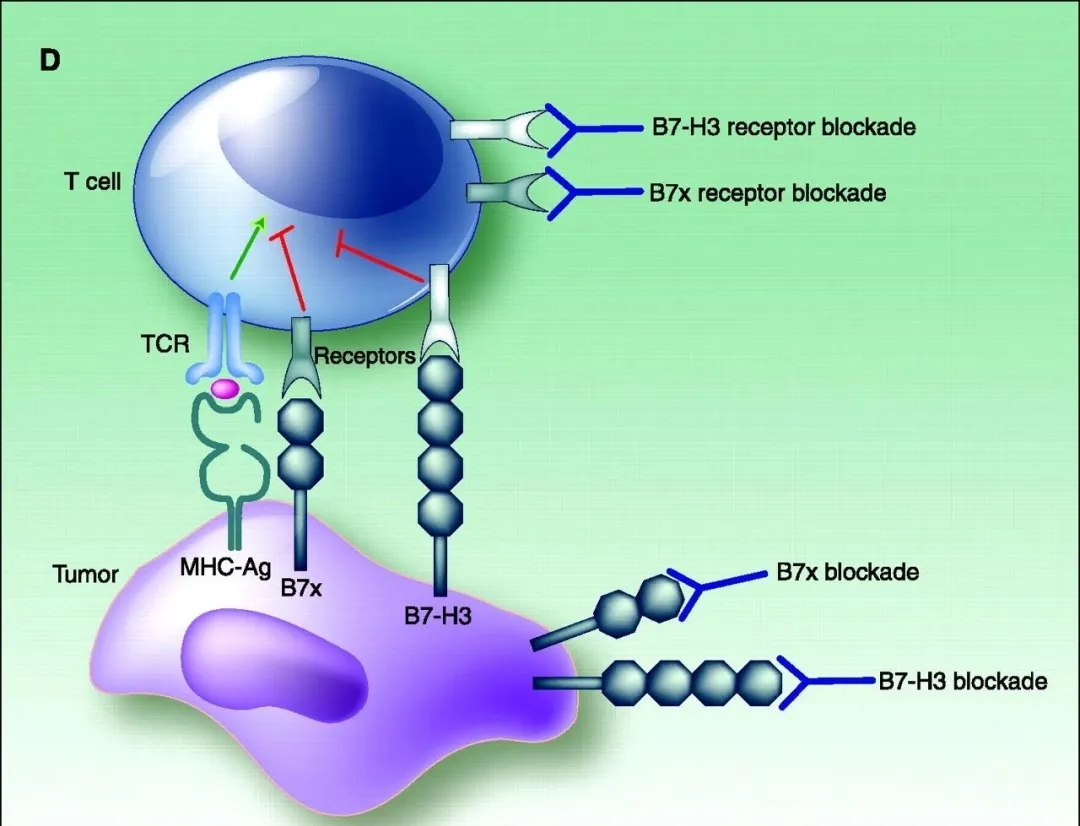
B7-H3是一种I型跨膜糖蛋白,为B7超家族的一个新成员。B7-H3在活化的免疫细胞如T细胞、NK细胞、APCs上均有表达,能以共刺激或共抑制方式调节T细胞功能。
B7-H3在多种肿瘤组织中过表达,在正常组织中很少表达,并且与肿瘤免疫抑制和患者不良预后密切相关。但目前B7-H3在抗肿瘤免疫应答中的功能和作用机制尚不清楚,B7-H3的受体也未确定,业界只是猜测可能是个潜在的新型免疫检查点。
上市申请是基于两项关键的期临床研究101和03-133的安全性和有效性结果。Phase1 03–133研究主要探索了omburtamab鞘内最大耐受剂量(MTD)。来自该研究的93名患者的数据显示,相对于历史6个月的OS中位数,此次的OS的中位数达到47个月(包括估计的五年OS约为43%)。Ⅱ/Ⅲ期的101研究评估omburtamab作为儿童神经母细胞瘤CNS/LM的单一疗法的安全性和有效性。共招募了32位患者。
在神经母细胞瘤方面,Y-mAbs还有另一款产品Naxitamab在今年底左右上市,此前(6月2日),naxitamab的BLA已获得 FDA的优先审查,用于治疗复发/难治性高危神经母细胞瘤的儿童患者,目标日期为2020年11月30日。
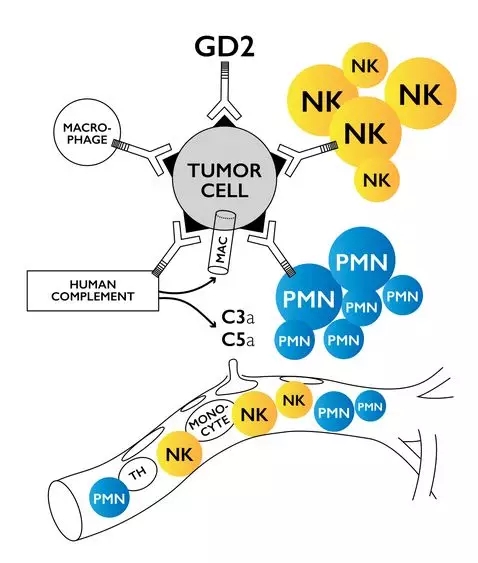
Naxitamab是一种靶向GD2(去唾液酸神经节苷脂)的人源化IgG1抗体,最初由Memorial Sloan Kettering癌症中心( MSK)的研究人员开发,此后Y-mAbs获得了该药的独家授权许可。
naxitamab可通过与肿瘤表面的GD2抗原结合,能够触发抗体介导的细胞毒性反应并激活免疫系统中的补体系统,从而达到杀伤肿瘤的效果。在2018年8月,FDA授予了naxitamab突破性药物资格(BTD),联合粒细胞-巨噬细胞集落刺激因子(GM-CSF)治疗高危神经母细胞瘤。目前Naxitamab在欧盟和美国被授予用于神经母细胞瘤孤儿药称号,并被FDA授予罕见儿科药物和突破性疗法称号。naxitamab正处于治疗复发/难治性高危神经母细胞瘤、骨肉瘤以及其他表达GD2的阳性肿瘤的临床开发中。
在B7-H3抗体开发方面,全球尚无此类药物获批。Macrogenics公司的Enoblituzumab进展也较为领先,不久前,天境生物以1.5亿美元拿下enoblituzumab中国开发权。另外还有一款在研的双特异性抗体MGD009,可同时靶向T细胞上的CD3和肿瘤细胞上的B7-H3,第一三共的还有靶向B7-H3的ADC药物DS-7300,去年底正式启动临床研究。
参考出处
1.https://www.biospace.com/article/releases/y-mabs-announces-initiation-of-submission-of-omburtamab-rolling-biologics-license-application-to-the-fda/
2.https://www.macrogenics.com/wp-content/wbuploads/wb_publications/SITC-2018-Enoblituzumab-Pembrolizumab-Charu-Aggarwal-2018-11-11.pdf

扫描上面二维码在移动端打开阅读