近日(7月1日),Amgen/百济神州的双特异性抗体AMG 910临床申请获得NMPA受理。
据了解,AMG 910是一款Claudin18.2/CD 3双抗,也是首个在我国申报临床的Claudin 18.2双抗。AMG 910目前处于较为前期的研发阶段,检索中文网站消息不多,甚至安进官网中管线(Pipeline)一栏中也尚未列出该项目。
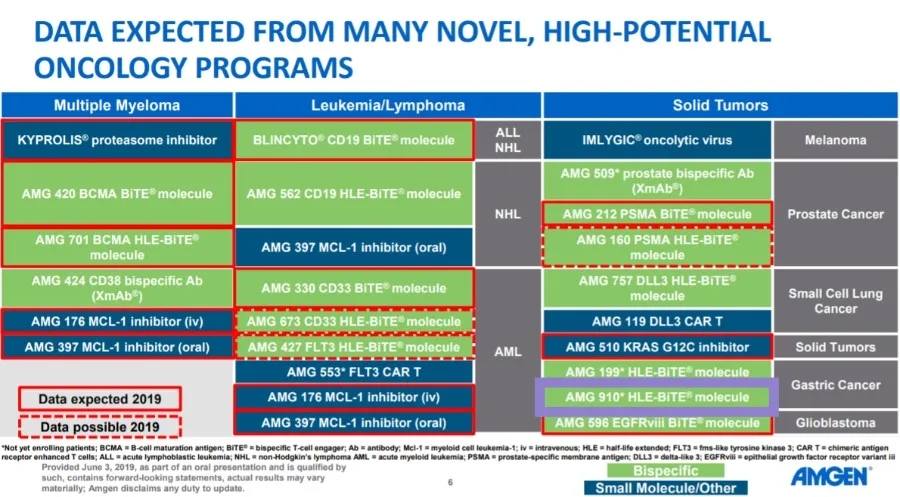
不过2019年3月,安进在ASCO年会上做了题为“Advancing a Portfolio of Novel,High-Potential Cancer Therapies”的报告对公司的创新肿瘤管线进展进行了展示,其中就包括AMG 910。可以看到AMG 910采用了安进最新的专有半衰期延长(HLE)-双特异性T细胞衔接器(BiTE®)技术平台进行开发。
BiTE技术平台
根据一篇2020年6月15日发表于Cancer上题为“The BiTE (bispecific T‐cell engager) platform: Development andfuture potential of a targeted immuno‐oncology therapy across tumor types”的文章,可以详细了解这一平台的细节。
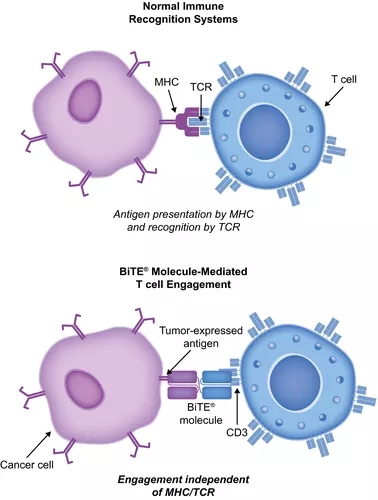
据介绍BiTE技术是一种肿瘤免疫靶向平台,可以将内源性T细胞与肿瘤表达抗原相结合,在不对T细胞进行基因改造或体外扩增的情况下激活患者自身T细胞的细胞毒性。BiTE分子是一种具有两个结合结构域的抗体构建,一个可以识别肿瘤抗原(例如BCMA,CD19,DLL3),另一个则识别T细胞的CD3。
一般BiTE分子
结合结构域由来自单克隆抗体的2个scFv,通过一个灵活的肽连接物串联。第一个scFv结合结构域可以经过修饰来针对各种表面抗原,提供针对各种肿瘤的现成疗效。第二个scFv结合结构域总是靶向CD3这一T细胞受体复合物的不变部分。
当一个BiTE分子同时与细胞毒性T细胞和肿瘤细胞相结合时,T细胞开始增殖,效应细胞总数增加,增强BiTE分子的治疗效力,之后恶性细胞裂解。由于这一过程不需要协同刺激或复杂的MHC机制,所以BiTE分子可以与任何T细胞接触。
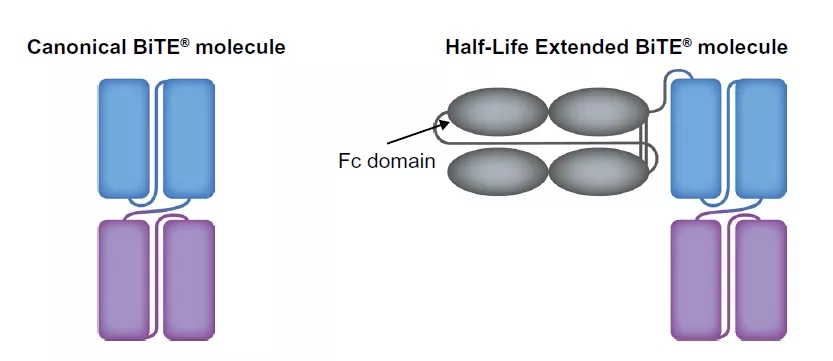
HLE -BiTE分子
由于FcRn作用,全长单抗有着更长的半衰期,而一般的BiTE分子缺乏负责结合FcRn的Fc部分,可能导致了其较短的半衰期。
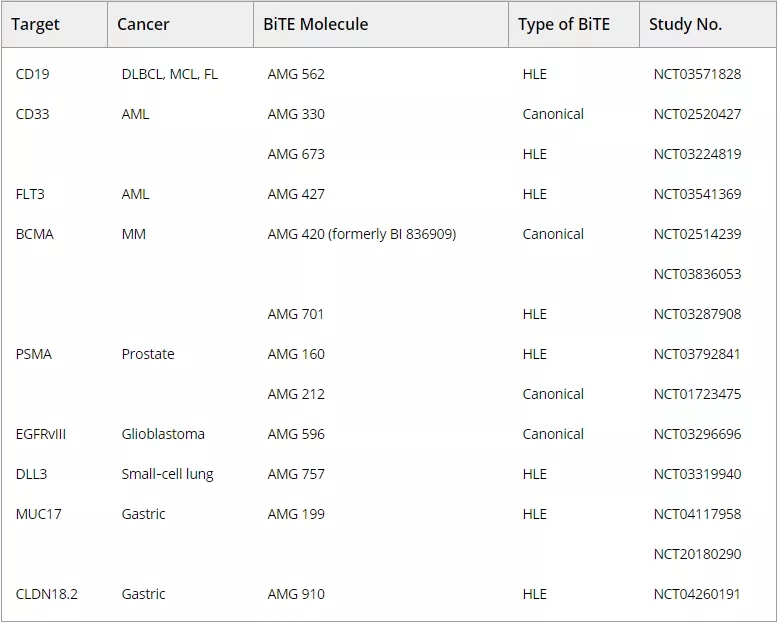
一般的BiTE分子半衰期为2-4小时,需要进行持续的静脉输液,视批准情况采用2天/4天/7天输液袋。对于患者来说较短的半衰期在发生不良事件时是一种好处,但也是一种长期负担。所以为了减轻患者的注射用药负担,安进开发了半衰期延长的BiTE技术,即将BiTE融合到Fc。AMG 910就采用了HLE-BiTE技术,靶点为Claudin 18.2,一种胃癌、食道癌、胰腺癌、肺癌和卵巢癌的上皮表面标记物。AMG910被设计用于引导T细胞向表达Claudin 18.2的细胞转移。目前已经有一项旨在评估AMG 910对胃和胃食管交界处胰腺癌患者的作用的I期临床研究(NCT04260191)正在进行中。
其他相关
目前,已经有一种BiTE分子获批上市——Blinatumomab。该疗法靶向正常和恶性B细胞表面的CD19受体,是一种高效的细胞毒性作用分子,10-100 pg/mL就能发挥效果。当其被使用时,T细胞可以进行一系列的目标裂解,迅速结合并杀死许多细胞,这种作用机制是BiTE疗法的标志性特点,并且已经在其他BiTE分子的研发中被观察到。
Blinatumomab在急性淋巴细胞白血病(ALL)中的有效性和安全性已得到证实,该药物已于2014年获得FDA加速批准,并于2017年全面获批治疗复发或难治性(R/R) B细胞前体(BCP)急性淋巴细胞白血病成人和儿童患者。2018年,Blinatumomab适应症成功扩展到伴微小残留病变(MRD)的前体B细胞急性淋巴细胞白血病。
目前,基于BiTE和HLE-BiTE技术,安进已经研发了多款肿瘤抗原靶向疗法。
参考来源:
1. NMPA
2. AMGEN AT ASCO 2019: ADVANCING A PORTFOLIO OF NOVEL, HIGH-POTENTIAL CANCER THERAPIES
3. Hermann Einsele MD, Hossein Borghaei DO, RobertZ. Orlowski MD,et al. The BiTE (bispecific T‐cell engager) platform:Development and future potential of a targeted immuno‐oncology therapy acrosstumor types, Cancer Volume126, Issue14, https://doi.org/10.1002/cncr.32909
扫描上面二维码在移动端打开阅读