近年来,以CAR-T和TCR-T为代表的过继性T细胞免疫疗法(Adoptive T cell therapy)已成为肿瘤治疗领域最具前景的发展方向之一。其中TCR-T细胞疗法在临床中的应用仍存在许多困难和挑战,特别是对自身抗原反应引起的脱靶毒性以及交叉反应毒性等,因此这就迫切要求我们去开发探寻新的肿瘤特异性抗原靶点。T细胞在特异性免疫应答中发挥的重要作用,主要通过其表面表达的T细胞受体(TCR)特异识别靶细胞表面由主要组织相容性复合体(major histocompatibility complex,MHC复合体)递呈的抗原肽来介导。TCR与抗原肽-MHC复合体(pMHC)之间发生特异结合后,通过激活TCR下游的信号通路从而发挥T细胞在多种疾病中的功能。目前,由于缺乏高效的将TCR与其特异识别的抗原信息相配对的技术,极大限制了我们对T细胞免疫应答机制的深入研究。而高通量测序技术、质谱流式细胞术、微流控技术以及计算生物学等新兴技术以及学科的高速发展,带动T细胞抗原筛选领域的技术性变革。
2020年7月6号,中国医学科学院苏州系统医学研究所李贵登研究员以及美国匹兹堡大学免疫学系Alok V. Joglekar教授在Nature Methods上合作发表题为T cell antigen discovery的综述性文章,该论文阐明了T细胞抗原靶点筛选所面临的各种挑战,并探讨、归纳总结了当前现有的多种T细胞抗原靶点筛选技术,同时深入分析了该领域未来的发展方向及其所面临的挑战,从而为TCR抗原筛选方法的进一步升级以及研究人员对TCR抗原筛选方法的合理选择提供了思路和指导。
在文章中,作者首先讨论了T细胞抗原筛选所面临的挑战。近年来的研究发现,T细胞其对抗原识别具有混杂性(promiscuity)。例如同一种TCR分子可与数量很大的不同抗原肽结合,而且呈递这些抗原肽的MHC分子也可能不相同。而被某个MHC分子所呈递的抗原肽则也可能被很多不同的TCR所识别。但现有技术上的局限性阻碍了对TCR-pMHC相互作用景观的全面理解。TCR抗原筛选技术的进一步升级和突破则有可能解决这一难题,从而促进自身免疫、传染病和癌症免疫研究领域的发展。
一直以来制约我们对TCR-pMHC相互作用的分子机制主要有以下四个主要因素。首先,靶向某一特定抗原的T细胞在外周血中的比例非常低,使得很难准确的检测出这些稀少的抗原特异性T细胞。其次,由于TCR和抗原肽的多特异性,因此某一特定TCR甚至可能识别若干具有非常低序列相似度甚至完全不同的抗原肽。再次,由于TCR和pMHC之间的亲和力远低于抗体及其抗原之间的亲和力,因此需要依赖更为灵敏的生化技术手段来检测TCR和pMHC之间的配对。最后,由于抗原的加工和递呈过程会产生大量的T细胞抗原表位,这就使得完整的合成这些抗原肽并在抗原递呈细胞(APC)中表达这一过程具有很大的挑战性。虽然最近已经开发了一些计算预测工具,比如NetMHC,来预测抗原肽在MHC上的呈递,但他们仍然不能准确预测这些肽的免疫原性。
在过去的几年里,随着T细胞抗原筛选技术的高速发展,使得我们有办法更深入的了解靶向肿瘤、病原体、自身抗原以及食物类抗原的T细胞免疫应答机制。该综述作者详细地介绍了现有的三种类别的TCR抗原靶点筛选技术:1. 通过抗原去筛选其识别的TCR;2. 通过已知TCR筛选被识别的抗原;3. 计算机辅助预测TCR和抗原配对信息,并深入讨论了他们各自的优缺点,以及未来面临的挑战,从而为该领域未来研究方向提供了新的视角。
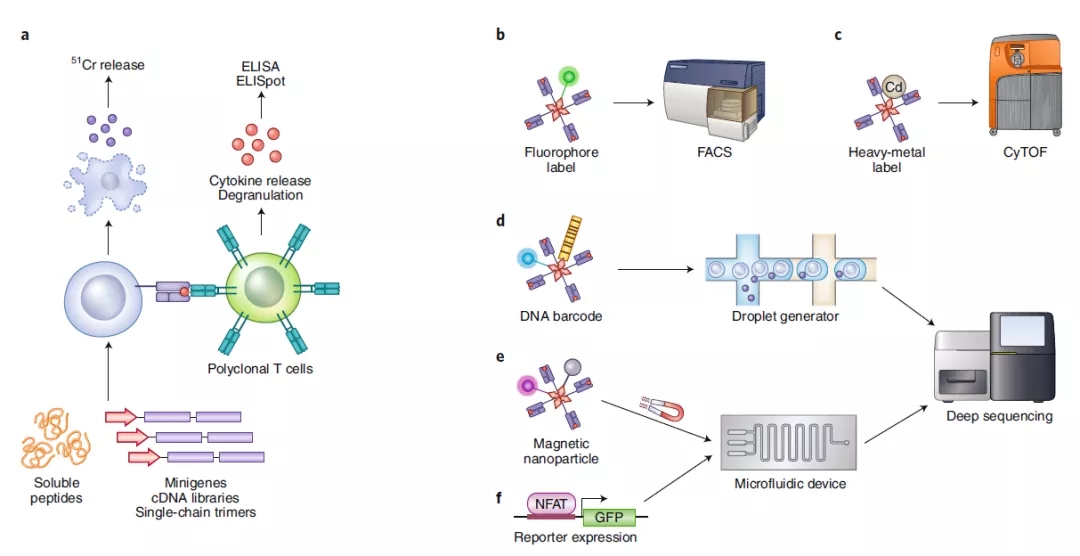
抗原主导的传统的TCR抗原靶点筛选技术通常利用T细胞暴露于某些特定的抗原,通过检测T细胞的增殖、杀伤活性、酶联免疫斑点反应以及TCR下游信号激活情况从而筛选出特异识别该抗原的T细胞。该方法已被成功应用于一系列的肿瘤相关抗原以及自身免疫疾病相关抗原的筛选过程,并成功鉴定出一些识别经典肿瘤抗原(比如MART-1和NYESO-1)的TCR。另外,单链三聚体 (single-chain trimer, SCT) 以及合成的微小基因也被广泛应用于抗原特异性CD8+ T细胞的扩增或筛选,然而该筛选方法需要大量的T细胞。
另一个常用的策略是pMHC多聚体标记技术。pMHC多聚体是MHC分子的可溶性寡聚体形式。自从20年前研究发现和可溶性pMHC单体相比pMHC多聚体可以对TCRs提供足够的结合稳定性以来,荧光标记的pMHC多聚体结合流式细胞仪已经成为免疫分析中最重要的检测工具之一,被广泛用于抗原特异性T细胞的定性和定量分析以及分离。近年来,包括UV多肽交换在内的多项技术的发展则解决了单独制备纯化每一种pMHC多聚体步骤繁琐的瓶颈。pMHC荧光多聚体方法的另一个主要缺点是,由于可用的荧光染料数量有限,在一个生物样本中只能检测到少量的抗原特异型性T细胞。而使用多荧光标记多聚体的组合编码的方法则提升了十倍左右的检测能力(几十个抗原特异性T细胞/每个样品)。此外多种新技术手段,例如质谱流式标记技术以及DNA-条形码标记技术等,也被开发并用于扩大可标记的抗原特异性T细胞的数目。其中重金属质谱pMHC多聚体标记技术可使一次实验中能同时使用一百多个标记的pMHC多聚体,而DNA-条形码标签技术可以使得标记pMHC多聚体种类达到一千个以上。pMHC多聚体的使用需预先确定所要应用的抗原肽的信息。此外,多种因素也可能制约该技术的实际应用的广度,包括抗原肽合成过程的有限性、pMHC多聚体生产效率的低下、pMHC多聚体文库的容量有限、pMHC聚合体的不稳定性(特别是MHCII多聚体)以及PCR扩增的偏差等。
微流控技术的快速发展为高通量TCR-pMHC配对筛选提高提供了新的工具。结合微流控技术和报告基因,pMHC多聚体标记和单细胞测序等多项方法,不仅可以达到高通量筛选获得抗原特异性T细胞,也可同时获得该T细胞所携带的TCR信息,从而达到高通量快速TCR与抗原肽的精准配对。
尽管抗原介导的TCR靶点筛选技术有其一定的局限性,然而该方法仍然为研究抗原特异性T细胞的免疫反应以及分离、鉴定具有临床应用价值的TCR提供了有力的工具。
图1. 通过抗原去筛选其识别的TCR的技术
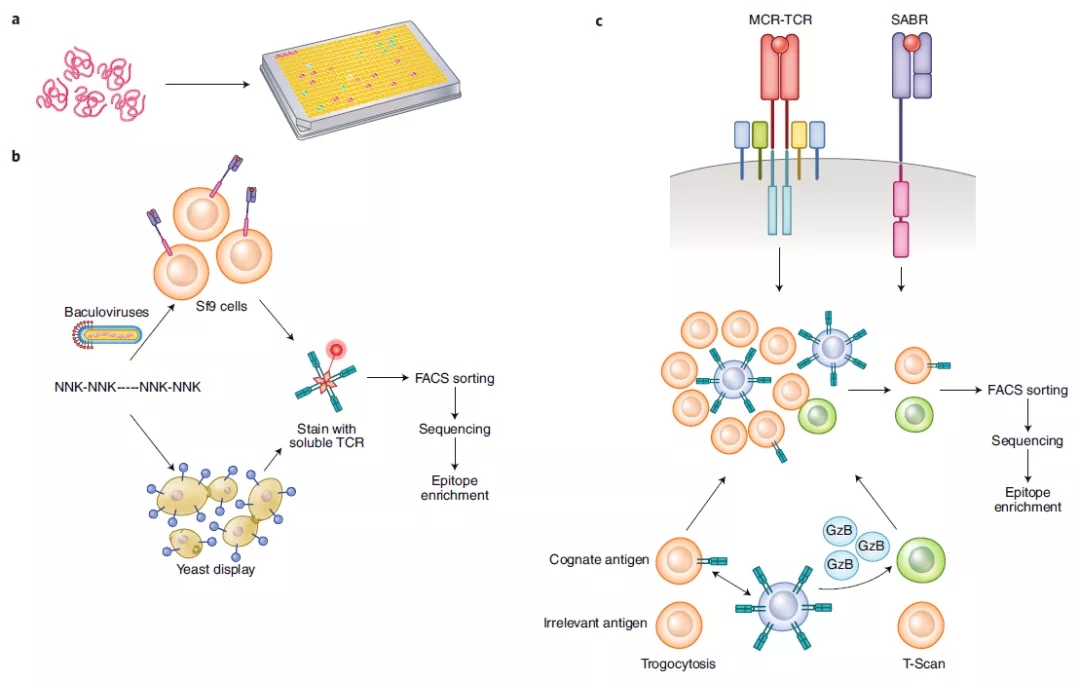
TCR主导的T细胞抗原靶点筛选技术主要从荷载大量pMHC复合体的文库中筛选出某一TCR或者T细胞克隆所识别的抗原信息。早期的TCR介导的筛选方法主要利用随机合成肽段文库获得某一TCR特异识别的抗原肽信息。例如将体外合成的肽段中某一或某几个位置固定,其他位置随机分布得到的肽段文库偶联到磁珠表面,通过分析其对携带某一TCR的T细胞的激活能力。这种策略也已被用于鉴定某一TCR识别的模拟表位信息(minotopes)、评估TCR交叉反应性以及分析免疫疾病个体的TCR组谱。
pMHC复合体还可通过基因工程技术展示在杆状病毒、酵母的表面,再利用体外合成制备偶联荧光标记的TCR试剂,通过几轮反复染色分选,最终获得TCR特异识别的抗原信息。酵母表面展示技术最大的优势在于其真正达到了应用相同的密码子简并规律荷载表达数十亿个pMHC复合体。因此它不需要预先知道每一个抗原表位的信息,而可以达到无偏差的TCR抗原筛选过程。该技术需要对不同的MHC等位基因进行一定的修饰从而促进其在酵母中的表达,并维持其稳定性以及抗原递呈能力,也需要针对每个孤儿TCR都要制备相应的荧光标记的可溶性TCR。
与此不同,荷载pMHC复合体文库的哺乳细胞则可以通过被TCR识别后,通过激活下游信号,从而将被识别细胞与其他不相关的细胞区分开。比如MCR的Joglekar教授开发的SABR方法是利用改造过的pMHC复合体来启动激活信号。当抗原呈递细胞和配对的T细胞相互识别后,则会激活抗原呈递细胞中的下游的NFAT信号通路从而诱导荧光蛋白的表达。随后进一步分选这一些靶细胞,并通过二代测序就可以获得其携带的抗原信息,从而达到TCR与抗原的精准配对。此外, T-Scan平台则是利用当T细胞表面TCR与其靶细胞识别后会将颗粒酶B (GzB) 运输到靶细胞内这一T细胞杀伤功能的生理过程,通过荧光报告基因的激活检测靶细胞中GzB的活性,从而筛选出携带有TCR特异识别的抗原肽信息的靶细胞。而李贵登研究员先前开发的TCR抗原筛选方法则是巧妙的利用了T淋巴细胞和抗原递呈细胞之间特有的胞啃作用(trogocytosis),通过标记T细胞和其识别的目标细胞表面膜蛋白转移来实现TCR-抗原的精确配对的筛选(见BioArt报道:Nature Methods丨李贵登博士等开发出基于胞啃作用的T细胞受体抗原靶点筛选新方法)。在这几种方法中,SABR和胞啃TCR抗原筛选技术用来筛选任意HLA类型的TCR所识别的抗原。这种技术不仅仅可以用来筛选被MHCI所呈现的抗原-TCR配对,也可以应用于MHCII所呈现的抗原-TCR配对,从而可以用来鉴定除了肿瘤之外与其他的免疫疗法相关的潜在抗原,比如那些自身免疫疾病抗原。利用哺乳细胞系文库可同时筛选104-105种抗原表位,其容量介于抗原主导的筛选方法以及酵母展示文库之间。此外和其他细胞相比,以哺乳细胞介导的抗原筛选方法更接近于真实的TCR和抗原的相互识别,而且技术方法上更容易入手。
图2. 通过已知TCR筛选被识别的抗原的技术
由于人体免疫系统中存在巨大数量的TCRs,使得上述多种TCR抗原靶点筛选方法不能完全满足实际需求。因此,以计算生物学为基础利用TCR序列信息来进行抗原靶点的预测方法则应运而生。高通量TCR测序技术的快速发展以及人们对于TCR-pMHC配对信息及其相互作用认识的深入,均为TCR抗原预测算法的建立奠定了基础。这些方法主要建立于具有相似CDR3序列的TCRs有可能靶向序列相似的抗原表位这一基础上。以此为基础的方法,研究人员成功利用TCRβ链信息进行CMV感染状况以及HLA结合亚型的分析。2017年两项独创性的研究建立了GLIPH以及TCRdist算法并应用于TCR抗原靶点的预测。这两项研究均表明,识别相同抗原的多数TCRs具有相同的序列以及相似的TCR结构特征,从而可以根据这些特征将TCR进行分类, 并最终预测其靶抗原信息。其他类似方法则利用了TCR-pMHC结合时的分子动力学以及构象特征或者氨基酸的生化特性等信息。这些计算机算法的建立会给TCR抗原筛选领域带来突破性进展。这些算法预测的精确性则受现有的TCR-pMHC配对信息数据规模的影响。而TCR抗原筛选的体外实验则可以对为这些算法提供大量的有效数据,并对预测的准确性进行验证。
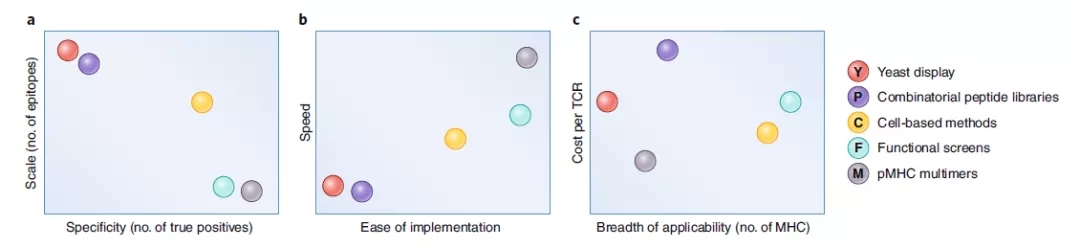
最后本文作者对比了各种抗原筛选方法的优劣,也为研究者们如何针对自己研究目的选择适合的TCR抗原靶点筛选方法提供了参考意见。
图3. 不同TCR抗原筛选技术的比较
总体而言,虽然不同TCR抗原靶点筛选技术有其自身的优势以及限制性,随着后续理论以及技术的进步,会建立出更具优势、更快速且精确度更高的TCR抗原靶点筛选平台。
李贵登课题组主要围绕肿瘤微环境免疫调控,T细胞抗原筛选和细胞免疫治疗相关研究。由于科研工作需要,目前课题组正在招聘优秀博士后/助理/副研究员2名。欢迎有志于肿瘤免疫治疗研究的优秀人才加入团队,课题组将提供一流的科研环境和良好个人发展空间。有意者请将个人简历和应聘意向、代表性论文发送至guidengl_ism@163.com)(邮件标题请注明: 姓名+申请职位)。
扫描上面二维码在移动端打开阅读