1973年,加拿大科学家拉尔夫斯坦曼教授第一次在小鼠脾脏中发现了一种特殊的细胞,因其细胞膜伸出许多类似于神经细胞的树突故而得名。随后,他一直在研究这种细胞在人体抵抗病原体中发挥的重要性,以及它如何被用来治疗疾病。
造化弄人,34年后,他不幸被诊断为最为难治,预后极差的胰腺癌。那时,得了胰腺癌几乎等于背叛了死刑,这种恶性程度极高的肿瘤没有任何好的治疗方案,存活时间一般是几周到几个月。于是他决定自救,他基于树突状细胞设计了一种疫苗方案,使用自己的肿瘤表面特异性抗原刺激体内的树突状细胞,然后用激活的树突状细胞启动全身的免疫应答。当这些树突状细胞注射回体内时,能够增强抗原特异性T细胞的产生,并且能够重新识别并攻击肿瘤细胞。最终,拉尔夫教授生存了四年半,他坚信是树突状细胞延长了自己的生命。
2011年10月3号,斯坦曼因其研究成果获得了诺贝尔生理及医学奖,但他永远不会知道这个消息了。在68岁这一年,与癌症斗争了4年半之后,在诺贝尔奖揭晓的3天前病逝。
但此后,开启了医学界对树突细胞疫苗研发的热潮。成为近年来研发成果较多的一类免疫疗法,目前已有FDA批准上市的树突细胞疫苗以及众多进入三期临床试验的值得期待的疗法。
FDA批准的首款树突细胞疫苗已上市!
2010年4月,FDA批准了首个癌症治疗疫苗PROVENGE(sipuleucel T),用于晚期前列腺癌的治疗,使该药成为第一个在美国被批准用于治疗的树突细胞疗法,开创了癌症免疫治疗的新时代,这项批复标志着20年的不懈努力终于取得成功。
激活自身免疫系统攻击癌症!树突细胞强大的抗癌机制
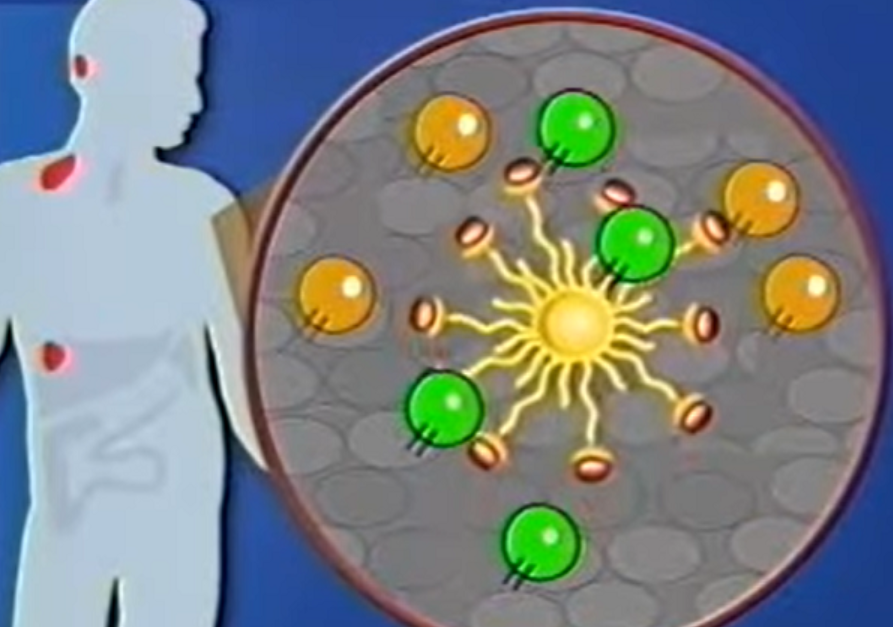
树突细胞是目前所知的机体内功能最强的抗原提呈细胞,最大的特点是能够刺激初始T细胞进行增殖。因此,DC是机体免疫应答的始动者,在免疫应答的诱导中具有独特的地位。树突细胞可以通过多种机制杀伤肿瘤细胞:
1 树突细胞通过表面丰富MHCI、II类分子提呈大量肿瘤抗原肽,使相应T细胞受体被充分占据;
2 树突细胞提供高水平B7-1、B7-2、CD40共刺激因子,充分激活T细胞;
3 树突细胞与T细胞结合,分泌大量IL-12,利于T细胞对肿瘤的清除;
4 树突细胞同时分泌趋化因子,专一性趋化初始型T细胞,促进T细胞富集,增强对T细胞激活。
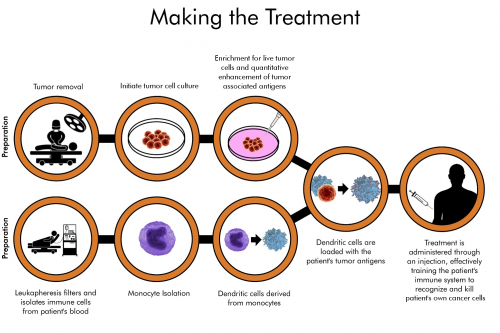
虽然人体的免疫系统中本来就有这种树突状细胞,但数量和活力都不够围歼癌变细胞的程度。于是,经过大量研究,研究人员将有潜力成为树突状细胞的前体细胞通过特定的方法从血液中分离出来。借助于某种特定的信使,在试管中分离出来的细胞可以获得免疫能力。当前体细胞成熟为树突状细胞时,他们即可捕获特定的肿瘤抗原,有效杀灭癌细胞。
并且体外重建的树突细胞回输体内时可以激活静息T细胞产生初次免疫应答的细胞,激活的T细胞可以被点状放大并进一步增殖。一个树突能激活100~3000 个T细胞,一部分T细胞迅速发挥巨大的抗癌作用,而另一部分会存活长达十几年到几十年成为记忆性T细胞,在下一次接触到低剂量抗原就可发生高强度的免疫应答。所以,基于树突细胞修复和重建的免疫防护系统可以持续发挥作用数十年,并在适当的条件下可以重新进入循环发挥长效的抗癌作用。
由于树突状细胞抗肿瘤特性与疫苗原理一致,因此树突细胞疗法在临床中更多的被称为树突细胞疫苗。
树突细胞疫苗在实体肿瘤中的最新研究进展
目前树突状细胞肿瘤疫苗正在全球范围内被迅速、广泛的研究 ,并且已在动物实验和早期的临床实验中取得了很有意义的结果,其中,脑瘤,肾癌,黑色素瘤的树突细胞疫苗研发已进入三期临床试验阶段,有望上市。大家也可以致电全球肿瘤医生网医学部评估适合自己的树突细胞疫苗。
1
目前在约翰·霍普金斯·金梅尔癌症中心正在进行一项联合或部联合PD-1阻断抗体(Nivolumab)和CD137激动剂抗体(Urelumab)的GM-CSF分泌同种异体胰腺癌疫苗的随机研究,用于新辅助和辅助治疗可手术切除的胰腺腺癌患者。
胶质母细胞瘤被称为免疫性“冷”肿瘤,这是因为脑肿瘤含有很少的免疫细胞,大脑中存在着一种叫做血脑屏障的系统,会阻碍T细胞进入大脑组织。想要这些免疫细胞需要产生针对肿瘤的免疫反应非常困难。但近两年,这种瓶颈逐渐被突破,多项疫苗的研发显示出初步的疗效,给患者带来希望。
DCVAC/LuCa是由SOTIO研发的针对非小细胞肺癌患者的树突状细胞疫苗。通过将树突状细胞与裂解死亡后的患者自体肺癌细胞所释放的抗原物质融合,使树突状细胞获得识别肺癌细胞的能力,并经过体外扩增后回输入患者体内进行治疗。
在一项冲击一线治疗方案的研究中,研究者选取了来自12个研究中心的112例患者。
结果显示:
mOS(中位总生存期):接受DCVAC/LuCa联合化疗治疗的患者为15.5个月,仅接受化疗的患者为11.8个月;
mPFS(中位无进展生存期):接受DCVAC/LuCa联合化疗治疗的患者为6.74个月,仅接受化疗的患者为5.63个月。
ORR(客观缓解率):接受DCVAC/LuCa联合化疗治疗的患者整体缓解率为45%,仅接受化疗的患者为34%。
整体来说,DCVAC/LuCa将IV期非小细胞肺癌患者的死亡风险降低了足有46%!这一研究结果为树突状细胞疫苗治疗非小细胞肺癌的疗效提供了证据。研究者认为,在一线标准化疗方案的基础上联合DCVAC/LuCa治疗,疗效确切。
加州大学洛杉矶分校的科学家已经发现了一种树突状细胞疫苗,其扩大了免疫系统对非小细胞肺癌(NSCLC)的反应,这是最常见的肺癌形式。该研究是第一个在人类中测试疫苗的研究,具有重要的临床意义,因为非小细胞肺癌和其他晚期癌症患者是非常难以成功治疗的,该方法可以提高目前抗PD-1免疫治疗对癌症的杀伤力。
该研究在线发表在美国癌症研究协会同行评议的临床癌症研究杂志《Clinical Cancer Research》上。
在I期临床试验中,将CCL21-树突疫苗直接施用于16例非小细胞肺癌患者的肿瘤中,两次剂量间隔约7天。加州大学洛杉矶分校的科学家们在接种疫苗当天比较了每个患者的一组肿瘤样本。
结果显示,在第56天,25%的患者病情稳定(意味着其肿瘤的大小不增加或减少)。在54%的患者中,CD8细胞浸润于肿瘤中,在接种疫苗后患者的PD-L1表达也显着增加。副作用是可控的,主要限于流感样症状,恶心和疲劳。
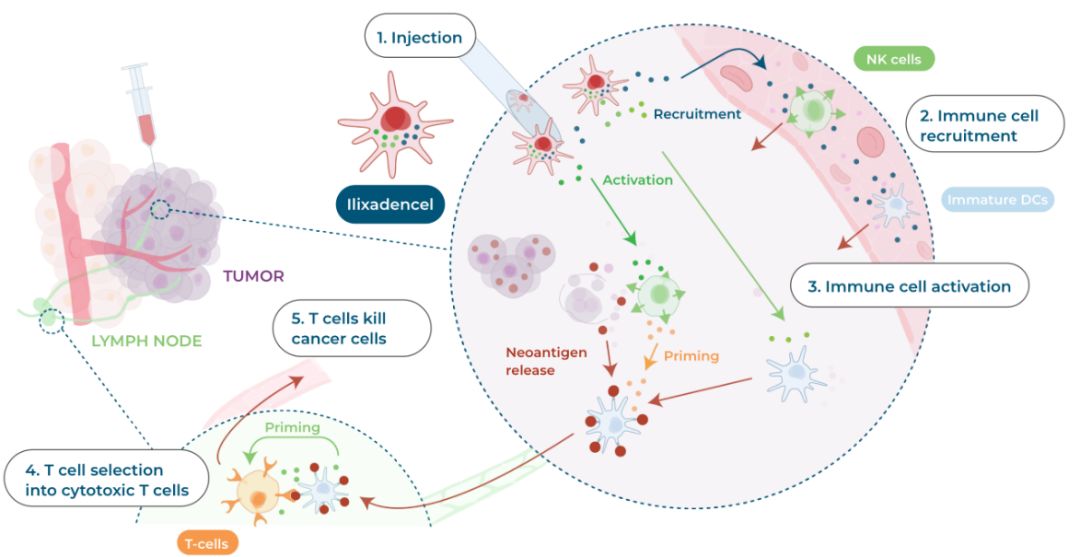
伊利沙定(Ilixadencel)是一种同种异体细胞治疗产品,属于预制的免疫触发剂,来源为健康供应者的树突状细胞。这些细胞在体外被激活,能够产生大量有针对性的免疫刺激因子,经注射入肿瘤部位后可以引起局部的免疫炎症反应,进而破坏肿瘤细胞和肿瘤组织,同时激活患者自身的免疫细胞,启动患者自身对肿瘤的免疫过程。
目前临床上正在进行的关于ilixadencel的研发试验共针对六种癌症类型,包括肾癌、肝癌、胃肠道间质瘤、头颈部肿瘤、非小细胞肺癌和胃癌,研究均有一定的进展。
其中,关于肾癌患者的应用研究进展最快,已经开始进行Ⅱ期MERECA研究(n = 88),对比联合应用ilixadencel与酪氨酸激酶抑制剂索拉非尼的患者与单独使用索拉非尼的患者的疗效。该研究已经完成了Ⅱ期的招募工作,预计于Q319完成试验并公开结果数据。
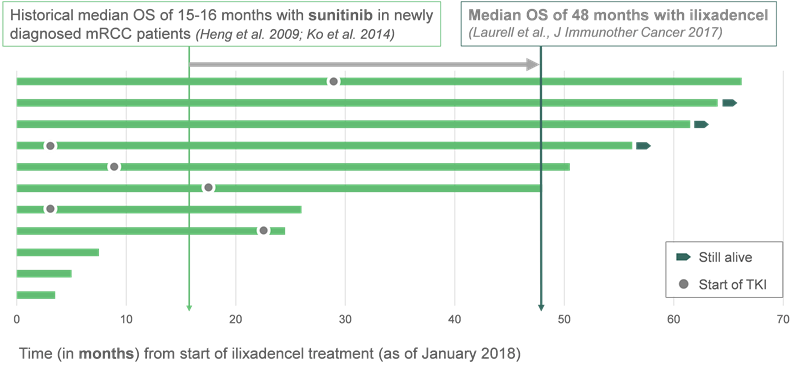
Ⅰ/Ⅱ期试验结果显示,晚期肾癌患者的总生存期是历史对照组的3倍以上!
目前这款疫苗仍在进行临床招募:
基于Arcelis平台开发并进入III期临床开发的一款个体化免疫疗法,可诱导一种靶向患者特定肿瘤抗原的免疫反应。当rocapuldencel-T诱导新的T细胞(包括持久记忆细胞和杀伤细胞)激活和扩增,专门攻击每个患者肿瘤的独特抗原时,即实现了所谓的“新免疫(neo-immunity)”。
Arcelis技术平台是基于患者DC和肿瘤样本创造出的一个完全个性化免疫疗法的治疗平台,能捕捉到针对每个患者个体疾病的突变(neoantigen,新抗原)抗原谱和变异抗原谱。这种疗法旨在通过特异性的靶向性持久记忆T细胞,克服免疫抑制。
制备Arcelis的过程仅使用很少量的疾病样本或活检样本作为抗原特异性抗原的来源,以及来自患者自身的DC(通过分离白细胞获得)。专有的工艺程序包括利用从患者疾病样本的RNA来编程DC细胞靶向疾病特异性抗原,这些活化的、加载了特定抗原的DC细胞与患者的血浆配制,通过皮内注射给药,进行个体化的免疫治疗。
除了伊利沙定和rocapuldencel-T,上面提到的NEO-PV-01,NeoVax也都在肾癌中初步显示出良好的临床效果,在此不一一介绍了,想了解每款疫苗详细信息的可以咨询全球肿瘤医生网医学部相关实验的入组条件(4006667998)。
2019年7月,美国的一家生物制药公司Elios Therapeutics开发创新的自体,颗粒交付,树突状细胞肿瘤疫苗,宣布了前瞻性,随机,双盲,安慰剂对照的IIb期临床试验结果。
入组的144例III期和IV期切除的黑色素瘤患者,随机接受TLPLDC疫苗或安慰剂,以防止疾病复发。
结果显示,治疗第24个月,与安慰剂相比,TLPLDC疫苗将患者疾病复发风险显著降低。具体数据为:在研究入组的全部144例患者(ITT),包括那些从未或未完全接种疫苗的患者,安慰剂组的复发率为66%,而TLPLDC疫苗组的复发率为54%,意味着复发风险具有18%的临床意义降低,尽管在统计学上不显著,但降低了疾病复发的相对风险。然而,对已完成TLPLDC疫苗或安慰剂疫苗初级免疫(6个月)的所有患者开展的PT分析显示,安慰剂组的复发率为56%,TLPLDC疫苗组复发率为29%,代表着疾病复发相对风险在统计学上显著降低了50%。
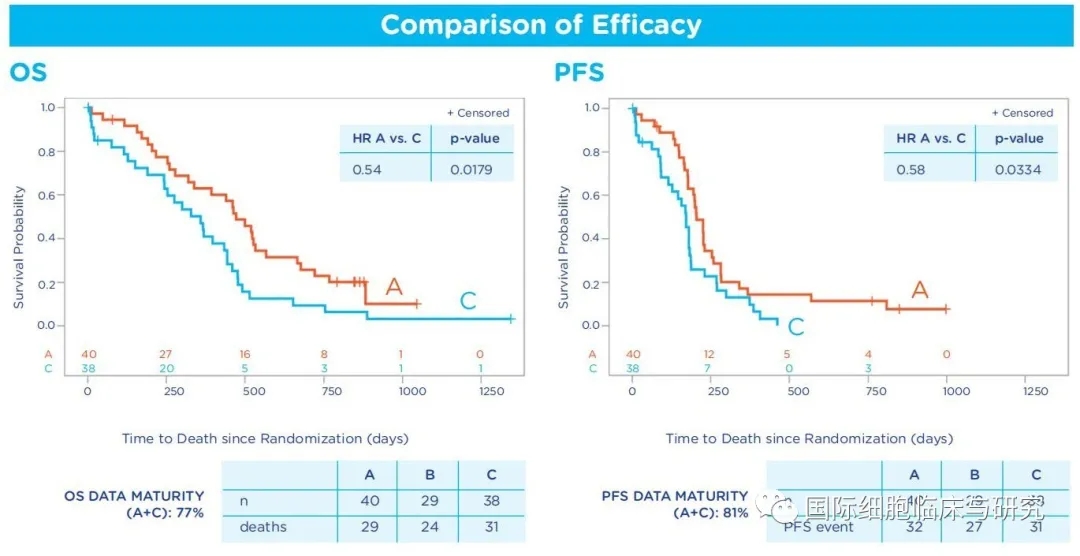
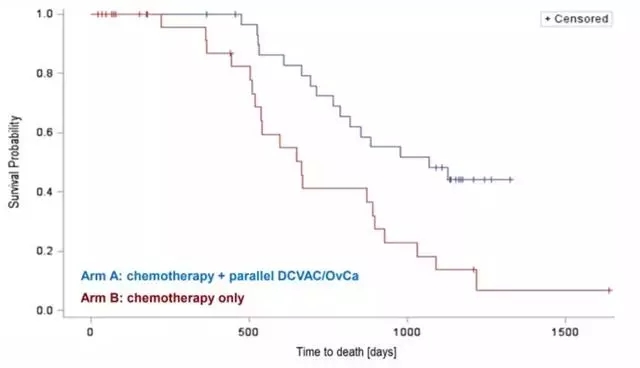
2019年第50届妇科肿瘤学会(SGO)年会上,一项二期临床试验SOV02(NCT02107950)最终结果公布:对复发,铂敏感,上皮卵巢癌患者使用基于树突状细胞的免疫疗法DCVAC / OvCA添加到标准卡铂和吉西他滨方案,可以使晚期复发的卵巢癌患者总生存期(OS)延长一年多,这个数据绝对称得上惊艳!
-
DCVAC / OvCa将卵巢癌二线治疗的死亡风险降低了62%。
-
总生存期(OS)显着增加13.4个月。中位数无进展生存率(mPFS)增加了1.8个月。
-
即将开展全球三期研究。
很多病友想问了,这款细胞疗法只针对卵巢癌么?
这款细胞疗法是一家名为SOTIO国际生物技术公司研发的,该公司正在基于DCVAC 平台开发三种细胞疗法,卵巢癌患者的DCVAC / OvCa,前列腺癌患者的DCVAC / PCa和肺癌患者的DCVAC / LuCa。我们也可以理解为这是三种分别针对于卵巢癌,前列腺癌和肺癌的树突细胞疫苗。所以还是非常值得期待的。
该公司目前正在通过多个I期至III期临床试验测试研究性药物治疗DCVAC的安全性和有效性。
最近的是卵巢癌的三期树突细胞疫苗(DCVAC / OvCA)试验,预计今年9月份开始招募,一旦开始,全球肿瘤医生网医学部将第一时间为大家公布。
一项正在H. Lee Moffitt癌症中心和研究所进行的HER-2脉冲DC1疫苗试验将测试在高风险HER-2高表达和中度表达乳腺癌中的安全性和免疫原性,用来预防乳腺癌的复发。
研究人员认为结合化疗的树突状细胞疫苗可以增加完全反应,使乳腺癌特异性免疫细胞有更大的机会发挥功能,并预防乳腺癌的复发。入组患者在初始诱导疫苗后,进行免疫分析,随后每隔3个月施用三剂加强疫苗,并分别进行免疫分析。
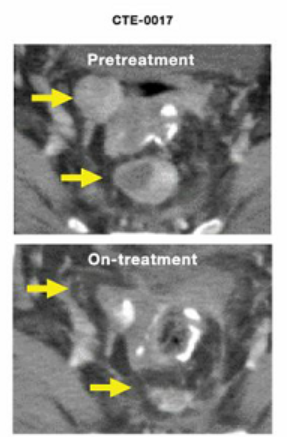
一项新的小型新研究表明,一种直接注射到单个肿瘤中的新型癌症“疫苗”可以激活免疫系统 攻击全身的癌细胞。
这项研究是由纽约西奈山伊坎医学院淋巴瘤免疫治疗项目主任Joshua Brody博士领导的,他说,“将疫苗注射到一个肿瘤后(原位疫苗接种),我们看到整个身体内的肿瘤消失”。
这项重磅的研究4月8日发表在国际顶级期刊“ Nature medicine”杂志上。
在抗癌疫苗的治疗下,11名患者中有8名取得了病情缓解,其中完全缓解的患者有2名。1名达到完全缓解的患者,无进展生存期已经接近4年!这些积极结果,也让研究人员们充满信心,现在该治疗方法也正在乳腺癌和头颈癌患者中进行检测。
现在的医学虽然还无法治愈癌症,但是已经有很多新的研究和治疗方案可以提高患者的生存治疗,尽量延长生存期。癌细胞表面存在特殊的蛋白质,通过靶向这些蛋白质,免疫系统可以特异性地消除癌细胞,同时不伤害正常的细胞。
上文中已的癌症疫苗,大部分目前都处于早期的临床试验阶段,想接受治疗只有通过申请临床试验入组,像DCvax-L疫苗已经进入到三期临床试验,有望上市,我们期待能够看到更多的有效数据。
此外,还有一些国家的树突细胞疫苗已经正式进入临床应用,一些早期肿瘤患者可以在手术后考虑使用疫苗联合放化疗辅助治疗,起到杀伤残余癌细胞,产生免疫记忆,预防癌症复发和转移。大家可通过全球肿瘤医生网医学部评估申请。
此外,全球在研的抗癌疫苗临床试验有200多项,大家可以添加文末二维码或致电,通过医学部匹配适合自己的抗癌疫苗临床试验。”科学家们说。“如果成功,在随后的试验中,个体化疫苗将被用于各类癌症,拥有足够数量的新抗原接种疫苗具有巨大潜力。
随着这些新型抗癌药物、疫苗和不断开发中的单克隆抗体研究,将被称为“绝症”的晚期癌症变为一种慢性疾病,从根本上改变对癌症治疗的观念。我们期待,从现在起10年后,人类能够接种疫苗来预防癌症,战胜癌症,相信这一天离我们不远了!
扫描上面二维码在移动端打开阅读