通用型细胞治疗
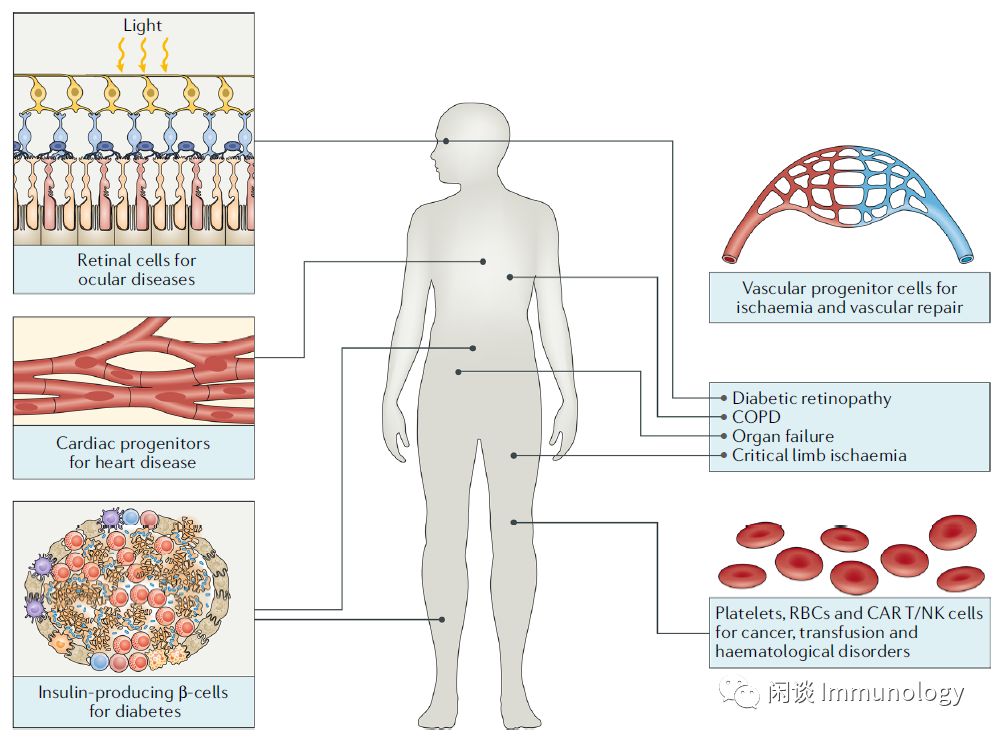
通用型细胞治疗,可被广泛应用一系列疾病。如目前正在临床上开展的多能干细胞治疗,从视网膜细胞治疗眼部疾病到心脏祖细胞治疗心脏病,到产生胰岛素的β细胞治疗糖尿病,CAR-T用于肿瘤治疗等。
HLA/MHC分子
同种异体细胞和组织移植的主要免疫障碍是MHC分子的相容性。MHC分子也称为人类白细胞抗原(HLA),由一组高度多态的基因编码,包括HLAⅠ类(HLA-A、HLA-B和HLA-C)和II类分子(HLA-DP、HLA-DM、HLADO、HLA-DQ和HLA-DR)。
HLAⅠ类分子在所有有核细胞表面表达,向CD8+T细胞递呈抗原。
HLAⅡ类分子向CD4T辅助细胞递呈抗原,主要由特异性抗原-递呈细胞表达。
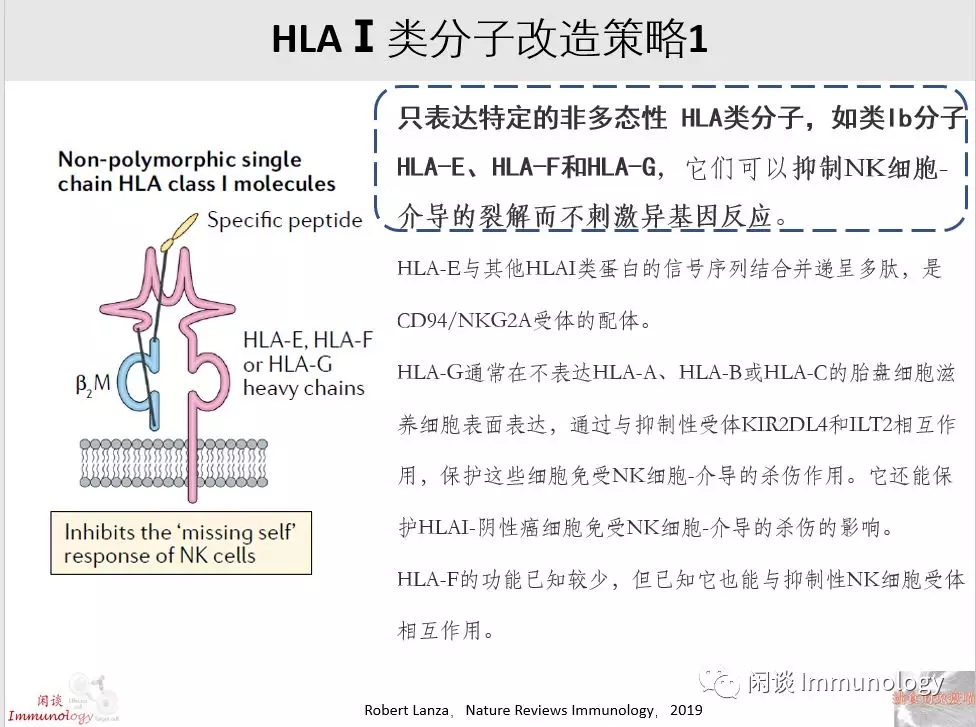
自然杀伤(NK)细胞通过“丧失自我/missing self”反应,可以识别和消除表达HLAⅠ类分子的细胞。
丧失自我:当NK细胞的抑制性受体与HLA-1分子结合时,可以抑制NK细胞对于HLA-1细胞的杀伤作用。KIRs(Killer Ig-like receptors)识别HLA-Cl-I上的同种异型决定簇,而CD94/NKG2A则特异性识别HLA-E。
当NK细胞抑制性受体不能结合HLA-1时,则,NK细胞就会启动丧失自我反应,清除该类细胞。
HLAⅠ类分子的工程改造
例如:iPSC或者胚胎干细胞工程改造,将HLA-1类分子去除,可以避免T细胞的细胞毒性,但是无法逃脱NK细胞裂解的厄运。所以将HLA-E工程入iPSC和胚胎干细胞分化的细胞,可以解决这个难题(文献1)
HLA II类分子工程改造
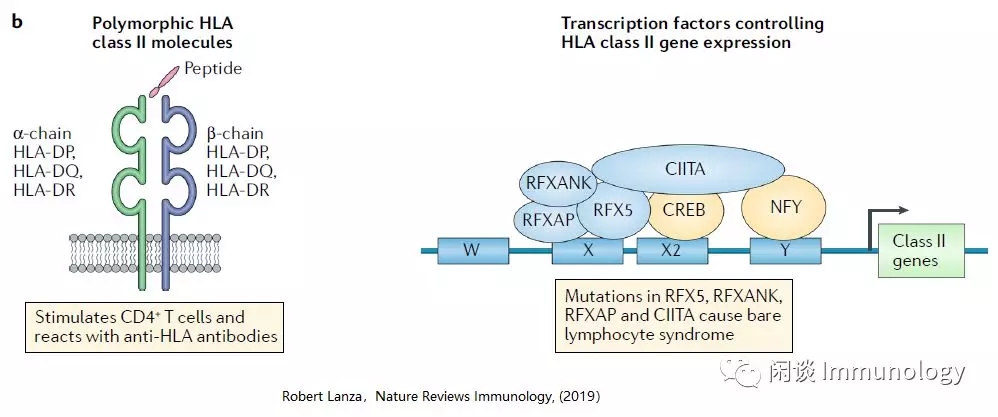
HLAII类分子(HLA-HDP、HLA-HDQ和HLA-HDR)是α-链和β-链形成的异二聚体,表达在抗原呈递细胞如,B细胞、巨噬细胞和树突细胞。
一些非专业抗原呈递细胞, 如基质细胞或胰岛β-1细胞,在暴露在炎症因子的情况下,可表达HLAII类II因子。
一个更简单的方法:不是消除所有单个HLAⅡ类基因的表达,而是敲除所有HLAⅡ类基因表达所需的转录因子。
裸露淋巴细胞综合征患者,由于CIITA、RFX 5、RFXAP或RFXANK四种不同转录因子基因突变,而缺乏HLAⅡ类基因表达。
CIITA和RFXANK在人PSCs中被敲除,并被证明能阻止这些细胞的分化后代HLAⅡ类的表达。
HLA工程改造细胞的优势
-
标准化-易于表征和质量控制
-
治疗可及性强
-
不递呈自身抗原
免疫遮蔽(Immune cloaking)
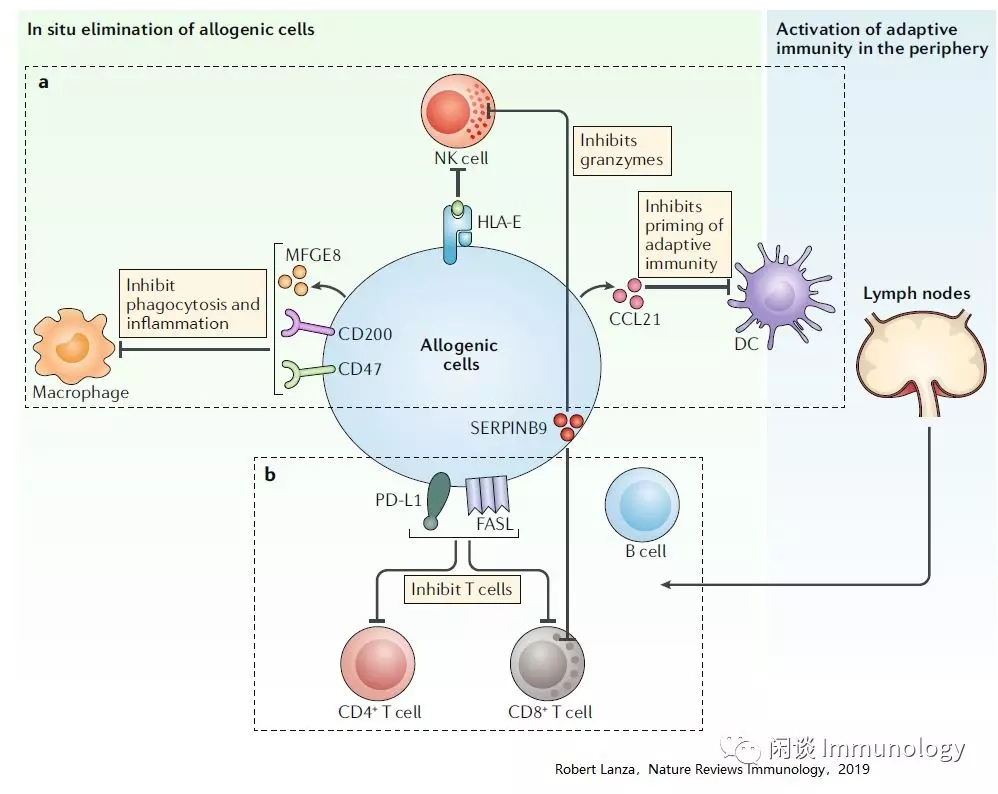
除了自体细胞,自然界存在一些种类的细胞,可以逃避人类免疫系统的监视。如胎盘缺少HLA-I类II类分子,肿瘤细胞高表达免疫检查点分子如PD-1,CTLA-4,抑制性细胞因子如TGF-β,或者上调调节性T细胞等。这些现象,就像对免疫系统进行了遮蔽,称之为免疫遮蔽(Immune cloaking)。
将免疫抑制基因(PD-L1、FasL、CD47、CD200、CCL21、Mfge8、H2-M3和Spi6)工程入通用型细胞,可能能够模拟免疫遮蔽,产生机体免疫系统对通用型细胞的耐受。
通用型细胞的安全风险及解决方案
-
HLA阴性通用型细胞可能完全逃避免疫系统监视
HLA表达的缺失或减少有助于肿瘤细胞逃避免疫应答。移植的HLA-阴性细胞发生恶性转化,则很难通过正常的免疫机制消除。理论上甚至有可能将完全逃避异基因识别的肿瘤细胞转移到其他个体身上。因而需要工程入自杀基因,如果这些细胞发生恶性转化,就可以将其清除掉。
-
这群细胞如果被感染,则无法通过免疫系统对其进行清除。应对方法也是工程入自杀基因。
-
自杀基因的安全性问题。
自杀系统的安全性取决于多种因素,包括特定的自杀基因、如何整合到基因组中以及治疗需要多少细胞。在大多数实现中,自杀基因,如iCasp9或编码单纯疱疹病毒胸苷激酶的基因,都是随机整合的。这可能会导致因沉默或表观遗传改变,也有可能因突变而丧失功能。
这一挑战的解决方案之一是(以纯合子方式)将单纯疱疹病毒胸苷酸激酶与细胞分裂或存活所必需的内源性基因连接,从而使从自杀开关逃脱的可能性大大降低。
细胞也可以被设计成这样一种方式,即自杀基因只能在分裂细胞中转录,从而允许选择性地消除可能发生恶性转化的细胞,同时使未分裂的细胞存活。
参考文献
-
Gornalusse, G. G. et al. HLA- E-expressing pluripotent stem cells escape allogeneic responses and lysis by NK cells. Nat. Biotechnol. 35, 765–772 (2017).
-
Robert Lanza,Engineering universal cells that evade immune detection, Nat Rev Immunol . 2019 Dec;19(12):723-733.
-
Flavell, R. A., Sanjabi, S., Wrzesinski, S. H. & Licona- Limon, P. The polarization of immune cells in the tumour environment by TGFβ. Nat. Rev.Immunol. 10, 554–567 (2010).
-
Barclay, A. N. & van den Berg, T. K. The interaction between signal regulatory protein alpha (SIRPα) and CD47: structure, function, and therapeutic target.Annu. Rev. Immunol. 32, 25–50 (2014).
-
Spranger, S. Mechanisms of tumor escape in the context of the T- cell-inflamed and the non- T-cellinflamed tumor microenvironment. Int. Immunol. 28,383–391 (2016).
扫描上面二维码在移动端打开阅读