导读:越来越多的证据支持循环肿瘤细胞(Circulating Tumor Cell,CTC)的检测在非小细胞肺癌(non-small cell lung cancer, NSCLC)中的临床相关性,而且最近的报告强调了肺癌患者的CTC具有显著异质性。一篇发表于cancers杂志上的文章旨在优化用于非小细胞肺癌(NSCLC)下游蛋白表达分析的循环肿瘤细胞(CTC)富集方法,以作为实时检测免疫检查点的工具。目前的研究表明,根据不同的免疫检查点进行CTC分析是可行的,并可能为监测接受抗PD-1药物治疗的非小细胞肺癌患者提供有价值的生物标志物。

在过去的几年里,针对细胞程序性死亡受体-1( programmed cell death-1, PD-1)或细胞程序性死亡配体-1(programmed cell death ligand-1, PD-L1)的免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)治疗是大多数NSCLC患者的标准治疗方法。然而,这个方法仅在一些患者中有明显的疗效,其获得性耐药也是常见的。来自NSCLC组织的临床前发现和证据表明,PD-L1和IDO代表了不同的、不重叠的免疫逃避途径,所以联合使用抗PD-1/PD-L1以及抗IDO抑制剂是一种具有广阔前景的治疗策略。
实体肿瘤患者外周血的循环肿瘤细胞(CTC)是一种对疾病的诊断、预后和预测极具前景的生物标志物。由于CTC的显著异质性和稀有性,其分析在技术上具有挑战性。通常,在CTC检测之前,使用不同的方法对CTC进行富集,这些方法的原理基于区分CTC和正常血细胞的特性,例如物理学特性(大小、密度、变形性、电荷等)和生物学特性(依赖标记和免疫亲和力)。虽然过去十年来引进了许多灵敏的CTC富集技术,然而,即使分析同一病人样本,不同方法的阳性率和CTC计数都是不一致的。
这篇文章的研究目的在于优化CTC分离技术,并用于NSCLC患者下游蛋白表达分析。为此,在使用具有代表性的NSCLC细胞系的尖峰实验中初步比较了各种富集方法的分析性能。测试了最常用的手动方法,即ficoll密度梯度离心法,红细胞裂解法,以及每一种方法组合使用包被有CD45抗体的磁珠进行负磁分离。还测试了两个自动化系统的效率,即基于细胞大小的过滤平台ISET和基于细胞大小和变形性的微流体系Parsortix。随后,在用抗PD-1药物治疗的NSCLC患者中,对最有效的方法的性能进行了平行评价。
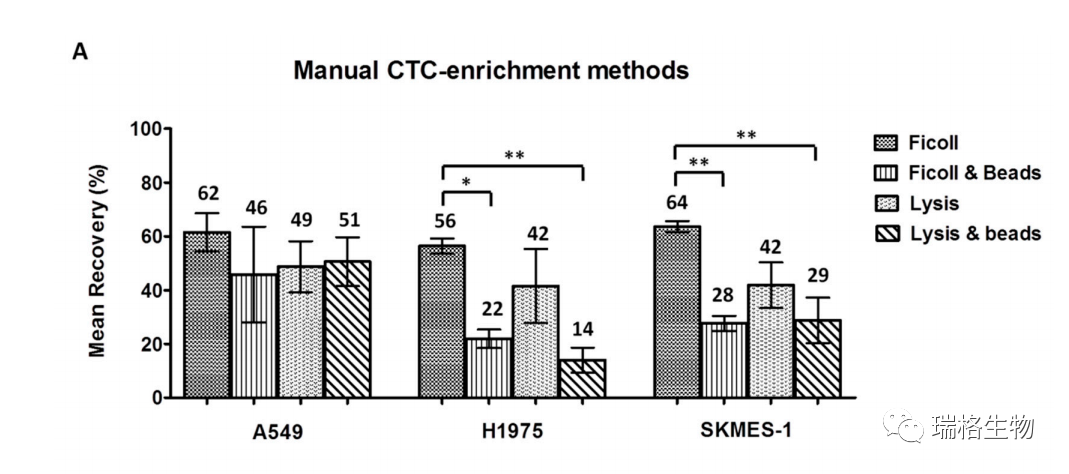
研究者采用A549、H1975和SKMES-1三种NSCLC细胞系进行了尖峰实验,比较了不同的富集方法。如上图所示,研究者用Ficoll、Ficoll/磁珠、裂解红细胞和裂解红细胞/磁珠富集后,记录了以上平均回收率(平均标准误差±SEM):a)A549细胞:62%±7%、46%±18%, 49%±10%,51%±9%;b)H1975:56%±3%,22%±3%,42%±14%和14%±5%;c)SKMES-1:64%±2%,28%±3%,42%±9%,29%±8%。单因素方差分析(ANOVA)试验显示,单独使用Ficoll对H1975和SKMES-1细胞的回收率显著高于Ficoll/Beads和裂解红细胞/Beads(Tukey多重比较试验,p<0.001)。
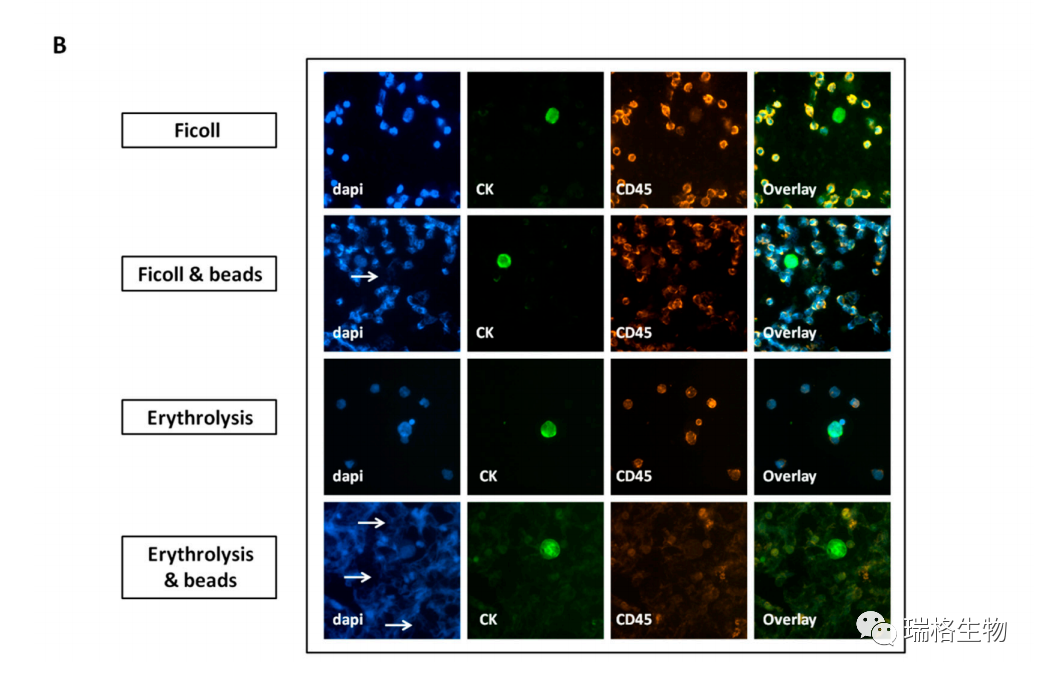
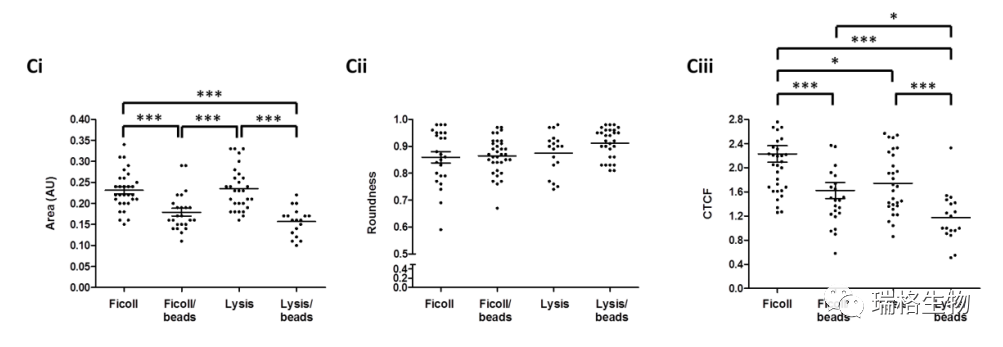
此外,无论是与Ficoll结合,还是裂解了红细胞(图2B),在磁珠分离处理的样品中观察到许多DAPI染色的碎片。根据ImageJ分析,这些样品的核面积明显减少,CD45染色强度降低(图S1CI-III)。
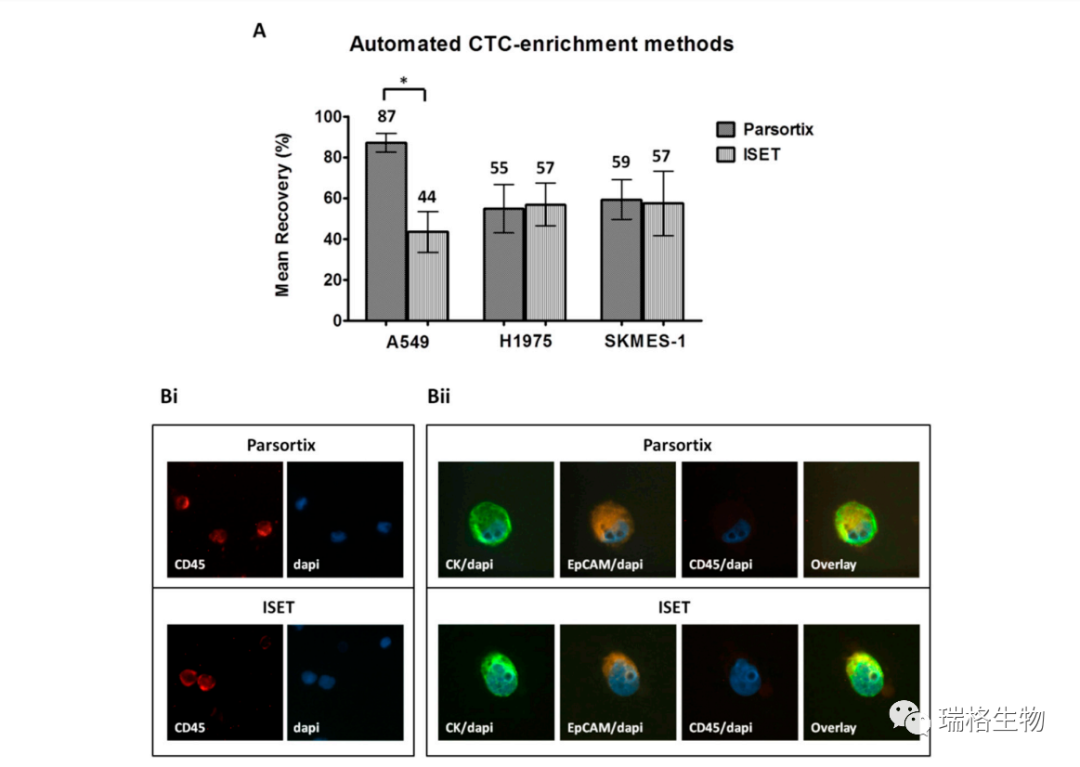
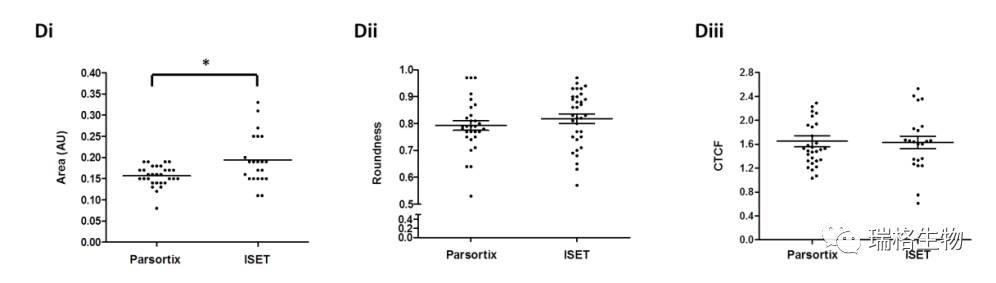
在比较自动化方法时,ISET和Parsortix系统为H1975细胞(分别为55%±12%和57%±11%)和SKMES-1细胞(分别为59%±10%和57%±16%)提供了类似的回收率(如上图A 所示)。然而,使用Parsortix对A549细胞的回收率高于ISET(87%±5%和44%±10%,双面T检验:p=0.017)。这两个系统都产生了明显正确的细胞形态和相似的免疫荧光染色强度(上图Bi,ii)。虽然ImageJ分析证实了染色强度没有差异,但它显示了ISET富集的细胞之间的核面积略有增加,但这可能是可以解释的,因为与Parsortix盒式间隙相比,ISET膜孔的尺寸更大(图S1DI-III)。
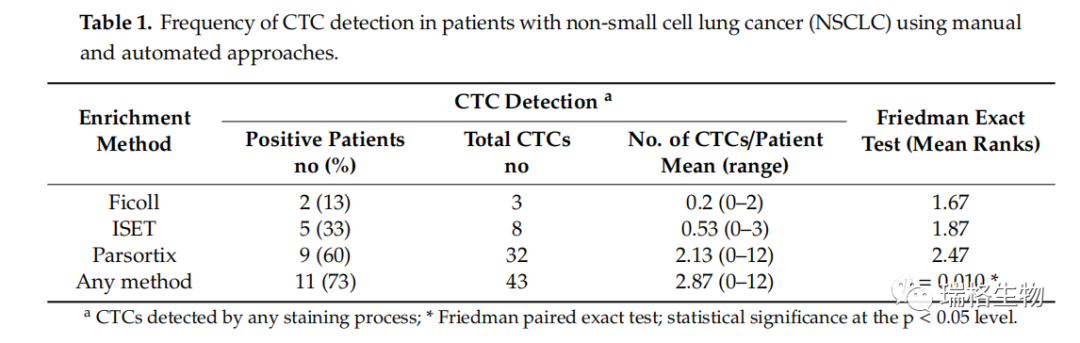
研究者用Ficoll密度梯度离心、ISET和Parsortix系统从15例NSCLC患者的外周血样本中富集CTC,并对样品进行CK/EpCAM/CD45和CK/IDO/PD-L1染色;CK和/或EpCAM的表达作为CTC阳性的鉴定标记。
如表1所示,与Ficoll和ISET相比,Parsortix提供了更高的CTC收集率(Friedman精确配对检验;p=0.010)。当不同的方法成对比较时,CTC计数用Parsortix检测比用Ficoll检测高(Wilcoxont检验;p=0.017),而Parsortix与ISET(p=0.052)或Ficoll与ISET(p=0.276)无显著性差异。
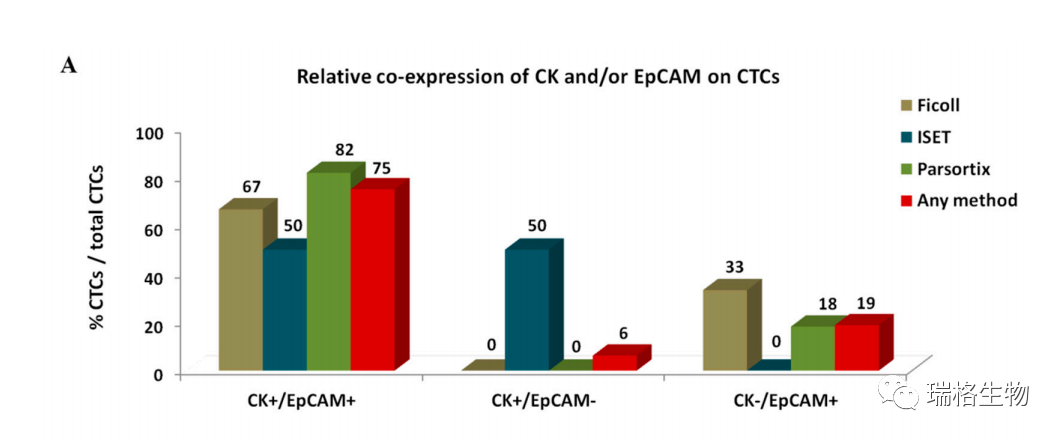
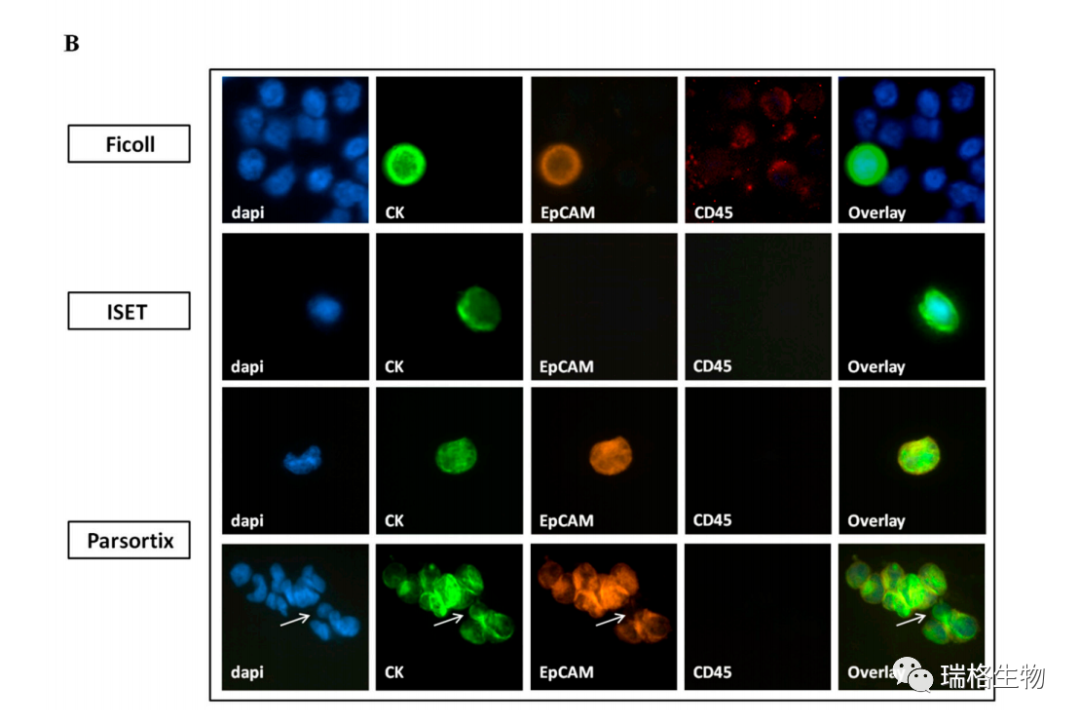
根据CK/EpCAM/CD45染色鉴定出三种不同的CTC表型;一种共同表达CK和EpCAM(CK+/EpCAM+),一种仅表达CK(CK+/EpCAM-),一种仅表达EpCAM(CK -/EpCAM+)。在任何CK+或EpCAM+细胞中均未检测到CD45的表达。有趣的是,使用不同的富集方法检测到的CTC不同表型的分布是不同的(图4A,B )。CK+/EpCAM+的CTC是最普遍的CTC群体,分别占使用Ficoll、ISET和Parsortix富集的CTC总数的67%、50%和82%(图4A,B)。相比之下,CK+/ EPCAM- 的CTC仅能在用ISET富集的方式检测到,占该系统检测CTC的50%。CK-/EpCAM+的CTC仅能在用Ficoll和Parsortix富集的方式检测到,分别占每种方法的总CTC检测的33%和18%(图4A)。
在所鉴定的单个CTC簇中检测到10个CTC,除一个具有CK+/EpCAM-表型的细胞外,其余细胞都具有CK+/EpCAM+表型(图4B)。
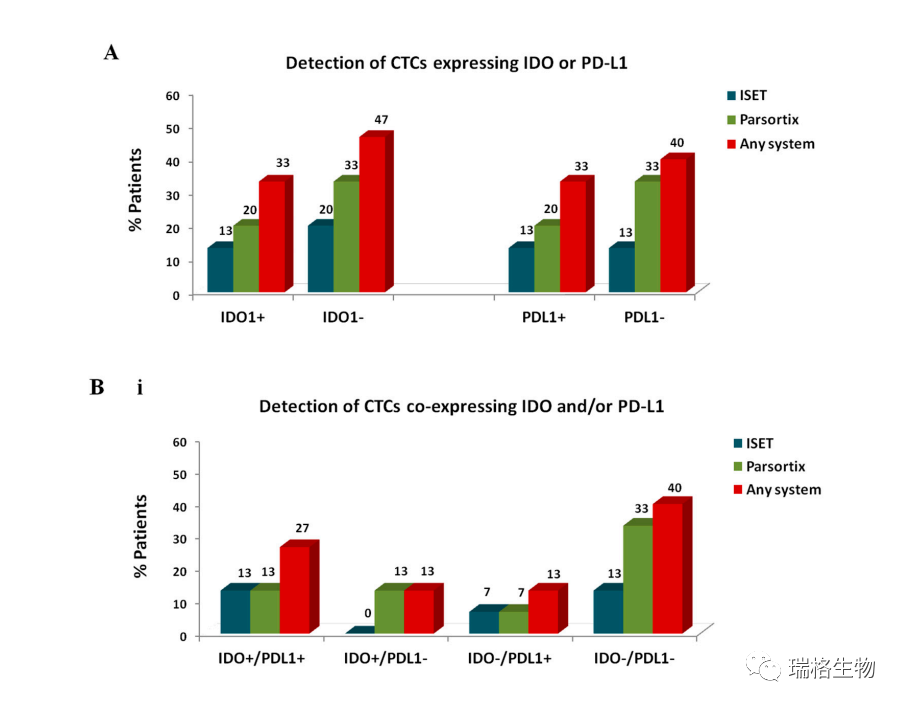
本文研究者为了研究IDO和PD-L1在CTC上的表达,对不同方法富集的样品进行CK/IDO/PD-L1染色。用此染色法在用ficoll富集的样品中未检出CTC;IDO和PD-L1在仅由ISET和Parsortix富集的CTC上表达(图5)。
如图5A所示,CTC中IDO+的患者中有13%是通过ISET富集的,20%由Parsortix富集的,33%则由两者中的一种方法所富集。
通过ISET、Parsortix和两者中任一系统分别检测到13%、20%和33%的患者的CTC阳性表达PD-L1。通过任一系统检测到PD-L1+的CTC占所有CTC的30%,且用ISET检测频率相比Parsortix高。
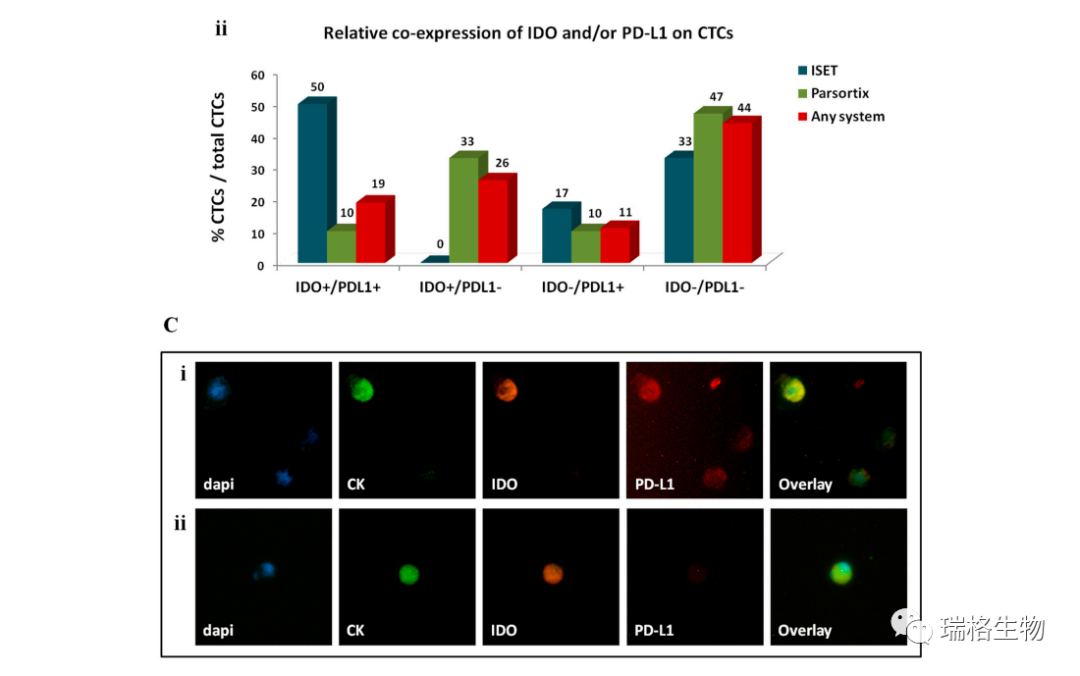
在两个自动化系统中,IDO和PD-L1在CTC上的共表达分布也不同(图5B)。通过ISET或Parsortix在13%的患者中检测到IDO+/PD-L1+ CTC;然而,在检测的人群中,用每种方法检测到的总CTC中的ISET相对百分比高于Parsortix。IDO-/PD-L1-的CTC在用Parsortix富集后最常见。值得注意的是,IDO+/PD-L1-的CTC 仅在Parsortix的富集标本中检测到。最后,图5C展示了IDO+/PD-L1+ CTC和IDO+/PD-L1- CTC的代表性图示。
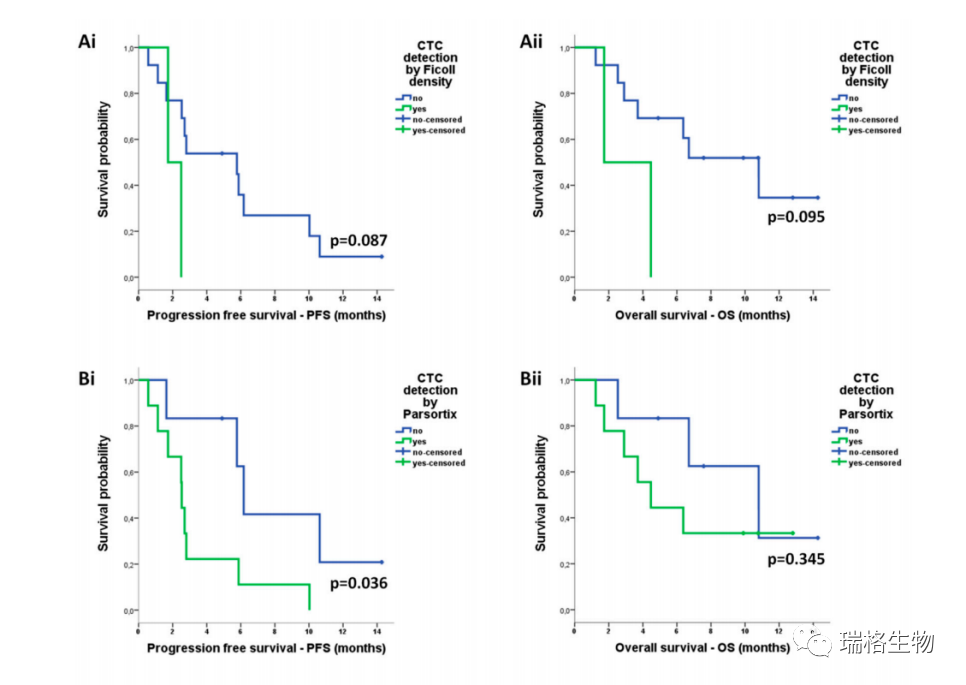
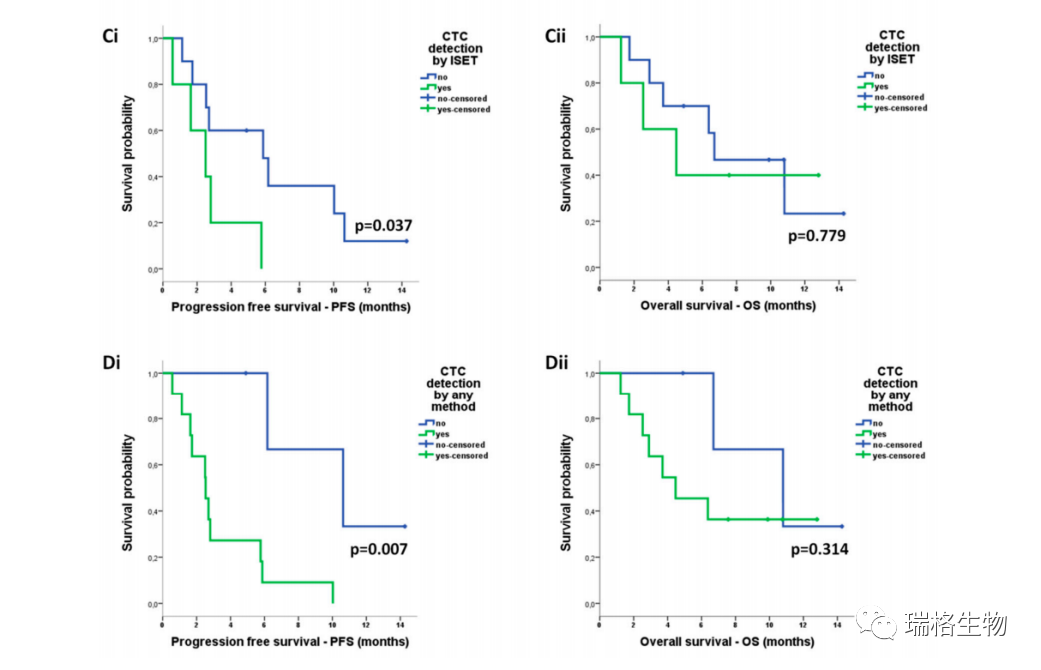
以上图A-D所展示的是用ISET、Parsortix或任一富集方法检测CTC 与PFS减少相关,以及 CTC检测与OS无关。
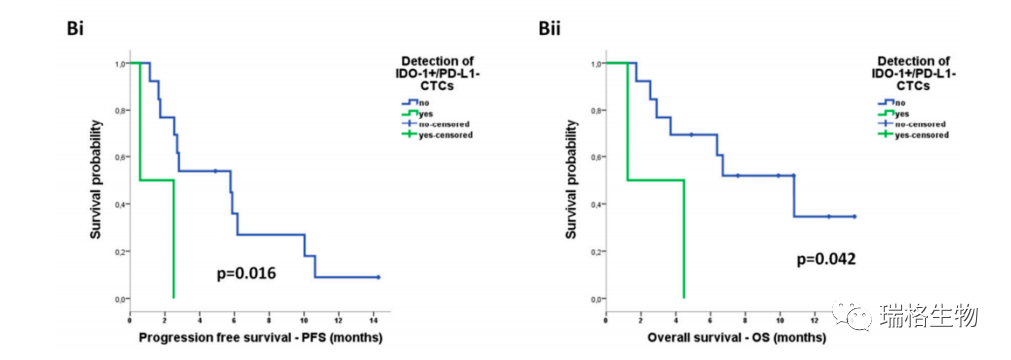

如上图所示,关于共表达表型,由Parsortix富集而检测到的IDO+/PD-L1-CTC是唯一与PFS减少以及OS减少相关的亚群体。
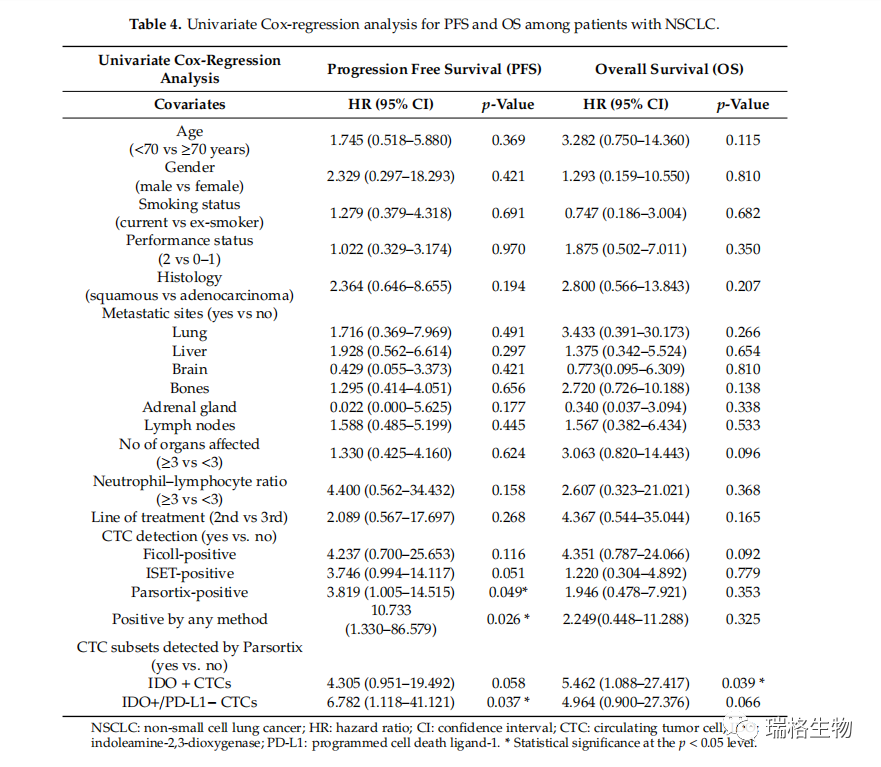
单因素Cox回归分析显示,由任一系统或Parsortix富集检测到带有CTC的患者复发风险增加,而且由Parsortix富集检测到的携带了IDO+ CTC的患者的死亡风险增加(表4)。
结论:这篇文章评估了手动和自动两种CTC富集方法在ICIs治疗的NSCLC患者中CTC的分离效率以及CTC分离的适用性,同是还在蛋白质表达水平上进行进一步的分析。此外,本文研究者还首次证明IDO在CTC上表达,即患者体内存在IDO+ CTC,特别是IDO+/PD-L1-亚型可能在用抗PD-1抑制剂处理的NSCLC患者中具有显著的预后相关性。总的来说,本研究通过单个CTC表型特征以获得更广泛的全身抗肿瘤免疫反应,提示实时CTC分析可改善不同分层患者的免疫治疗策略。

扫描上面二维码在移动端打开阅读