基于T细胞免疫检查点,PD-1/PD-L1和CTLA-4的阻断治疗在临床抗肿瘤取得了巨大的进展。然而,愈来愈多研究表明T细胞免疫疗法对抗肿瘤效果仍有限,或仅能惠及少部份患者。因此,有必要开发替代免疫疗法或联合治疗策略。
作为先天免疫第一道防线,抗病毒与抗肿瘤的NK细胞不需预先致敏就可以杀伤靶细胞,具有免疫清除和免疫监视等功能;同时NK细胞识别杀伤肿瘤的机制与T细胞相比存在差异优势。基于NK细胞的肿瘤免疫疗法逐渐受到关注,如正新兴的NK细胞治疗(CAR NK) 与通过单克隆抗体靶向NK细胞免疫检查点治疗。
由于长时间的抗原暴露和T细胞受体刺激引起严重的T细胞耗竭,常见于慢性感染和癌症中。T细胞免疫检查点治疗 (immune checkpoint therapy)即以逆转T细胞耗竭并进而增强T细胞的杀癌效应为主。然而,对于NK细胞的肿瘤”免疫耗竭(Immune exhaustion)” 则定义为:在肿瘤发生或癌症进展中,NK细胞效应功能低下的状态。NK细胞的状态往往伴随着NK细胞表面一系列活化性或抑制性受体的改变。通过对NK细胞表面受体功能与NK细胞肿瘤免疫耗竭的研究,临床前研究或临床试验的NK细胞免疫检查点治疗已登上肿瘤免疫治疗舞台。
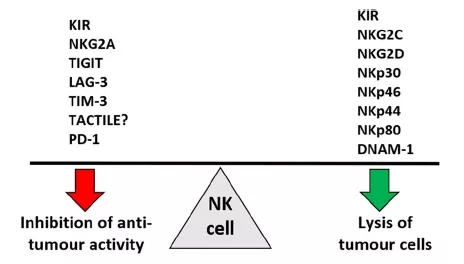
NK细胞的激活依赖于NK细胞表面表达的抑制受体和激活受体之间的平衡。主要的抑制受体(如 KIR)识别HLA Class I。一些非HLA Class I特异性抑制受体在NK细胞(如TIGIT、TIM-3、LAG-3)上高度表达。Adapted from Cancer Immunol Immunother 2020 May;69(5):879-899.
一般而言,NK细胞发挥抗病毒与抗肿瘤功能。但在肿瘤局部或癌症进程不断恶化时,NK细胞处于功能低下的免疫耗竭状态。功能低下,首先反映在NK细胞”数量”减少。在多发性骨髓瘤的小鼠模型中,NK细胞比例明显随着癌症进程减少。再者,NK细胞的杀伤功能与分泌细胞因子的能力下降。在小鼠黑色素瘤模型中,与外周血NK细胞相比,肿瘤局部的NK细胞分泌IFN-γ和GM-CSF的水平显著降低。而临床上,在不同癌症患者间,如肝癌、肺癌,也观察到患者肿瘤局部NK细胞产生IFN-γ浓度下降。而在乳腺癌、胰腺癌、胃癌及结肠癌患者的肿瘤局部,发现NK细胞表达的颗粒酶、穿孔素等具杀伤功能的分子水平也明显低于外周血NK细胞。NK细胞免疫耗竭的异常状态即为NK细胞表面受体与所在肿瘤环境及肿瘤相关细胞上的配体异常表达相互联结反应产生。
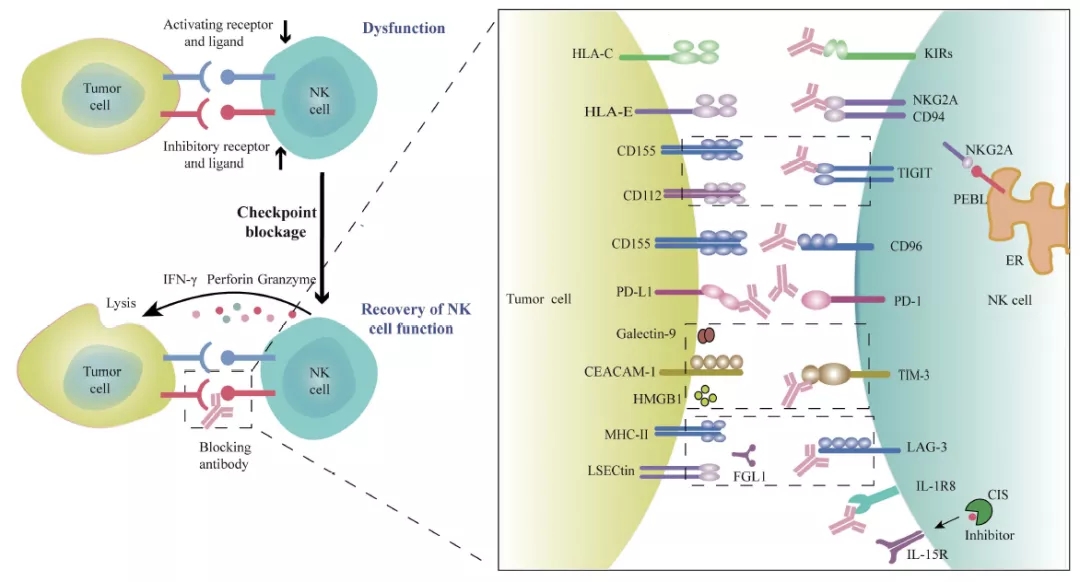
肿瘤微环境中的多种因素可导致NK细胞功能异常,表现为抑制性受体上调和肿瘤浸润性NK细胞活化受体下调,导致NK细胞衰竭。用单克隆抗体阻断这些免疫检查点受体或分子,可恢复NK细胞的抗肿瘤活性。联合使用不同的检查点抑制剂或与其他治疗药物联合使用,可以进一步提高抗肿瘤的疗效。Adapted from Front Immunol. 2020. PMID: 32714324
简言之,检查点受体与其配体之间的相互作用是NK细胞衰竭的主要原因。检查点阻断 (Checkpoint Blockade)可逆转多发性肿瘤中的NK细胞功能。常见的NK细胞受体 (亦被称为检查点受体)包括KIR、PD-1、TIM-3、LAG-3、NKG2A和TIGIT,可经由免疫抑制剂如单克隆特异性抗体,通过下调激活受体表达和上调抑制受体表达来改变抑制或激活NK细胞受体之间的平衡。因此,以NK细胞检查点为靶点的免疫治疗可实际应用于治疗实体瘤和血液系统恶性肿瘤。以下我们选择部分NK细胞检查点分子,简要了解以NK细胞检查点分子为靶点的免疫治疗。
早期恶性血液肿瘤患者获骨髓移植研究中显示,供者NK细胞KIR与患者MHC I匹配时,五年内复发率为75%;但若KIR与MHC I不匹配,复发率降为0。由此得证,KIR-MHC I的识别缺失会触发NK细胞活性;因此可通过单克隆抗体阻断KIR与 MHC I之间的识别结合,调动NK细胞抗肿瘤功能。基于KIR的阻断,目前有多项临床试验进行中,如KIR与PD-1联合阻断治疗晚期头颈癌(NCT01714739)。
NKG2A在人外周血中约50%的NK细胞和5%的CD8+T细胞上表达。在人体,NKG2A通过与配体HLA-E连接,阻止NK细胞活化,从而抑制细胞因子分泌和细胞毒性。
肿瘤浸润性NK细胞与外周血NK细胞相比表达高水平NKG2A,而HLA-E在血液瘤和实体瘤中亦表现上调。NKG2A与HLA-E的相互作用抑制了肿瘤微环境中NK细胞和部分CD8+T细胞亚群的抗肿瘤作用。肝癌患者肿瘤浸润性NK细胞表达NKG2A水平高,瘤内组织HLA-E水平高,预后差与高表达NKG2A的CD56dim NK细胞功能衰竭有关。此现象也在不同实体瘤发现,如卵巢癌、肾细胞癌、结直肠癌、乳腺癌和肺癌患者。因此,NKG2A被认为是NK细胞的主要免疫检查点。使用抗NKG2A单克隆抗体阻断NKG2A与HLA-E结合,可恢复NK细胞溶解活性;阻断NKG2A与HLA-E的相互作用可以诱导有效的抗肿瘤免疫反应。NKG2A阻断剂增强了CD8+T细胞和NK细胞介导的抗肿瘤作用。特别是联合PD-L1单抗促进了多种肿瘤的保护性抗肿瘤记忆的产生。靶向NKG2A的单抗或联合其他治疗策略,目前正在临床试验中用于恢复NK细胞和CD8+T细胞的效应功能。
TIGIT是表达在NK细胞与T细胞表面的抑制性受体。通过与配体相互作用,TIGIT抑制NK细胞杀伤功能和降低IFN-γ分泌。在肿瘤微环境中,TIGIT会诱导NK细胞进入免疫耗竭状态。结肠癌患者肿瘤局部NK细胞明显高表达TIGIT。小鼠模型中,肿瘤发生进程与NK细胞功能低下,亦与高表达TIGIT明显呈正相关。在在证明,TIGIT是NK细胞肿瘤免疫应答中的”检查点分子”。
CD96是位于NK细胞表面的一重要的抑制性受体。在肝癌患者局部肿瘤浸润的NK细胞发现高表达CD96,CD96+NK细胞呈现出功能耗竭状态,致使IFN-γ和TNF-α分泌水平降低。
TIGIT和CD96被视为在NK细胞功能效应的控制中起到互补作用。因此,TIGIT和CD96被认为是NK细胞的关键免疫检查点,阻断这些分子在肿瘤免疫治疗中显示出巨大的前景。TIGIT通常与PD-1共表达;因此,TIGIT和PD-1的联合阻断可以更有效地逆转功能衰竭,如在晚期黑色素瘤患者联合使用,表现促进NK细胞扩增和抗肿瘤免疫反应。
PD-1与配体的相互作用抑制了NK细胞的抗肿瘤能力。在结肠癌、肝癌、胃癌、食管癌、卵巢癌、头颈癌和霍奇金淋巴瘤中,PD-1+NK细胞和PD-1在NK细胞上的表达比例增加,导致细胞因子分泌受损,细胞溶解活性降低,增殖不良,甚至功能衰竭。PD-1+NK细胞水平与预后不良亦有关联。阻断PD-1/PD-L1与抗PD-1或PD-L1抗体的相互作用可以逆转PD-1+NK细胞的功能失调状态,显著增加细胞因子的产生、NK细胞的细胞毒性和体内肿瘤生长的显著抑制。因此,临床上PD-1阻断剂不仅可以释放T细胞攻击肿瘤细胞,而且可以恢复NK细胞的抗肿瘤反应。值得注意的是,通过阻断PD-1/PD-L1来增强NK细胞的抗肿瘤效果对于治疗MHCⅠ表达缺陷或显示低突变负荷的肿瘤患者更为重要,因为T细胞在MHC Ⅰ缺失环境中通常是不活跃的。事实上,大多数霍奇金淋巴瘤表达的MHCⅠ减少或阴性,但PD-L1表达上调,但患者对阻断PD-1/PD-L1的免疫治疗反应良好,表明NK细胞的抗肿瘤疗效起关键作用。
TIM-3被认为是NK细胞活化或成熟的标志物,因为TIM-3与配体galectin-9结合后能诱导IFN-γ的产生并促进NK细胞的早期成熟。然而,TIM-3的持续高表达导致NK细胞功能障碍和衰竭。TIM-3在多种实体瘤患者的外周NK细胞上高表达,与NK细胞功能障碍和衰竭相关。肿瘤浸润性NK细胞尤其表现为TIM-3表达上调,可预测肝癌、NSCLC、子宫内膜患者的预后不良。TIM-3和PD-1阻断剂联合IL-21治疗晚期MHCⅠ缺陷性肿瘤可恢复衰竭NK细胞的抗肿瘤作用。
除了异常的细胞表面受体(检查点)与NK细胞的肿瘤免疫耗竭有关,细胞因子IL-15刺激的信号通路对NK细胞的发育、存活与功能提供了关键作用。若当IL-15信号通路受阻,会导致NK细胞成熟水平降低并减低生产IFN-γ,最终也致使NK细胞免疫耗竭。
T细胞免疫检查点疗法 (如 PD-1/PD-L1和CTLA-4)在临床肿瘤治疗上,显示了免疫疗法的巨大潜力;然而仅少数恶性肿瘤患者受益。但基于此免疫检查点,可充分调动免疫系统的抗肿瘤能力,NK细胞免疫检查点疗法的加入,可大大扩增肿瘤免疫疗法的适用范围,不管是使用单克隆抗体、细胞治疗或联合治疗。因此对于癌症的治愈,未来可期。
参考文献:
1. Targeting NK Cell Checkpoint Receptors or Molecules for Cancer Immunotherapy. Zhang C, et al. Front Immunol. 2020. PMID: 32714324
2. Current progress in NK cell biology and NK cell-based cancer immunotherapy. Tarazona R, et al. Cancer Immunol Immunother. 2020. PMID: 32130453
3. NK细胞耗竭与卡控点免疫治疗. 中国免疫学杂志2019年 第35卷. Doi:10.3969/j.issn.1000-484X.2019.02.001
扫描上面二维码在移动端打开阅读