#1
调节性T细胞
Foxp3+CD4+调节性T(Treg)细胞约占T细胞的5-7%,在预防自身免疫疾病和维持免疫稳态中起核心作用,但同时也是抗肿瘤免疫的主要障碍。
Treg细胞的主要特征是组成性高表达CD25(IL-2受体α链),和β和γ链形成高亲和力的IL-2受体,此外还表达抑制分子CTLA-4。
CTLA-4是一个关键Treg抑制性分子,在后期,CTLA-4水平逐渐降低,其他抑制分子如LAG3和IL-10增加来填补。
Treg细胞还利用多种抑制分子发挥抑制作用,包括IL-10、TGF-β,IL-35、TIGIT、CD39和CD73,也是抑制自身免疫重要力量。
#2
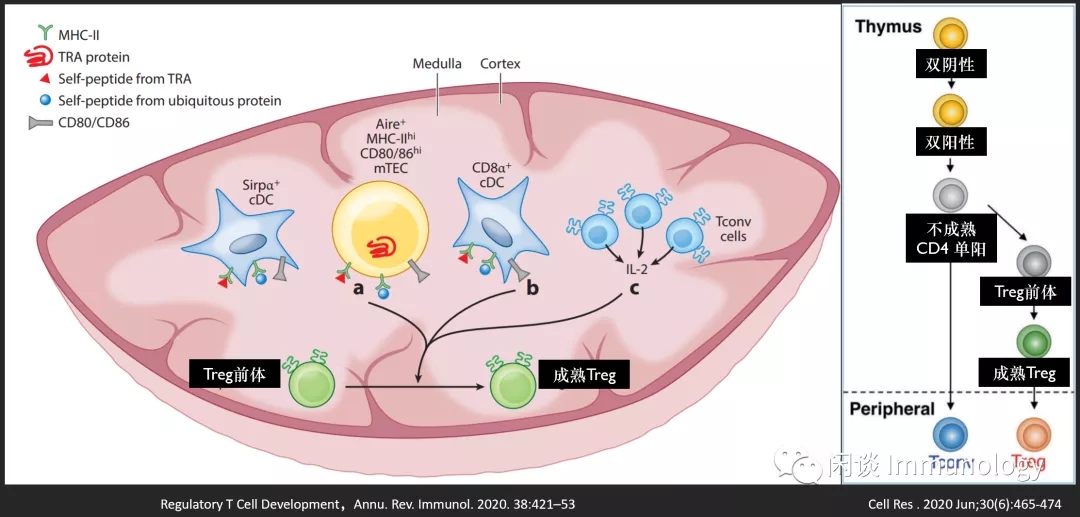
调节性T细胞发育
对Treg细胞发育的早期研究表明,出生两天,Foxp3+CD4+细胞出现在胸腺中,在第三天出现在外周。
备注:TRA: tissue-restricted antigens, 组织限制性抗原; mTECs:medullary thymic epithelial cells, 髓质胸腺上皮细胞
很多研究工作集中在确定Treg细胞分化启动和完全执行的胸腺区域。
这些信号是如何传递的,以及它们是否必须按一定的顺序,仍然是一个热门研究领域。阳性选择的胸腺细胞进入髓质,在那里他们遇到一组APC递呈的自身pMHC-II配体和辅助信号。
#3
MHC-II自身抗原--Treg自身耐受的形成
#4
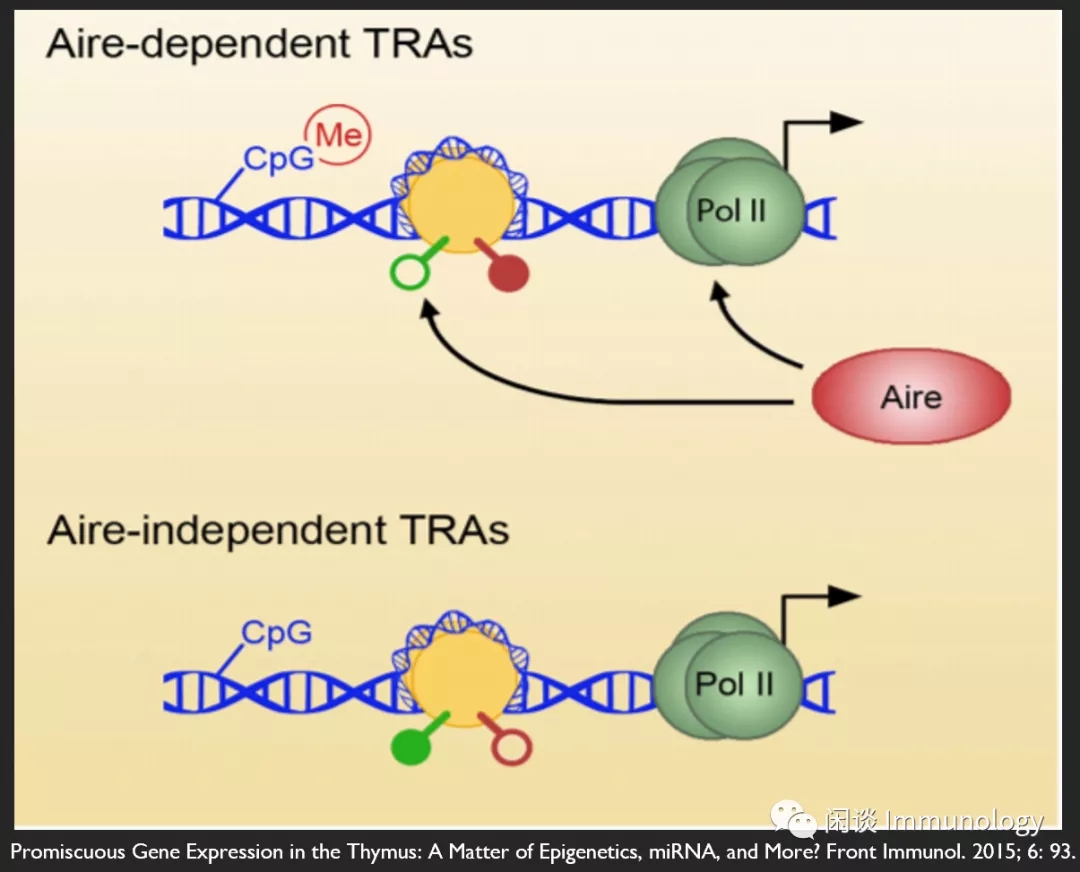
寻求稳定性:Treg细胞表观遗传程序
-
Fontenot JD, Gavin MA, Rudensky AY. 2003. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat. Immunol. 4:330–36
-
Hori S, Nomura T, Sakaguchi S. 2003. Control of regulatory T cell development by the transcription factor Foxp3. Science 299:1057–61
-
Fontenot JD, Rasmussen JP,Williams LM, Dooley JL, Farr AG, Rudensky AY. 2005. Regulatory T cell lineage specification by the forkhead transcription factor Foxp3. Immunity 22:329–41
-
Peter A. Savage, David E.J. Klawon, and Christine H. Miller. Regulatory T Cell Development,Annu. Rev. Immunol. 2020. 38:421–53
-
Hanahan D. 1998. Peripheral-antigen-expressing cells in thymic medulla: factors in self-tolerance and autoimmunity. Curr. Opin. Immunol. 10:656–62
-
Ohkura N, Hamaguchi M, Morikawa H, Sugimura K,Tanaka A, et al. 2012.T cell receptor stimulation induced epigenetic changes and Foxp3 expression are independent and complementary events required for Treg cell development. Immunity 37:785–99
-
Zheng Y, Josefowicz S, Chaudhry A, Peng XP, Forbush K, Rudensky AY. 2010. Role of conserved noncoding DNA elements in the Foxp3 gene in regulatory T-cell fate. Nature 463:808–12
-
Naganari Ohkura et al, Transcriptional and epigenetic basis of Treg cell development and function: its genetic anomalies or variations in autoimmune diseases Cell Res . 2020 Jun;30(6):465-474
-
Olga Ucar, and Kristin Rattay,Promiscuous Gene Expression in the Thymus: A Matter of Epigenetics, miRNA, and More? Front Immunol. 2015; 6: 93.
扫描上面二维码在移动端打开阅读