-
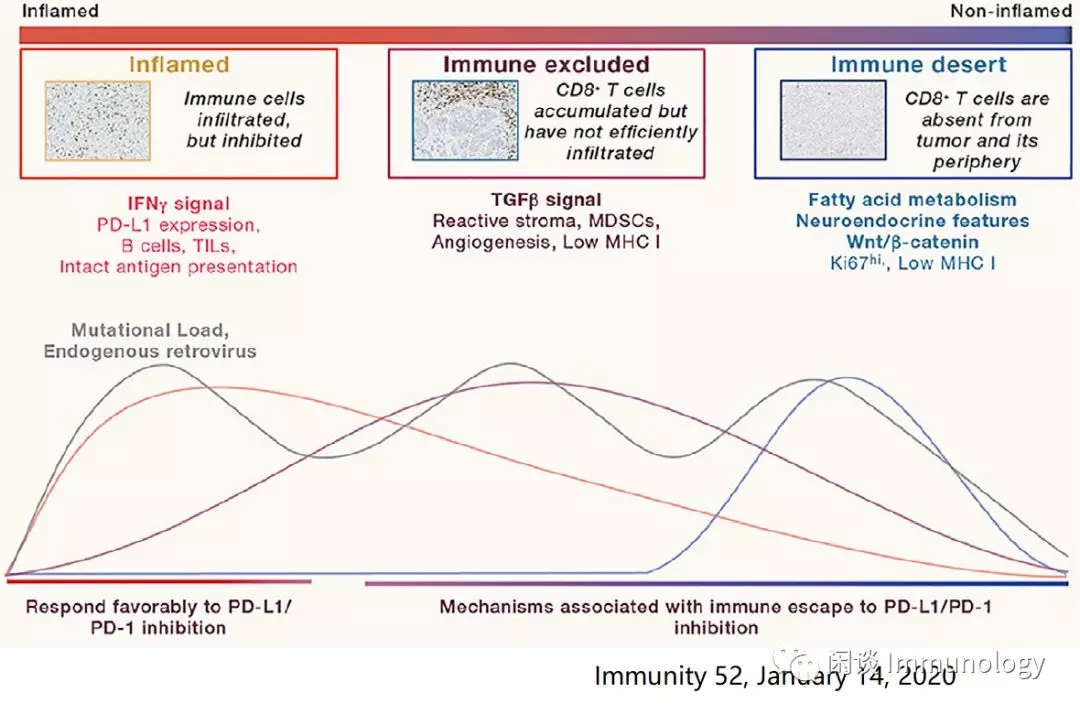
免疫炎症型(inflamed):肿瘤周围有免疫细胞浸润
-
免疫排除型(Immune exclued):肿瘤微环境排除肿瘤浸润淋巴细胞TILs
-
免疫沙漠型(Immune desert):免疫细胞远离肿瘤细胞,微环境基本无免疫细胞。
免疫排除型肿瘤
3#
免疫沙漠型肿瘤
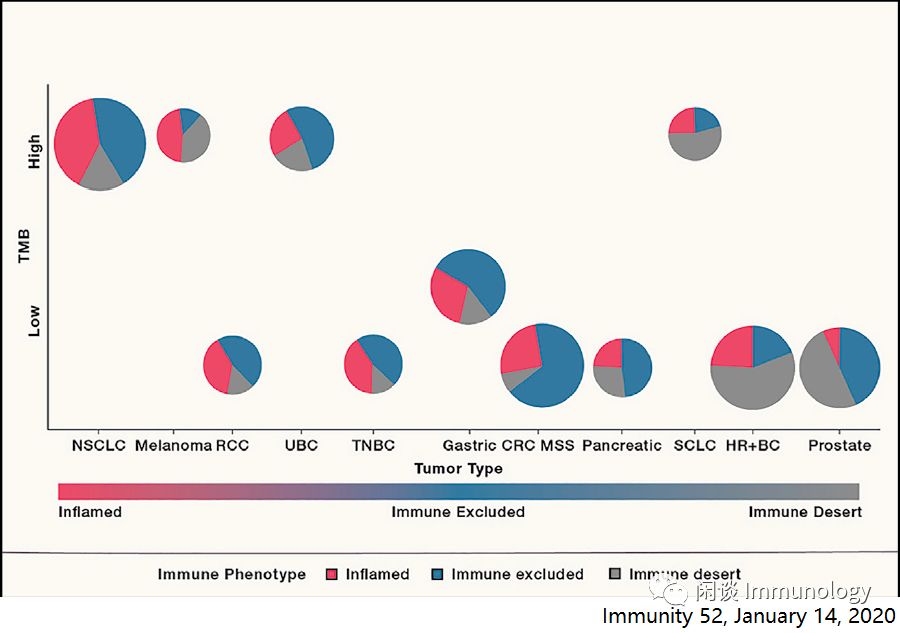
上述炎症型、免疫豁免型和免疫沙漠型,在特定的肿瘤类型和不同的癌症中,不同程度上普遍存在。
-
Hegde, P.S., Karanikas, V., and Evers, S. (2016). The Where, theWhen, and the How of Immune Monitoring for Cancer Immunotherapies in the Era of Checkpoint Inhibition. Clin. Cancer Res. 22, 1865–1874.
-
Marabelle, A., J.A., Miller, A., et al.(2019). Association of tumor mutational burden with outcomes in patients with select advanced solid tumors treated with pembrolizumab in KEYNOTE-158. ESMO 2019 Congress. Ann. Oncol. 30, v475–v532.
-
Mariathasan, S, et al. (2018). TGFb attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells. Nature 554, 544–548.
-
McDermott, D.F, et al. (2018). Clinical activity and molecular correlates of response to atezolizumab alone or in combination with bevacizumab versus sunitinib in renal cell carcinoma. Nat. Med. 24,749–757.
-
Top 10 Challenges in Cancer Immunotherapy,Priti S. Hegde and Daniel S. Chen,Immunity 52, January 14, 2020
-
McDermott, D.Fet al. (2018). Clinical activity and molecular correlates of response to atezolizumab alone or in combination with bevacizumab versus sunitinib in renal cell carcinoma. Nat. Med. 24,749–757.
扫描上面二维码在移动端打开阅读