当地时间8月26日,罗氏旗下Foundation Medicine公司宣布美国FDA批准了其泛癌液体活检产品FoundationOne Liquid CDx(F1LCDx)上市,用于多种伴随诊断适应症,包括一种前列腺癌和三种非小细胞肺癌。这是FDA批准的第二款基于NGS的液体活检伴随诊断大panel产品。F1LCDx将于当地时间8月28日在市场上出售。
本月,肿瘤NGS液体活检领域接连迎来喜讯。当地时间8月7日,FDA批准了Guardant Health公司开发的液体活检Guardant 360 CDx用于所有实体瘤类型的综合基因组分析,这也也是FDA批准的首个将NGS和液体活检技术结合在一起用于指导治疗决策的诊断检测产品。此外,FDA还批准Guardant 360 CDx作为伴随诊断,用于识别携带表皮生长因子受体(EGFR)基因突变的转移性非小细胞肺癌(NSCLC)患者,以帮助确定可以从Tagrisso ®(osimertinib)治疗中获益的患者。FDA设备与放射健康中心体外诊断与放射健康办公室主任Tim Stenzel博士当时表示:“液体活检以及NGS技术伴随诊断的批准标志着突变检测的新时代。”
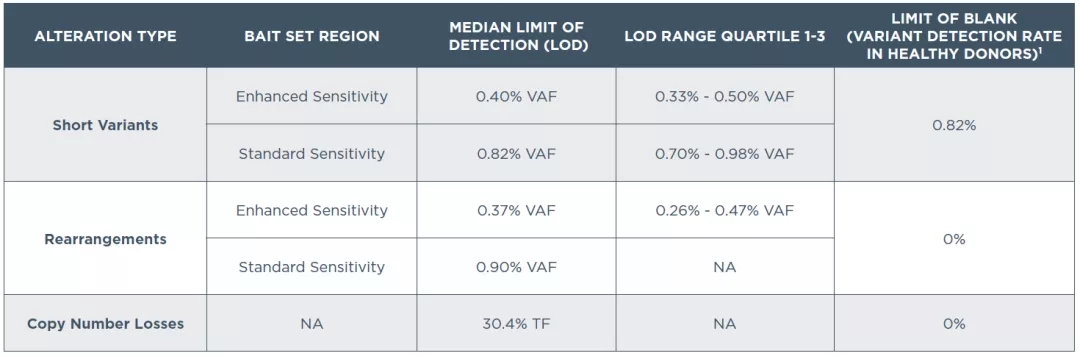
据悉,本次FDA批准的第二款NGS液体活检伴随诊断产品F1LCDx,是基于该产品对包含30多种癌症类型的超过7500个样本的临床验证研究。该研究进行了30000多个独特变异分析,并使用跨越多种癌症类型的不同验证方法对该产品进行评估。结果表明,即使对于临床血液样本中经常观察到的低等位基因频率,该检测也显示出高灵敏度和高特异性。
来源:Foundation Medicine
F1LCDx是一种基于NGS的泛实体瘤定性体外诊断(IVD)检测,使用基于高通量杂交靶向捕获技术,可利用晚期癌症患者外周血中的循环游离DNA(cfDNA)分析324个基因的变异信息,报告311个基因的SNVs/Indels及BRCA1/2的重排和拷贝数丢失。同时,还可检测免疫治疗相关的生物标志物微卫星不稳定性(bMSI)和血液肿瘤突变负荷(bTMB)以及单基因改变,包括所有NTRK融合,作为多个靶向药物的伴随诊断。F1LCDx检测可在收到样本2周内提供一份综合结果报告,除报告与FDA批准的疗法相匹配的基因组变异信息外,还可提供相关临床试验信息,以及根据肿瘤学专业指南为任何实体瘤患者提供的解释性内容。
F1LCDx的具体用途包括:
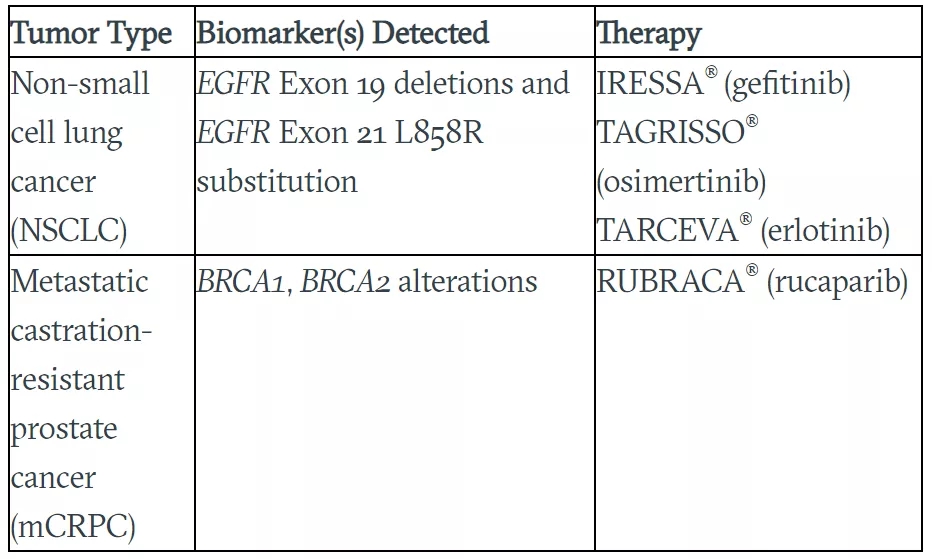
·作为伴随诊断,确定可能从FDA批准的特定靶向疗法中获益的患者,包括为PARP抑制剂Rubraca(Rucaparib)筛选携带BRCA1/2基因突变的转移性去势抵抗性前列腺癌患者,以及使用EGFR酪氨酸激酶抑制剂(TKI)(吉非替尼、奥西替尼和厄洛替尼)进行一线治疗的三种非小细胞肺癌患者;
·作为一款全基因组图谱分析(CGP),报告基因组改变结果(包括bTMB、bMSI和单基因变异),为任何实体瘤患者的护理提供指导。
来源:Foundation Medicine
此外,Foundation Medicine方面提示,该检测可能会报告其他基因组发现,但对于任何特定治疗产品的使用而言,并非是规定性或决定性的。使用该检测不能保证患者会与治疗方法相匹配。阴性检测结果并不排除存在后续更改的情况。伴随诊断检测突变阴性的患者应进行肿瘤组织检测,并使用FDA批准的肿瘤组织检测确认突变状态。
来源:Foundation Medicine
Foundation Medicine首席医学官Brian Alexander博士认为:“ 我们相信癌症患者及其医生应获得最高质量的基因组检测结果,以做出有关个性化治疗的明智决定。凭借我们的科学专业知识和开拓精神,F1LCDx通过提出多种FDA批准的全面基因组分析(CGP)方案,进一步强调了对所有癌症类型患者护理的承诺,这些方案对于高质量的癌症护理越来越重要。我们正在寻求F1LCDx的其他伴随诊断适应症,如果获得批准,将进一步提高该检测在临床实践中的效用。此外,该检测为加速药物开发和了解耐药机制提供了重要工具。”
美国Huntsman癌症研究所泌尿生殖肿瘤学项目主任Neeraj Agarwal教授表示:“从临床角度来看,我认为医生应该与每个转移性前列腺癌患者讨论肿瘤基因组分析,以告知其适合使用的靶向和免疫疗法。这项批准的意义在于,当进行组织样本检测可能具有挑战性时,可进行基于血液的基因组检测,进行治疗指导。”
LUNGevity基金会总裁兼首席执行官Andrea Ferris表示: “ 所有癌症患者都应该获得高质量的基因组检测,以了解肿瘤的驱动因素,从而有助于制定个性化的治疗决策。 对于许多患者来说,由于肿瘤位置或患者的健康状况,无法进行组织活检,或者患者可能不愿意进行额外的手术。基于血液的生物标志物检测,可以帮助扩大晚期癌症患者获得这些可行的基因组见解的机会。”
AdventHealth癌症研究所执行主任、医学肿瘤学家Mark Socinski博士表示:“液体活检正变得越来越重要,它可以为需要进行微创基因组检测的某些晚期癌症患者的医生提供个性化的治疗决策。该批准有助于扩大医生对所需重要基因组信息的访问,从而为患者的靶向治疗做出更明智的决定。这是使全面基因组检测成为常规临床癌症治疗一部分的又一重要步骤。”
参考资料:
1.FDA Approves Foundation Medicine's FoundationOne®Liquid CDx, a Comprehensive Pan-Tumor Liquid Biopsy Test with Multiple Companion Diagnostic Indications for Patients with Advanced Cancer
https://www.foundationmedicine.com/press-releases/445c1f9e-6cbb-488b-84ad-5f133612b721
2.Foundation Medicine Liquid Biopsy Gets FDA Approval for Multiple Companion Diagnostic Indications
https://www.genomeweb.com/cancer/foundation-medicine-liquid-biopsy-gets-fda-approval-multiple-companion-diagnostic-indications

扫描上面二维码在移动端打开阅读