在过去几年中取得了很大的临床进展,特别是在过继细胞转移治疗和免疫检查点阻断(ICB)的应用领域。靶向PD1/PDL1的ICB疗法已被批准用于多种不同的实体肿瘤治疗,并于2018年获得诺贝尔生理学或医学奖。
然而,抗PD1/PDL1治疗的临床数据显示其应答率有限。大量患者遭受原发耐药,对PD1/PDL1治疗没有应答,一些应答者在最初反应后也出现了获得性耐药。目前,潜在的耐药机制在很大程度上仍然不为人知。
近期发表在Front. Cell Dev. Biol的发表在“Resistance Mechanisms of Anti-PD1/PDL1 Therapy in Solid Tumors”很好的总结了目前关于PD1 / PDL1治疗的原发性和获得性耐药可能的机制以及改善PD1 / PDL1治疗耐药性的策略的进展。

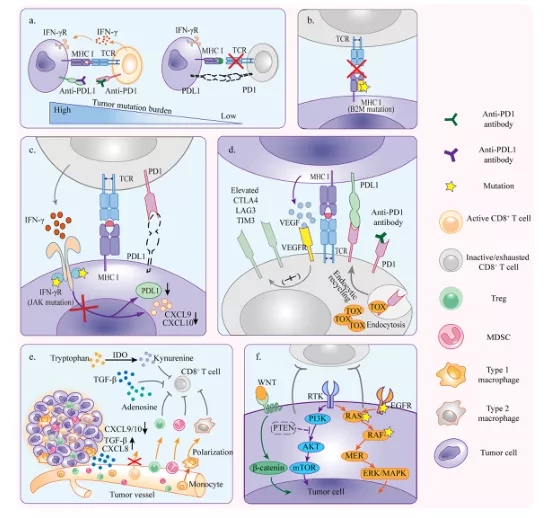
在PD1/PDL1治疗中,肿瘤可以通过形成肿瘤微环境(TME)来阻碍T细胞的抗肿瘤效果。这可能是由于抗原免疫原性不足、抗原提呈功能障碍、不可逆的T细胞耗竭、IFN-γ信号的抵抗和免疫抑制所致(图1)。
图1. 原发性耐药机制
1.1. 肿瘤免疫原性不足
与无反应者相比,对PD1疗法敏感的人含有更多非同义单核苷酸变异,并且检测到更高的HLA I类和II类新表位负荷。根据这些证据,我们可以推测,突变负荷高的肿瘤产生更多具有足够免疫原性的新抗原的可能性更高,能够诱导抗原特异性T细胞反应。基于CD8+T细胞在突变负荷较高的肿瘤中浸润较高的证据,新抗原被认为与抗肿瘤免疫特别相关。此外,错配修复基因缺陷的癌症会产生新抗原的突变,使它们对抗PD1治疗敏感。相反,突变负荷低的肿瘤,如前列腺癌和胰腺癌,由于缺乏免疫原性新抗原,更有可能对治疗无效。
在TME中,抗原提呈主要通过MHC-I类途径进行,因此肿瘤可以通过失活的MHC-I类复合物来逃避T细胞的杀伤。B2M对于HLA I类复合物的组装和稳定是必不可少的。假设由于B2M突变导致HLA-I类分子功能障碍,导致抗原提呈功能障碍,使得T细胞杀伤活性减弱。事实上,一项对肿瘤组织的研究表明,具有微卫星不稳定性(MSI)的大肠癌中经常存在B2M突变,这表明在治疗前的MSI-H大肠癌中存在B2M突变。此外,更直接的证据显示,与接受PD1阻断治疗的一组黑色素瘤患者中的应答者相比,无应答者B2M位点杂合性丢失的发生率高出3倍。在CTLA4疗法中也观察到类似的现象。总之,肿瘤可能通过B2M突变干扰MHC-I类功能来抵抗PD1/PDL1免疫治疗。
由于肿瘤抗原和免疫抑制TME的长期存在,T细胞耗竭被视为一种功能失调状态。由于PD1/PDL1疗法通过重塑受损的细胞毒性T细胞起作用,因此不可逆T细胞耗竭可能使得PD1/PDL1疗法耐药。耗竭的CD8+T细胞表达多种抑制性受体,包括PD1、TIM3、LAG3和 CTLA-4。由于PD1/PDL1抗体只能克服TME中的部分抑制性信号,但TME中有更多的抑制T细胞功能的抑制受体。例如,对非小细胞肺癌患者组织的分析阐明,TIM3在T细胞表面上调,导致抗PD1耐药性。此外,大量肿瘤来源的VEGF诱导CD8+T细胞表面PD1、CTLA4、TIM3和LAG3的高水平表达。T细胞表面PD1的表达量也会影响抗PD1治疗的效果。非小细胞肺癌患者中高水平表达PD1和多种抑制受体的T细胞在抗PD1治疗后功能恢复较差。严重耗竭的CD8+T细胞即使表达高水平PD1的但对PD1疗法依然没有反应.
由T细胞产生的IFN-γ通过IFN-γ受体作用于肿瘤抗原识别信号,从而通过诱导JAK1/2的激活以及信号转导和转录激活因子(STAT)的磷酸化而导致IFN-γ刺激基因的表达。大多数受刺激的基因有利于抗肿瘤免疫,而其他如CD274(编码PDL1)会导致肿瘤特异性T细胞失活。JAK1/2突变干扰IFN-γ信号转导,导致PDL1表达减少。尽管高肿瘤突变负荷(TMB)通常被认为是有效的抗PD1/PDL1治疗的标志,但一些研究表明,在一些高突变的肿瘤中,PD1/PDL1阻断的耐药性可能与JAK1/2突变有关。研究人员分析了黑色素瘤和结肠癌患者的样本,这些患者被测试具有高TMB,但对PD1阻断治疗没有反应。他们发现,这些患者存在JAK1/2纯合子功能丧失突变,这导致即使在IFN-γ存在的情况下,PDL1的表达也不足,使得阻断PD1和PDL1的相互作用是无效的。此外,JAK1/2控制趋化因子(如CXCL9、CXCL10和CXCL11) 的表达,这些趋化因子可以有效地吸引T细胞。因此,JAK1功能缺失突变的肿瘤缺乏T细胞浸润是合理的。
肿瘤细胞微环境包括免疫抑制细胞(Tregs, MDSCs, TAMs),细胞因子和肿瘤代谢产物均可以抑制抗肿瘤的功效。
关于免疫抑制细胞,请参考之前的文章“肿瘤免疫知多少:了解肿瘤微环境中的免疫细胞及其相关免疫疗法”,这里就不在赘述。
细胞因子是TME中的关键调节器,介导免疫细胞的募集和极化。例如,TGF -β通过诱导肿瘤细胞的上皮-间质转化、招募免疫抑制细胞如Treg和MDSCs以及抑制CD8+T细胞的功能来促进肿瘤进展。研究发现,TGF -β与不良的临床结果相关,并限制了尿路上皮和结直肠癌T细胞排斥的抗PDL1治疗的反应。肿瘤衍生的趋化因子向TME招募免疫抑制细胞,包括Tregs、巨噬细胞和MDSCs,以创建一个免疫抑制但支持肿瘤的环境,干扰针对获得性免疫耐药的免疫治疗。肿瘤中高表达的CXCL8招募了MDSCs或M2样TAM,从而破坏了抗PD1的疗效。此外,肿瘤衍生的趋化因子不仅可以调节抑制性细胞的募集,还可以防止T细胞的浸润。
吲哚胺2,3-双加氧酶(IDO)催化色氨酸(Trp)分解代谢生成犬尿氨酸(KYN)。在TME中,IDO通过抑制T细胞的功能,同时促进Tregs和MDSCs的生成和激活,创造了一种免疫抑制的氛围。Epacadostat是一种高选择性的IDO1口服抑制剂,能促进效应T细胞和NK细胞的增殖,增加CD86高树突状细胞的激活。基于在第1/2阶段研究中获得的令人鼓舞的结果,开始了几个第2阶段和第3阶段试验,以确定Epacadostat和Pembrolizumab的联合疗效。然而,在晚期黑色素瘤患者中,3期研究的结果令人失望,与单独使用Pembrolizumab相比,联合用药在PFS或OS方面没有改善。在最近的一篇综述中,对此负面结果提出了几种解释,包括由于抑制剂本身或临床剂量可能对IDO1抑制不足,以及患者选择不充分。
作为缺氧的结果,腺苷能途径在肿瘤内被激活,并诱导细胞外腺苷蓄积。CD39和CD73是将ATP转化为腺苷的两种重要酶。多余的胞外腺苷已被确定为抗肿瘤活性的抑制剂,它直接与T细胞表面的A2A受体结合,或有利于免疫细胞向免疫抑制表型的极化。临床前研究一直表明,当将抗PD1/PDL1治疗与A2A受体拮抗剂治疗相结合时,抗PD1的效果有所增强。
研究表明,癌基因信号在免疫抑制剂TME的形成和促进肿瘤免疫逃逸中起着关键作用。肿瘤内源性致癌途径在PD1/PDL1耐药中的作用不容忽视。EGFR是非小细胞肺癌的重要分子表型。研究发现,EGFR突变率与PDL1表达呈负相关。EGFR和ALK突变的患者在接受抗PD1/PDL1治疗时的应答率较低。
据报道,具有KRAS突变的NSCLC患者对抗PD1/PDL1治疗更敏感。其机制是KRAS突变促进了CD8+T细胞的浸润,增加了TMB和肿瘤的免疫原性。然而,另一项研究发现,肿瘤中的KRAS突变可以通过抑制IRF2的表达而导致抗PD1耐药。
部分患者在PD1/PDL1治疗起效后最终会出现耐药或复发。宿主免疫系统有时是治疗抵抗的帮凶。在抗PD1/PDL1治疗过程中,通过肿瘤免疫编辑,能够逃脱抗肿瘤免疫的肿瘤细胞逐渐占据主导地位。此外,在PD1/PDL1抑制剂存在的情况下,激活PD1/PDL1非依赖的抑制通路和重新耗竭活化的T细胞可以再次使T细胞的功能失效(图2)。
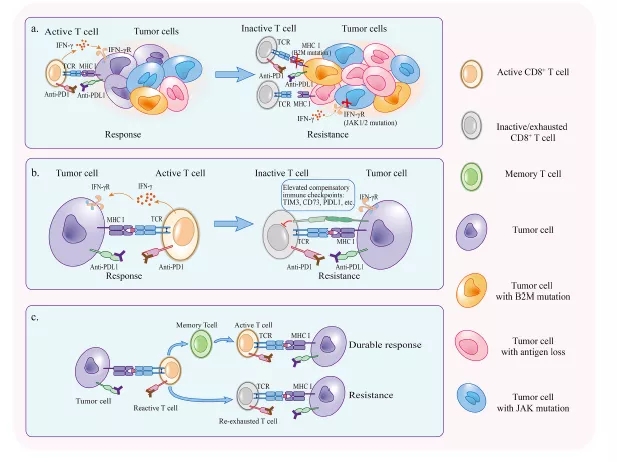
免疫编辑的概念表明,抗PD1/PDL1治疗增强的免疫不仅保护宿主免受肿瘤进展,而且还能够选择逃脱抗肿瘤免疫的肿瘤亚克隆,这最终导致抗PD1/PDL1治疗的获得性耐药性。在产生IFN-γ的抗原特异性CTL存在的情况下,观察到肿瘤细胞中由于DNA拷贝数改变而导致的抗原丢失,这表明在肿瘤特异性免疫的压力下新抗原的基因变化。非同义突变产生的新抗原在诱导瘤内T细胞反应中起重要作用。引起新抗原丢失的免疫编辑可能导致获得性抗PD1/PDL1耐药。对来自产生获得性耐药的患者治疗前后肿瘤组织的分析证实,在具有获得性耐药的肿瘤中检测到7至18个突变相关新抗原丢失。进一步的研究发现,消除的新抗原能够在自体T细胞培养中诱导克隆性T细胞增殖,这表明T细胞依赖的免疫选择发生在PD1/PDL1阻断的压力下。
虽然在免疫前治疗样本中观察到了B2M突变,并在一定程度上导致了抗PD1/PDL1治疗的主要耐药机制,但更多的证据表明,包括黑色素瘤、大肠癌和肺癌在内的肿瘤在治疗过程中发生了B2M突变,因此对PD1/PDL1阻断具有抵抗力。
针对PD1或PDL1的免疫治疗只能阻断许多免疫检查点中的一个,但仍有可能通过激活额外的抑制信号或上调PDL1的表达来逃避免疫消除。在临床前和临床研究中,在治疗后的TIL上检测到TIM3的上调,随后导致PD1/PDL1阻断的获得性耐药性。此外,发现对抗PD1/PDL1治疗产生耐药性的肿瘤伴有CD73表达上调或血清犬尿氨酸/色氨酸比值升高,表明获得性耐药机制中存在代谢变化,限制了PD1/PDL1疗效的持续性。
在发挥效力和清除抗原之后,一小群效应T细胞转化为记忆细胞,当再次遇到肿瘤抗原时,记忆T细胞将被重新激活和扩张。在PD1治疗期间,观察到应答者中效应记忆T细胞显著增加。如果抗原的高水平表达保持不变,而PD1/PDL1阻断所激活的耗竭的T细胞不能成为记忆T细胞,那么治疗后恢复活力的持久性将受到限制。
尽管抗PD1/PDL1治疗取得了很大的成功,但大多数实体瘤患者仍然存在原发和获得性耐药。迫切需要生物标志物来指导治疗方案的选择,从而减轻患者的经济负担,提高患者的生存率。根据对PD1/PDL1阻断的潜在机制的理解,潜在的生物标志物基本基本上包括那些显示免疫原性抗原态势和既存的免疫环境。
考虑到适应性免疫激活是阻断PD1/PDL1的基础,需要良好的抗原识别。与TMB和MSI密切相关的新抗原的免疫原性可能会影响抗原识别。高TMB和MSI涉及新抗原总数的增加,这些新抗原可能会产生更多的免疫原性新抗原,从而诱导强烈的免疫反应。因此反映肿瘤突变频率的TMB已被用作临床环境中的指标;2017 年 5 月 24 日,美国 FDA 批准 PD-1 抑制剂帕博利珠单抗治疗带有微卫星高度不稳定(MSI-H)/错配修复缺陷(dMMR)的实体瘤患者,瘤种覆盖结直肠、小细胞肺癌、宫颈癌等 15 个不同部位的恶性肿 瘤。这是FDA批准的首款不依照肿瘤来源,而是依照生物标志物进行区分的抗肿瘤疗法,代表精准医学的一个里程碑,也标志着人类对癌症的认识水平抵达了一个新阶段。然而,与突变负荷相关的生物标记物并不完美,因为肿瘤特异性抗原的存在只是驱动癌症-免疫循环的许多必要条件之一,而且只有一小部分新抗原可以由MHC呈递并被TCR识别。
TME中CD8+T细胞的存在是抗PD1/PDL1治疗的先决条件。因此,TIL的丰度与PD1/PDL1阻断效果呈正相关。免疫组织化学(IHC)检测TIL可能是有前景的,但仍需标准化。PDL1在肿瘤中的表达已被确认为“煤矿中的金丝雀”,因为它证明了T细胞的存在。IHC检测到的PDL1表达已被广泛用作多种癌症的预测指标。PDL1的表达被认为是识别应答者的潜在预测生物标记物。然而携带PDL1阳性肿瘤的患者并不总是对抗PD1/PDL1治疗有反应。而且PDL1阴性的肿瘤并不意味着PD1/PDL1耐药。因此,将PDL1的表达视为“是或否”的生物标志物是不合适的。在一项试点研究中,研究人员发现,尽管PDL1表达高,但对抗PD1治疗无反应的大多数NSCLC患者在肿瘤内检测到Galectin-3的高表达,这表明协同使用某些生物标记物可能更好。
针对肿瘤免疫逃逸的不同步骤提出了不同的策略。类似于“打鼹鼠”的游戏。目前,策略主要集中在加强T细胞启动、逆转T细胞耗竭、增加T细胞浸润和改善免疫抑制微环境(图3)。
化疗可以促进肿瘤抗原的释放,并在诱导肿瘤凋亡时提供损伤相关信号,将DC转化为免疫刺激的APC用于CD8+T细胞启动。例如,地西他滨可以通过上调食管癌中MAGE-A3的表达来增强后续的抗原识别。一些化疗药物,如吉西他滨和环磷酰胺,在杀死肿瘤细胞的同时消耗MDSC和Treg。
黑色素瘤患者的临床研究显示,当将抗PD1治疗与多肽疫苗相结合时,通过增加抗原提呈来改善T细胞的启动,可以提高总体存活率。耐人寻味的是,一些患者在个性化肿瘤新抗原疫苗接种和抗PD1治疗的协同治疗中显示出CR。与自身免疫相似,溶瘤病毒治疗也会诱导肿瘤抗原释放,从而增强T细胞的启动和释放, 改善PD1/PDL1耐药性。放射治疗通过诱导肿瘤细胞死亡,激活STING通路并促进T细胞启动,从而上调I型干扰素的产生。接受过放射治疗的非小细胞肺癌患者在接受pembrolizumab治疗后显示存活时间延长
此外,靶向TLR的方案,如TLR3、TLR9,促进DC成熟,并合理缓解PD1/PDL1耐药性。由于CTLA4的表达上调被认为是介导T细胞启动的负调节因子,PD1和CTLA4抗体的联合治疗显著延长了患者的总体生存时间。总之,加强T细胞启动的策略可以提高PD1/PDL1治疗的敏感性。
共抑制免疫检查点受体的表达在T细胞激活后上调。针对替代免疫检查点或放大共刺激信号的策略可能有助于缓解抗PD1/PDL1耐药性。PD1/PDL1阻断与包括TIM3和TIGIT阻断在内的其他ICB的协同治疗已在多项研究中被证明具有优越的生存结果。近期Roche在ASCO公布了TIGIT抗体(Tiragolumab)与PD-L1抗体(Tecentriq®, Atezolizumab)联用在非小细胞肺癌(NSCLC)中的2期临床结果, 其客观反应率(ORR)达到31.3%,与Tecentriq单药的16.2%相比提高了近一倍。此外,针对CD40的激动性抗体已被发现显著逆转了T细胞的耗竭,重新激活的T细胞增加了细胞因子的产生以及细胞毒和增殖的能力。
充分的T细胞浸润是通过阻断PD1/PDL1重振抗肿瘤免疫的前提。PD1/PDL1阻断和过继细胞转移联合治疗增加了T细胞的浸润和细胞毒性,从而打破了MHC功能障碍的限制。
免疫抑制微环境抑制了抗肿瘤免疫的主力军CD8+T细胞的功能,导致抗PD1/PDL1耐药。靶向TME中积累的TAMs可以有效地改善对治疗的应答。CSF1R抑制剂与PD1抗体联合治疗可将M2重新编程为M1,并促使荷瘤小鼠肿瘤的消退。来自肿瘤的免疫抑制细胞因子不仅能吸引免疫细胞浸润并促使其分化为亲肿瘤表型,而且还能直接抑制CD8+T细胞的细胞毒作用。基于这一机制,靶向细胞因子特别是TGF-β可促进T细胞穿透并增强抗肿瘤免疫。此外,通过抑制剂脱敏趋化因子受体可以防止包括MDSCs和Tregs在内的免疫抑制细胞的渗透,这最终会增加肿瘤对PD1/PDL1阻断的敏感性。Th1型趋化因子如CXCL9和CXCL10的表观遗传沉默与免疫抑制有关。通过DNA甲基转移酶和组蛋白去乙酰化酶抑制剂的表观遗传调节使的肿瘤对PD1/PDL1治疗敏感。
代谢产物在调节肿瘤免疫抑制环境中起着关键作用。IDO已被证明通过将色氨酸转化为犬尿氨酸来影响TME。有证据表明,IDO抑制剂与抗PDL1和抗CTLA4抗体联合使用可促进临床前模型中CTL和IL2的增殖和浸润。然而,可能需要精确的生物标记物来选择应答者,因为临床研究中并没有显著的益处,而且有副作用,导致几项临床试验中断。
腺苷是腺苷能途径的产物。腺苷在TME中的积聚破坏了抗肿瘤免疫。使用A2A受体拮抗剂联合抗PDL1或抗CTLA4抗体治疗的小鼠中,高达90%的肿瘤完全消除。通过靶向酶CD73抑制腺苷的产生有效地促进了抗PD1/PDL1的效率。最近,对抗PD1/PDL1耐药的肾癌患者进行了首个罗氏开发的A2AR拮抗剂(CPI-444)治疗的研究。最新临床进展于2020年1月份发表在Cancer Discovery上。当单独使用A2AR拮抗剂或联合使用抗PDL1抗体治疗PD1/PDL1耐药患者时,观察到了临床应答。
PD1/PDL1 ICB的应用已成为免疫治疗的里程碑。尽管抗PD1/PDL1治疗在实体瘤治疗中显示出令人印象深刻的效果,但持久的应答只在一小部分患者中发生。一些最初对治疗有反应的患者最终产生了后天抵抗力。每个人都有不同的机制,使得正确选择患者和设计克服策略变得错综复杂。目前,广泛使用的生物标志物用于识别应答者的效率并不稳定,大多数基于机制的策略仍在进行临床前研究,而一些临床试验由于严重的不良反应和有限的效果而被终止。因此,绘制更详细的耐药机制图,设计适当的临床试验,探索适当的生物标志物,对于指导未来的精确治疗和扩大应答率是必要的,这需要我们每个医药工作者的共同努力。
1. Resistance Mechanisms of Anti-PD1/PDL1 Therapy in Solid Tumors.
2. Anti-angiogenic agents in the age of resistance to immune checkpoint inhibitors: Do they have a role in non-oncogene-addicted non-small cell lung cancer?
3. Resistance to immune checkpoint inhibitors. Next steps and combinational approaches.

扫描上面二维码在移动端打开阅读