膜结合的CD73催化AMP去磷酸化为腺苷(图1)。高浓度的腺苷一方面损害T细胞和自然杀伤(NK)细胞的激活和功能,导致强大的免疫抑制; 另一方面增强调节性T细胞(Treg)的功能和巨噬细胞M2的分化。通过抑制CD39和CD73的酶活性来阻断腺苷的产生直接破坏腺苷介导的免疫抑制将会是一种极具前途的治疗策略,并可以与其他的免疫免疫疗法如PD1/PDL1疗法和化疗协同作用。
各种临床前研究表明,体内抑制CD73限制了肿瘤细胞的生长和转移,增加了炎性细胞因子的分泌,并增强了针对PD1/ PD-L1和CTLA-4疗法的抗肿瘤效果。由于CD73的表达和活性似乎受许多疗法的调节,联合其他免疫检查点、过继T细胞治疗、化疗和放射治疗将会是提高各种癌症治疗效益的合理策略(图3)。
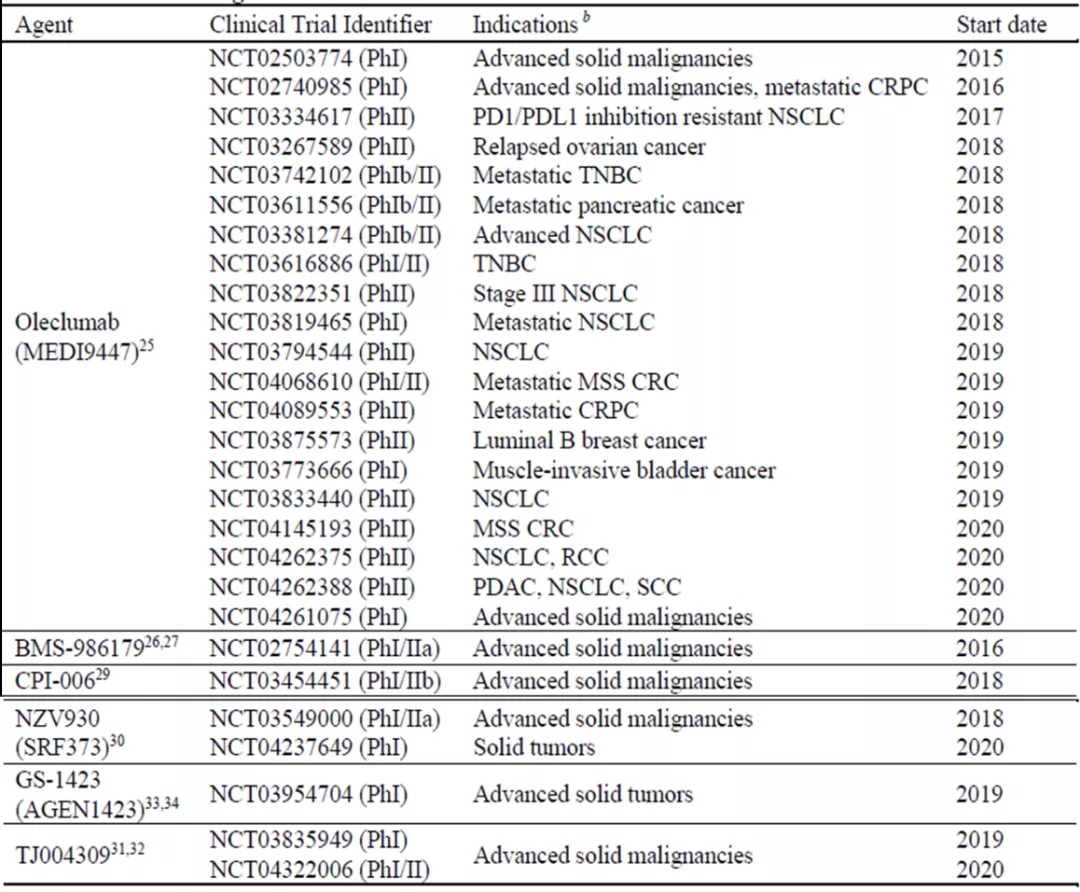
目前,对处于临床评估的CD73的Ab,如图4所示。Oleclumab,由阿斯利康公司开发,是CD73的变构抑制剂。它可以阻止CD73酶采用其催化相关的构象,导致CD73的聚集和内化。BMS开发的 (Ig)G1-G2杂合型BMS-986179也有类似的作用机制,它抑制CD73的催化活性,并诱导该酶内化。Oleclumab与duvalumab(PD-L1单抗)联合应用于结直肠癌和胰腺癌(NCT02503774),早期显示出一定的疗效,这促使20多个正在进行的临床试验,以进一步研究Oleclumab作为单一药物和联合免疫治疗或化疗在多种肿瘤类型中的作用。另外四种CD73单抗目前正处于I/II期临床试验,涉及一系列晚期实体恶性肿瘤。其中包括CPI-006(Corvus PharmPharmticals),一种人源化IgG1mAb,它与活性位点高亲和力结合,在没有内化的情况下阻断CD73的酶活性;NZV930由Surface Oncology开发,随后授权给诺华公司,它是一种全人IgG4单抗,其用临床研究药策略包括单药、联合PD-1抗体、联合A2AR拮抗剂等。
图4. CD73抗体临床在研药物
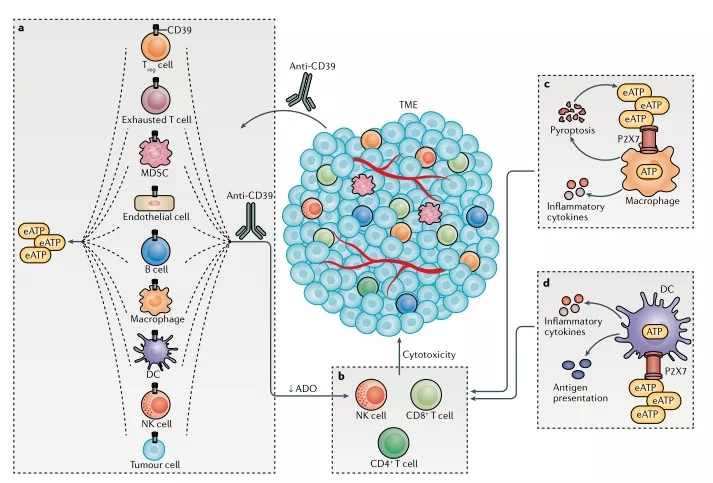
靶向CD39的潜在优势是它既可以释放免疫刺激的细胞外ATP,并可以通过降低这一途径产生的免疫抑制胞外腺苷的水平(图5)。然而,作为癌症的药物靶点,对CD39的研究略落后于CD73,很可能是因为CD39的研究历史以及对其在非肿瘤细胞上表达的担忧。
图5.CD39 通过多种机制增强抗肿瘤效力
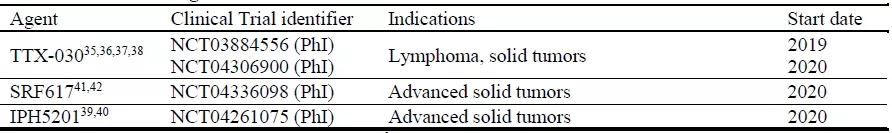
CD39 Ab的临床评价最近也开始了,目前正在进行的研究相对较少(图6)。TTX-030(Tizona Treeutics)是一种人IgG4 CD39单抗,它结合人CD39并变构抑制其酶活性,目前正在作为单一药物进行评估,并与化疗和/或免疫疗法结合用于淋巴瘤和实体瘤的治疗。IPH5201由Innate Pharma开发,是一种人源化的Fc沉默IgG1抗体,可以有效地阻断膜结合和可溶性CD39,从而保护免疫刺激的细胞外ATP,并防止细胞外腺苷在体外积累。2018年10月Innate Pharma与阿斯利康(AstraZeneca)签署了一项合作开发协议,以进一步为IPH5201进行共同开发和共同商业化。此外,在结合CD39和CD73抑制的临床前研究中,Innate Pharma已经证明了同时阻断这两种酶的潜在协同抗肿瘤作用。在这些结果的指导下,阿斯利康目前正在评估IPH5201、Oleclumab和PD-L1 Durvalumab的三联疗法。SRF617是一种全人源CD39单抗,由Surface Oncology研发,其可与原代免疫细胞和肿瘤细胞上的CD39结合,抑制CD39介导的ATP水解,并在体内降低系统腺苷水平。近日,Surface Oncology宣布,已与默沙东(MSD)达成了一项临床试验合作,逐步评估其开发的CD39抑制剂SRF617,与默沙东的重磅PD-1抑制剂Keytruda联合,以治疗实体瘤患者的安全性和有效性。
图6. CD39抗体临床在研药物
总之,人们对CD73和CD39的认知虽然仍处于初步阶段,但随着国内外企业纷纷投入巨资布局肿瘤免疫治疗药物的开发,越来越多肿瘤免疫机制将被探明。如何提高免疫疗法的应答率,使得用免疫疗法来治疗肿瘤的疗效增加,是现阶段学术界和工业界关注的重点。我们相信,更多安全有效肿瘤免疫治疗将被开发出来,免疫疗法治愈癌症的希望会变得越来越大。
2. Targeting Metabolism of Extracellular Nucleotides via Inhibition of Ecto-Nucleotidases CD73 and CD39
3. Targeting CD39 in cancer.
4. The yin and yang functions of extracellular ATP and adenosine in tumor immunity
5. On the mechanism of anti-CD39 immune checkpoint therapy.
扫描上面二维码在移动端打开阅读