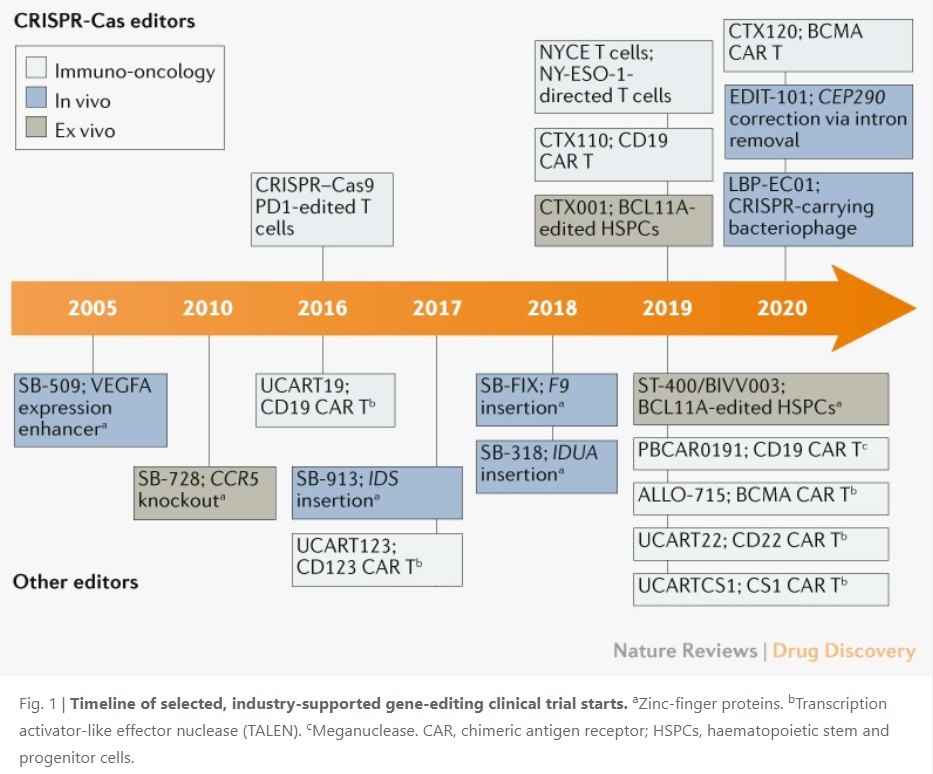
近几年来,基因编辑技术正在快速发展,仅过去的一年半里,就至少有11项基因编辑研发项目进入了美国或者欧盟的临床开发阶段,其中有6项都依赖于CRISPR-Cas基因编辑系统。当然,基因编辑技术并不只有CRISPR,基于锌指核酸酶(ZFN),转录激活因子样效应子核酸酶(TALEN)以及大范围核酸酶(meganulease)研发的基因编辑技术也不容忽视。
近日,Nature Reviews Drug Discovery 上发表了一篇题为Gene-editing pipeline takes off 的文章。作者在文中对基因编辑疗法的研发管线进行了盘点和分析。
体外基因编辑
最初的基因编辑技术主要是对体外细胞的基因进行编辑,这是治疗风险相对较低的起点。体外基因编辑是指从患者体内采集细胞到体外进行基因编辑后,再作为治疗药物重新注入患者体内。
体外基因编辑技术可以克服基因编辑的多种障碍。以CRISPR基因编辑技术为例,基因编辑的一个主要障碍是如何将较大的基因编辑系统递送到细胞内部,而体外基因编辑可以使用电穿孔技术打开细胞膜这一屏障,让基因编辑系统比较容易地进入细胞。
CRISPR基因编辑技术需要克服的另外两个难关是防止基因编辑的“脱靶效应”和Cas蛋白产生的免疫原性。而在体外对细胞的基因进行编辑可以避免人体的免疫反应带来的一系列问题;同时,可以对编辑后的细胞进行检测,发现和清除具有“脱靶效应”的细胞。另外,研究人员还可以对编辑效率进行量化,并仔细控制用药剂量后,再将细胞回输到患者体内。因此,体外基因编辑技术能提高潜在疗法的安全性。
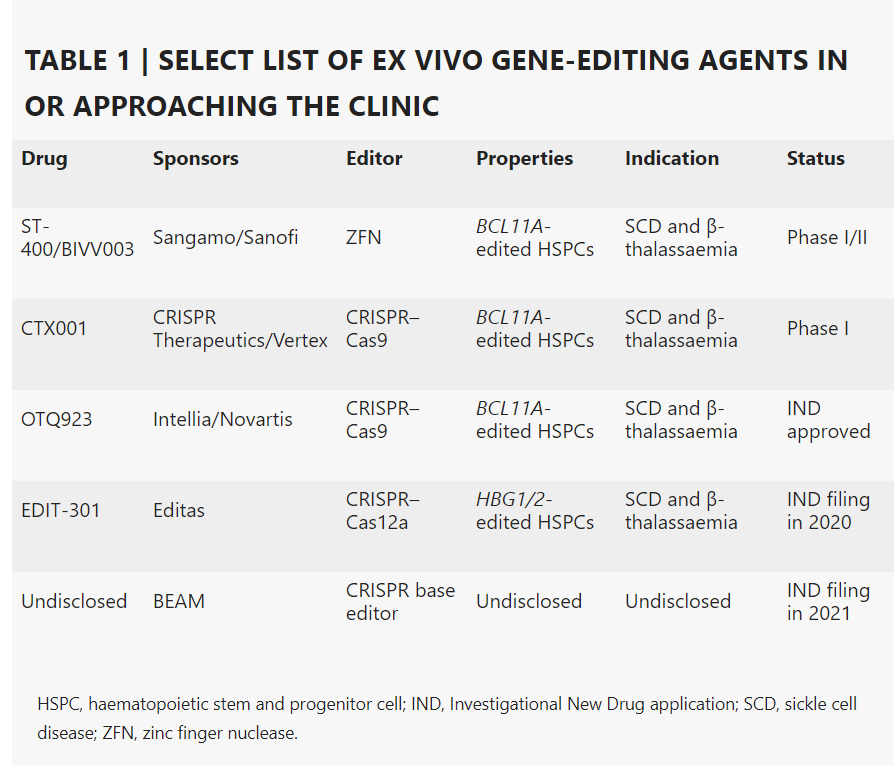
目前,体外基因编辑技术主要应用于血红蛋白疾病和肿瘤免疫学这两大领域。在血红蛋白疾病方面,镰状细胞贫血(sickle cell disease ,SCD)和β地中海贫血(β-thalassaemia)的基因编辑治疗已经进入了临床开发阶段。Sangamo Therapeutics 是基因疗法领域的领导者,其开发的ST-400和BIVV003是基于ZFN基因编辑技术来编辑BCL11A基因以增强胎儿血红蛋白的表达,提高胎儿血红蛋白水平。
CRISPR Therapeutics 和 Vertex基于CRISPR-Cas基因编辑系统联合开发了CTX001,靶向编辑BCL11A基因,于2019年2月进入了临床研究,治疗同类疾病。2019年这两家公司报告了来自2名患者的初步安全性和有效性数据。
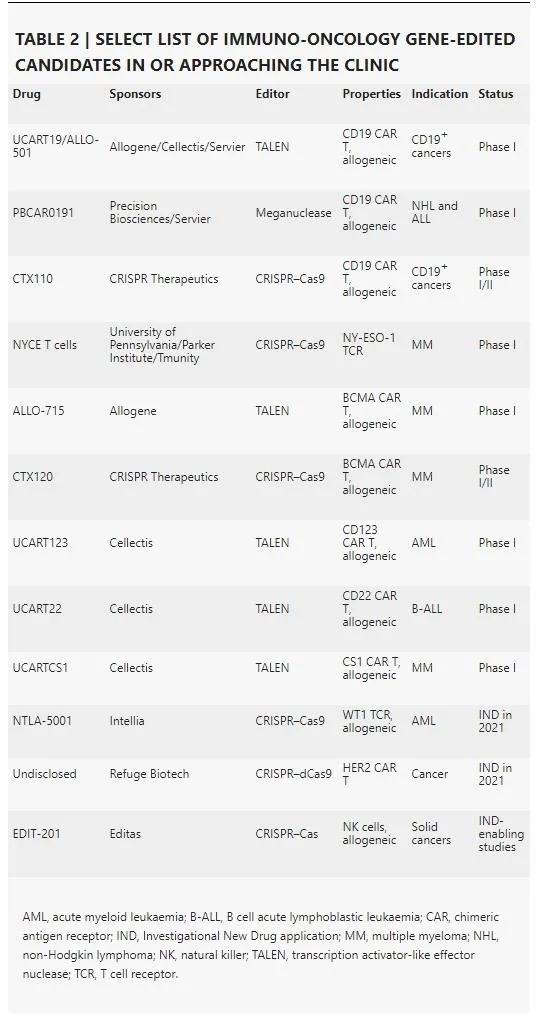
在肿瘤免疫疗法方面,CAR-T疗法的获批以及其在治疗血液肿瘤方面的成功,不但为T细胞的基因编辑打下了良好的基础,也为基因编辑技术提供了一个很好的应用领域。CAR-T疗法是指抗原嵌合受体通过基因工程的方法表达在T细胞表面,得到CAR-T细胞,以攻击肿瘤。然而,T细胞中原本存在的天然T细胞受体可能影响CAR-T细胞的疗效,并且T细胞还受到多种免疫抑制和调控机制的影响,导致它们功能失常或出现衰竭。
基因编辑技术提供了一种进一步改进CAR-T 疗法的策略。在2019年,宾夕法尼亚大学的 Carl June 教授(CAR-T 细胞疗法先驱之一)与合作伙伴一起,使用CRISPR-Cas9基因编辑技术敲除了T细胞中的内源T细胞受体和表达PD-1的基因。然后,他们将识别NY-ESO-1抗原(一种在多种肿瘤组织中高度表达的抗原)的T细胞受体表达在这些T细胞中。今年2月,研究团队在Science 杂志上发表了研究的初步结果。初步结果表明,经过基因编辑的T细胞没有导致与治疗相关的严重不良反应,而且显示出持久的存活和扩增能力。
相关链接:https://science.sciencemag.org/content/367/6481/eaba7365/tab-pdf
目前在癌症免疫疗法的研发管线中,基因编辑技术被用于进一步改善靶向CD19或BCMA抗原的CAR-T疗法,以及对同种异体细胞疗法进行改造,防止同种异体的T细胞对宿主组织进行攻击。
体内基因编辑
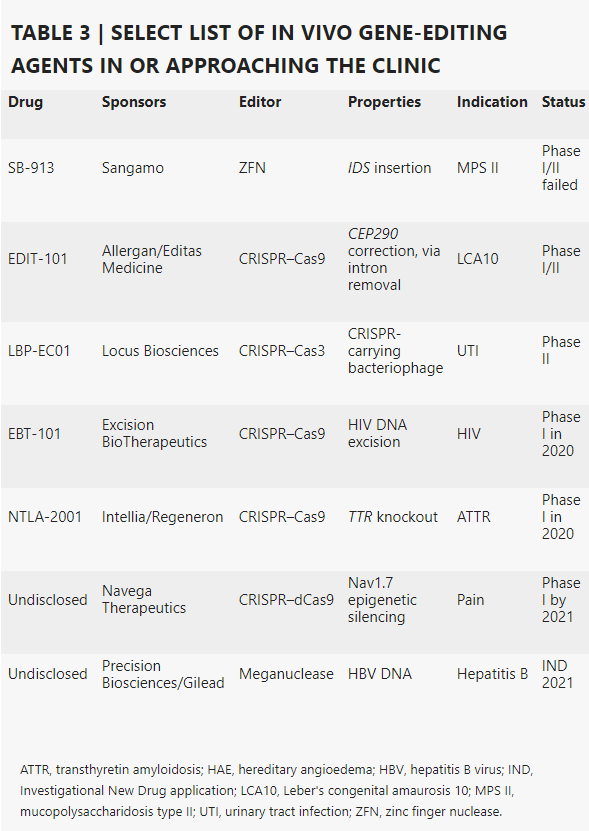
体内基因编辑技术需要将基因编辑系统送入患者体内,在体内完成对基因的编辑。与体外基因编辑相比,它需要克服更多的障碍,而它的应用领域也更为多样化。
例如,Sangamo的SB-913用于治疗一种罕见的遗传疾病——II型粘多糖贮积病(MPS II)。Sangamo希望通过SB-913疗法证明将缺失基因的功能性版本直接插入细胞染色体DNA中的可行性。SB-913也已于2017年11月开始临床试验。不过,2019年2月,Sangamo发现接受SB-913治疗的患者病情并没有明显的好转。
基于 CRISPR 技术开展研发的公司除了插入基因的方案,也在探索使用该编辑工具删除DNA,例如,Editas 和 Allergan 开发的 EDIT-101 跨里程碑的使用CRISPR-Cas9 来剪切 Leber 先天性黑蒙症 10 型(LCA10)失明患者的一部分突变 CEP290,从而迫使机体产生功能蛋白,最终达到恢复视力的效果。这是一项具有里程碑意义的研究。
通过这种尝试,在2017年,Spark Therapeutics获得了FDA的批准,使用 voretigene neparvovec 治疗 LCA2 先天性失明。Spark通过选择眼科很好地避开了障碍基因治疗领域的并发症。因为眼睛具有免疫特权(immunoprivileged),对外来载体和引入的转基因发生免疫反应的风险较低。而且从眼睛到身体其他部位的循环有限,从而降低了组织脱靶(off-tissue)编辑的风险。此外,已编辑的细胞不再更新,提高了产生长期效应的可能性。
面临的挑战
随着基因编辑试验结果的陆续揭晓,一些关键的临床发现可能会对基因编辑疗法的发展产生巨大的影响。
首先,各类不同的编辑技术具有怎样的免疫原性?因为进入体内编辑所需的编辑工具和载体都是外来的,所以可能会降低疗效甚至造成伤害机体的免疫反应。虽然 AAV 载体在基因治疗中的应用已将其风险大幅降低,但 CRISPR-Cas系统是细菌产生的,目前尚不清楚患者的免疫系统会对其产生怎样的反应。初步的免疫原性数据是混杂的。对人类Cas9蛋白质的免疫力分析也显示,高达 58%~78%的受试个体对不同的 Cas9 突变体具有预存的免疫力。而另一项使用了不同类型测量方法的研究发现,预估比例为 2.5%~10%。此外,最近的一项研究表明,对 Cas9 的预存免疫力会消除小鼠体内的基因组编辑细胞。但是,在人体中是否也如此还有待观察。
其次,基因编辑脱靶效应也是一个持续存在的问题。虽然基因编辑是特异性的,但仍然可能在意想不到的位置切割 DNA。当然这种情况的发生程度尚待讨论,也还需要更好的工具来评估脱靶编辑的范围和效果。
除此之外,基因编辑的长期作用也存在一些问题。基因操纵的稳定性以及结果可控性都是仍待解决的问题。对这些问题的研究非常重要,将为CRISPR未来的应用奠定基础。
未来展望
现在很多基因编辑工具已逐渐变得多样化。例如,Beam Therapeutics 希望使用哈佛大学的David Liu等人许可的基础编辑方法,将CRISPR-Cas推向新的方向。该方法是替换DNA链中的碱基,而不是去除,还可以精确地靶向基因组的某个区域,从而精确地控制将要产生的序列(在疾病相关的遗传错误中,有一半以上是由单碱基变化引起的)。此外,2013年,Doudna教授与其同事在一篇Cell 论文中揭示了 CRISPR可以与催化失活的dCas蛋白偶联。dCas9可以与效应域结合,以控制靶基因的表达,而不是切割DNA。
杜克大学基因编辑专家Charles Gersbach教授则认为这些类型的编辑工具可能会改变基因编辑某些规则,因为它们在治疗疾病上会更加灵活、强大和适应性强。
原因有以下三点:
首先,这些基因编辑方法的脱靶编辑效应可能更易于管理。虽然候选转录物可能装入错误的基因并产生一两个mRNA转录物,但不会产生像意外切割非目标DNA一样的持久影响。
其次,这些下一代基因编辑工具还可以根据需求进行反向的调节性编辑。尽管一步到位的基因编辑疗法对于罕见的单基因疾病来说很振奋人心,但在其他疾病中,药物开发人员可能会想要随时间的推移能够调节基因编辑靶向活性。这有助于减轻患者、医生和监管机构对永久编辑可能引发的长期影响的担忧。
最后,许多常见疾病是由基因表达失衡导致的,因此,它们可能更适合通过调节性编辑来纠正。
所以,未来也还会有很多新的公司基于这些新基因编辑工具开展研发。而基因编辑技术的临床应用也才刚刚开始,仍有大量未知等待探索。
原文链接:https://www.nature.com/articles/d41573-020-00096-y
扫描上面二维码在移动端打开阅读