2020年8月29日/医麦客新闻 eMedClub News/--最新一期的医麦课堂邀请到了西安桑尼塞尔生物医药CEO、首席科学家彭作翰博士做客直播间,就“下一代CAR-T升级之路——非病毒载体与基因敲入技术略谈”进行案例分析和干货分享。
本次课程从CAR-T行业痛点出发,总结目前非病毒载体和基因敲入技术在CAR-T细胞治疗中的应用,并且重点介绍该领域的国际最新进展,以此与行业众多同行交流碰撞,一起推动细胞治疗领域的新技术革命。
内容摘要如下:
1、 背景
CAR-T细胞疗法所取得的成绩
行业痛点
行业升级之路
2、 非病毒载体
3、 基因敲入技术
4、 桑尼赛尔所做的工作
行业背景
CAR-T细胞疗法迄今为止取得了令人鼓舞的成绩,曾在2013年被评为科学杂志的十大科学进步之首。近几年,无论是在医药圈还是投资圈都非常的火热。
CAR-T治疗在多种的复发难治白血病中都有非常好的治疗效果。2017年两款CAR-T上市以后,销售额都保持了一个比较好的增长率,并且已经在很多的国家获批上市,另外在美国和日本都有CAR-T进入医保。
然而,CAR-T的发展处于早期阶段,和其他比较成熟的小分子化药或者抗体药相比,还属于幼年时期。
彭博士介绍,目前该领域有几个痛点,首先是价格非常高昂,已经上市的两款CAR-T售价都超过了300万人民币,而这个价格仅仅是药物本身,并不包含住院以及其他的治疗费用,预计今年或者明年在国内上市的CAR-T细胞价格都将在百万级别。
第二个是安全性。诺华早期CD19 CAR-T治疗急性淋巴白血病的安全性数据显示,49%的病人发生3级以上的CRS,72%的病人发生神经毒性,而且大多数的病人都需要使用托珠单抗或者激素去进行干预治疗。所以安全性问题导致CAR-T治疗只能在有经验的医生以及科室才能够进行,极大限制了普及性。
第三个是疗效。彭博士以今年陆道培医院公布的临床数据为例,他们发现在接受CD19 CAR-T治疗急性淋巴白血病的一年之后,如果不做骨髓移植的话,仅有11.6%的病人是无病生存的,有90%的病人会复发。
综上,CAR-T虽然可以给很多的白血病患者带来希望,但是它还有很多提高的空间。所以未来产品的升级是大势所趋。
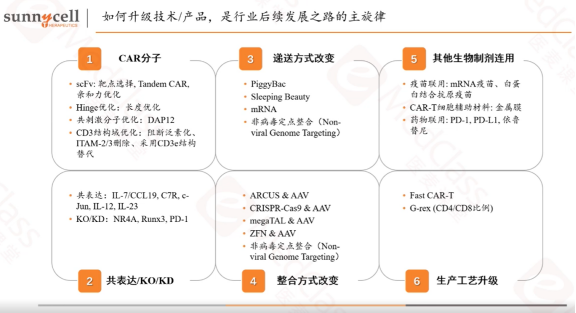
在医麦课堂上,彭博士总结了6个CAR-T升级的方向:
第一,CAR分子的改变;
第二,通过共表达、敲除(knock-out)或敲低(knock-down)内源性基因;
第三,递送方式的改变,传统使用的都是病毒载体,现在趋势是使用非病毒载体,譬如转座子或者mRNA等;
第四,整合方式的改变,传统的CAR-T采用的都是病毒载体,以随机插入的方式,将CAR整合到T细胞,未来有可能使用到定点整合;
第五,和其他的生物制剂联用;
第六,生产工艺升级。
接着,彭博士对非病毒载体的递送方式和定点敲入的整合方式进行了重点介绍。
非病毒载体递送技术
目前使用的非病毒载体主要有三种,一个是PB转座子,SB(睡美人)转座子以及mRNA。采用PB转座子的公司包括国外的Poseida和国内的上海细胞治疗集团,该递送方式的基本原理是将PB转座酶和PB转座子,通过电穿孔转导到T细胞后,转座酶将转座子上的CAR基因或者是其他的原件,剪切下来以后粘贴到基因组DNA中。这两家公司都发现PB转座子技术有一个很独特的优势,就是可以提高中央记忆T细胞的比例,来提高CAR-T的安全性以及疗效。
另外PB转座子应用于CAR-T,还有一个优势是它的装载量会更大,而且转导效率很高。目前Poseida的BCMA CAR-T已经进入到了临床II期阶段,上海细胞治疗集团主要是应用在CD19 CAR上,现在正在开展临床I期,主要是用来治疗复发难治性弥漫性大B细胞淋巴瘤。
第二个常用的非病毒系统是SB转座子系统,代表性公司有Ziopharm和Precigen公司,原理和PB转座子系统类似,用到的载体也是质粒或者是mRNA。比较有特色的是Ziopharm这个公司,它使用该技术时是将mbIL-15(膜结合IL-15)蛋白和CAR基因同时转导到T细胞做成CAR-T细胞,使得CAR-T可以在体内持续的自我激活,所以该方法对回输的剂量要求是比较少的。因此他们将这项技术做成快速CAR-T技术,即细胞无需激活就进行电穿孔,培养两天以后就进行回输。目前该项目进入到了临床阶段,另外他们也使用SB转座子系统去开展了一些其他的TCR-T项目。另外一个公司是Precision,他们利用SB系统研发的CAR-T分别用于治疗实体瘤以及AML,目前有一些项目已经进入了临床阶段。
mRNA载体是相对小众的一种非病毒载体,原理是把CAR基因通过体外转录成 mRNA,然后通过电穿孔转导到T细胞。最早的几年主要是宾大的Carl June团队开展了这方面的研究,并且公布了少量的临床数据,另一个是MaxCyte公司。
mRNA载体应用于CAR-T治疗的优势:
-
T细胞无需激活,可实现快速CAR-T的制备(1天);
-
转染效率比较高,通常是90%以上;
-
瞬时表达,风险小,特别适用于新靶点的早期临床验证;
-
制备工艺相对比较简单。
根据MaxCyte在今年ASCO上公布了使用基于mRNA非病毒载体的CAR-T或者是CAR-NK、CAR巨噬细胞的混合细胞来治疗卵巢癌以及间皮瘤的初步结果,11例病人中的4例是确定疾病稳定(SD),2例待确定,没有神经毒性,CRS级别都比较低,相对比较安全。彭博士认为,mRNA非病毒载体技术能取得这样的临床数据已经相当不错。
基因敲入技术
2018年,Carl June团队发表了一篇文章,这篇文章报道了一例特殊的病人。这个病例比较有意思,在回输CD19 CAR-T的2个月以后才开始产生应答,并且在6个月后实现了完全缓解(CR)。目前这名患者已经随访5年,并且没有复发。该团队觉得这个病例非常的不可思议,于是就寻找其中的具体机制是什么。他们发现原来是CAR基因随机插入TET2位点,而导致CAR-T细胞的记忆T细胞比例提高,从而促使它的疗效非常好。
这个病例说明了强效的CAR-T细胞理论上是可以缓解病情的,并不需要太多的CAR-T细胞。如果能够使用定点整合重现这种意外的效果,是不是会更好?
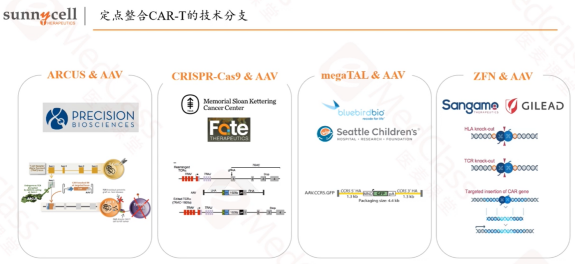
彭博士介绍,定点整合CAR-T技术应用在细胞中的难度是很大的。一方面是因为T细胞比较脆弱,另一方面是因为T细胞的DNA重组活性并不活跃,所以在T细胞里进行定点整合是比较难的。那么直到AAV病毒和基因编辑的出现,两个技术联用才改变了局面。目前有4种基因编辑手段与AAV联用,布局定点整合CAR-T的多集中在基因编辑头部公司,而且都是以联合开发为主。
目前基因敲入技术在CAR-T中的应用仍处于早期阶段,而且基本上所有的项目都是应用在通用型CAR-T上面,很少应用到自体CAR-T。
整合非病毒载体和基因敲入技术是西安桑尼赛尔生物医药(Sunnycell Therapeutics Co., Ltd)目前所做的工作,其技术平台被称为非病毒定点整合CAR-T技术 (non-viral Genome Targeting CAR-T, nvGT CAR-T™)。这是基因编辑技术(定点敲入技术)首次应用在自体CAR-T细胞治疗上,有望成为下一代自体CAR-T。目前,该公司已经将这项技术推进到研究者发起的临床研究阶段。
彭博士称,这项技术有几个优势,首先是制备工艺极简,第二是安全性,第三是疗效。
首先是工艺。基于病毒载体的CAR-T,通常需要三个生产车间,进行质粒、病毒以及CAR-T细胞的生产,并且质粒或者病毒的生产其实都是比较复杂的,需要投入的硬件设备以及人员团队都很多,而且需要海量的时间去摸索。而非病毒定点整合载体的生产工艺非常的简单,它不需要质粒,也不需要病毒,桑尼赛尔的非病毒载体的制备只需要两步就可以完成。根据桑尼赛尔的计算,固定资产投入会更少,大概是慢病毒或者逆转录病毒的三分之一投入。
第二个是省时间。工艺开发时间大概为2~3个星期。目前,该公司已经将非病毒定点整合技术应用于首次的人体临床研究。该项临床研究利用CD19 CAR-T细胞治疗复发难治性急性淋巴细胞白血病,目前已经完成了12个人的治疗以及评估,这12名患者均是高危高肿瘤负荷,很多都是其他医院并不收治的病人,而且有相当的病人在治疗前都有很严重的感染。
彭博士还具体介绍了CAR-T候选产品的制备情况和安全性数据(详细数据请回看课程)。他表示,0.5~8×10^6/kg的回输剂量可能已经超过了很多现在的CD19 CAR-T。在前面提到的12名高肿瘤负荷病人中,目前只有1例发生3级的CRS,而且这1名病人的肿瘤负荷超过99%。另外跟病毒载体CAR-T相比,该CAR-T治疗导致的CRS的发生时间也是比较慢的,病人在第9天才开始CRS反应。在治疗的过程中,没有观测到神经毒性,而且研究者没有使用托珠单抗或者是激素类的药物去干预,目前没有病人因为治疗而死亡。
截止目前,接受这款CAR-T治疗的12名患者全部都处于CR,最长的1例已经持续了156天。nvGT CAR-T™有可能在疗效上相对病毒载体更有优势,但还需要更多的观察。
非病毒定点整合CAR-T是一种平台技术,其应用范围很广阔,未来可以用在CD19 CAR-T以外的其他CAR-T上。目前,一些研究工作发现该技术在实体瘤上有更好的潜在的效果。而且跟其他的非病毒载体类似,nvGT CAR-T™可以安装更多的辅助元件,比如说像细胞因子、趋化因子等,提高它的功能。非病毒定点整合平台也可以应用在TCR-T、通用CAR-T的项目开发。
详细的临床数据预计将于今年底美国血液年会(ASH)上发布。期待西安桑尼赛尔报告的临床结果能够为解决行业痛点带来一些希望,让我们拭目以待。
扫描上面二维码在移动端打开阅读