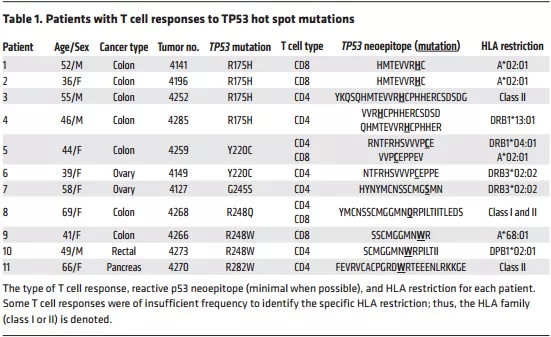
表1:对TP53热点突变有反应的患者
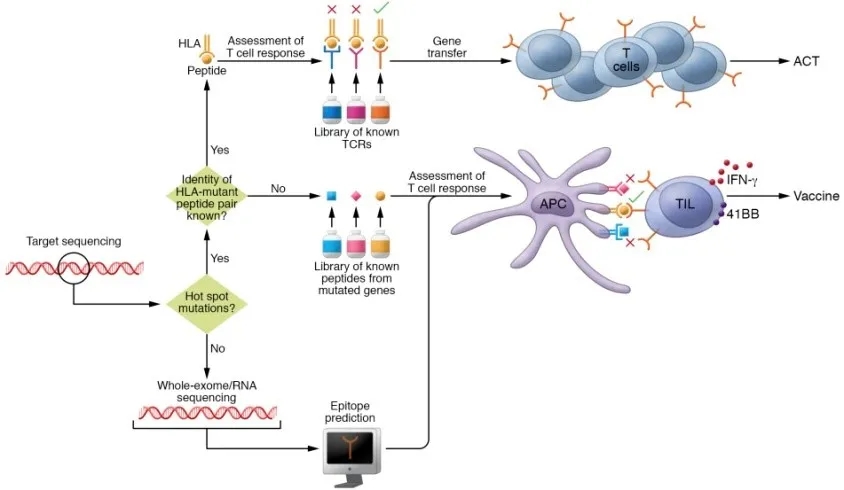
作者提供了一种快速的方法来筛选肿瘤新抗原用于后续免疫治疗。COSMIC数据库显示所有肿瘤类型中最常见的12种TP53热点突变为R175H, Y220C, G245S, G245D, R248L, R248Q, R248W, R249S, R273C, R273H,R273L, R282W。把每个T细胞热点突变构建为编码25个氨基酸肽的小基因或肽段(共25个氨基酸,中间为突变氨基酸,两侧为12个野生型氨基酸)。用串联小基因(TMGs)电穿孔或肽脉冲来自体外周血中未成熟的树突状细胞,并与TILs片段培养物共培养,以IFN-γ的分泌和CD137(41BB)的上调作为读数来评估患者TILs的新抗原反应性。一般情况下,从患者肿瘤标本中鉴定新抗原特异性T细胞的过程耗时34天,通过使用预先创建的文库中的肽刺激T细胞可以进一步加快整个过程。如果没有热点突变,则使用全外显子组/RNA测序和表位预测来鉴定新抗原的标准流程(图1)。
图1:加快新抗原鉴定流程
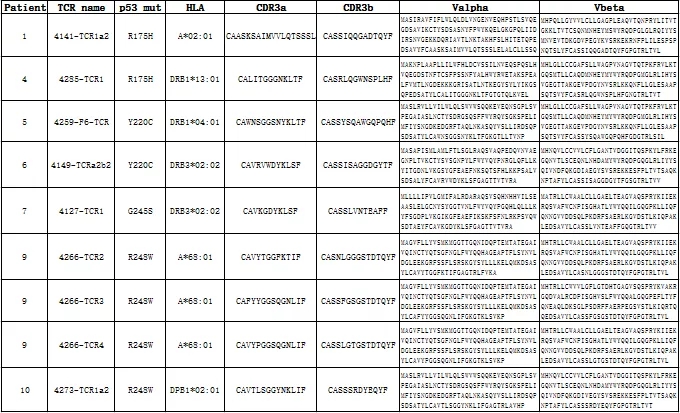
表2:TP53新抗原特异性TCR
扫描上面二维码在移动端打开阅读