免疫检查点抑制剂的出现彻底改变了临床上对某些癌症的管理方案。但是,大多数实体瘤对现有的免疫疗法无充分应答。目前,现有的大多数免疫治疗方法侧重于增强αβ T细胞反应。但在复杂的肿瘤微环境中其他具有抗肿瘤功能的细胞亚群,如可浸润大多数人类肿瘤局部的γδ T细胞,其抗肿瘤功能未充分利用。根本原因在于目前的免疫疗法未能充分开发γδ T细胞的原位MHC非依赖性的抗癌潜力。与免疫抑制性B7家族成员结构相似的嗜乳脂蛋白(butyrophilin)和类嗜乳脂蛋白分子可以激活 γδ T细胞,但是该家族如何调节和协调αβ和 γδ T细胞的反应仍然未知。
2020年8月21日,美国H. Lee Moffitt癌症中心Jose R. Conejo-Garcia研究组在Science杂志发表了题为BTN3A1 governs antitumor responses by coordinating αβ and γδ T cells 的研究文章。该研究发现:嗜乳脂蛋白BTN3A1通过阻止N-糖基化CD45从免疫突触的分离来抑制肿瘤反应性 αβ T 细胞的激活。值得注意的是,CD277 (BTN3A1-3) 特异性抗体与BTN3A蛋白结合,能够重塑 αβ T细胞的抗肿瘤效应,同时能恢复 γδ T淋巴细胞对表达BTN3A1癌细胞的细胞毒性作用,最终消除肿瘤的恶性进展。因此,靶向BTN3A1的治疗手段不仅能够协同 αβ 和 γδ T细胞来杀伤已确立的肿瘤,同时对抵抗现有免疫疗法的肿瘤提出一个全新的潜在治疗策略。
为了研究BTN3A1在肿瘤中的潜在作用,作者首先分析了42个III / IV期的人类高级浆液性卵巢癌(HGSOC)组织中BTN3A1的蛋白表达水平。与卵巢良性肿瘤和正常组织相比,BTN3A1在恶性组织中过表达。流式细胞分析结果也显示,卵巢组织和乳腺癌组织中,CD277在骨髓来源的细胞和肿瘤细胞中高表达,但是在淋巴细胞中表达较弱。随后作者又对398个HGSOC癌组织进行免疫组化分析,发现BTN3A1普遍表达于卵巢癌的肿瘤床,且通常定位于上皮细胞的细胞膜和细胞质中。与其免疫抑制作用一致,作者发现BTN3A1在200例卵巢癌组织中的平均表达水平与患者存活率明显相关。值得注意的是:γδ T细胞浸润与患者预后的改善相关。
随后作者构建了逆转录病毒介导的过表达BTN3A1的(MHC-I-)CD32+ K562人工抗原提呈细胞(BTN-K32 aAPCs)。体外T细胞-抗原提呈细胞共培养实验发现,BTN3A1过表达的BTN-K32 aAPCs废除了CD4+ 和CD8+ αβ T细胞的体外激活。为了阻断BTN3A1的免疫抑制活性,作者筛选了一系列与BTN3A1反应的全长单克隆抗体,最终确定克隆CTX-2026具有最佳活性。CTX-2026表现出最佳的重塑CD4+ 和CD8+ αβ T细胞的体外激活的能力。CTX-2026以及其他BTN3A1的阻断剂都显著提升了αβ T细胞对靶细胞的特异性杀伤。值得注意的是,CTX-2026能够促进Vγ9Vδ2T细胞对卵巢癌细胞的杀伤。
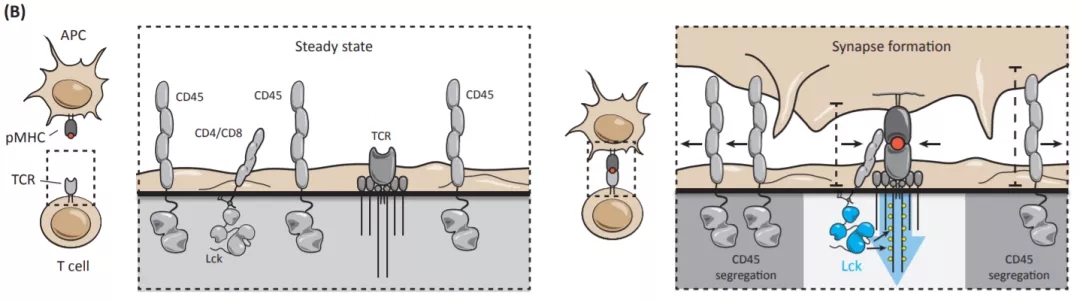
那么,BTN3A1通过什么机制来抑制 αβ T细胞的活化呢?作者发现,TCR激活后,同型二聚体BTN3A1-Fc结合于活化的原代T细胞表面,并抑制TCR近端信号分子的磷酸化活化。液相色谱-串联质谱光谱法(LC-MS / MS)结果显示BTN3A1蛋白与T细胞表面的跨膜蛋白磷酸酶CD45组成性结合。已知,T细胞在静息状态下(steady state),激酶Lck随机遇到TCR复合物并将其磷酸化,但是这些磷酸化事件被蛋白酪氨酸磷酸酶(例如CD45)的去磷酸化功能所抵消,从而维持T细胞的静息状态。但是,在T细胞与抗原提呈细胞或者靶细胞之间形成免疫突触时,TCR-pMHC的结合将会破坏Lck和CD45之间的稳态平衡,将CD45从免疫突触中分离出去,从而形成稳定的免疫突触,启动TCR信号传导(图1)【1】。作者的研究发现,BTN3A1-CD45的相互作用,阻碍了CD45的与TCR复合物的分离,证明BTN3A1通过阻断CD45从免疫突触的分离,从而有效阻碍免疫突触的形成,最终抑制 αβ T细胞的活化及效应功能。
图1 CD45在T细胞中的重要功能。
那么BTN3A1与CD45的相互作用的具体机制是什么呢?作者将关注点集中在CD45胞外段严重的N-糖基化。作者通过一系列的体外研究表明,BTN3A1可以识别CD45的膜近端结构域中的N-甘露糖基化寡糖,并将CD45二聚体锚定在TCR附近,并可能通过物理方式阻断TCR-pMHC的连接有效抑制了TCR信号激活及T细胞的功能。
接下来,作者利用重度免疫缺陷小鼠(NSG小鼠)构建了人的卵巢癌肿瘤模型,来验证阻断BTN3A1的抑瘤功能。结果显示,CTX-2026抗体阻断最有效的抑制了卵巢癌肿瘤生长,其抑瘤效果甚至优于抗PD-1抗体nivolumab。CTX-2026抗体阻断也增强了γδ T细胞的抗肿瘤效应。CTX-2026抗体阻断也大大促进了αβ T细胞和 γδ T细胞的肿瘤浸润。最终作者发现,对已确立肿瘤的最佳抗肿瘤功效来源于同时回输 γδ T细胞和肿瘤特异性 αβ T细胞并联合CTX-2026给药的组合治疗。这种多手段的治疗引起肿瘤内囊性腔的形成,提示部分肿瘤排斥反应。
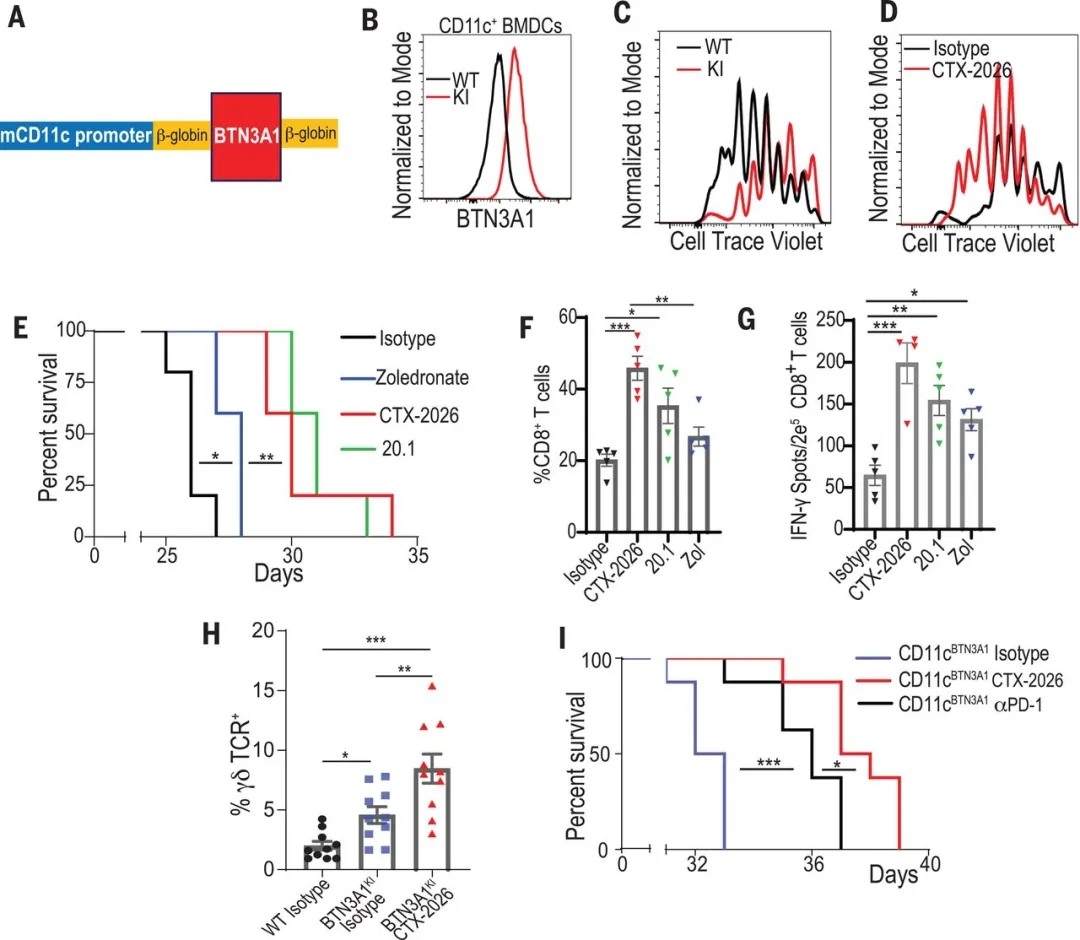
最后,作者构建了转基因小鼠(BTN3A1KI小鼠),该小鼠的CD11c+ DCs特异性表达人的BTN3A1蛋白(图2,A和B)。作者验证了人BTN3A1的过表达能够抑制 αβ T细胞的增殖(图2C),但是CTX-2026抗体可挽救BTN3A1的抑制作用(图2D)。体内原位卵巢癌模型结果也证实,与野生对照小鼠相比,BTN3A1KI小鼠体内的肿瘤表现出加速的恶性增长。而CTX-2026抗体能够极大的改善BTN3A1KI小鼠的生存期(图2E),同时促进荷瘤小鼠腹水中CD8+ T细胞(图2F)及 γδ T细胞的聚集(图2H)。最后作者也发现,CTX-2026抗体治疗比中和PD-L1 / PD-1治疗更有效(图2I)。
图2. 靶向BTN3A1可导致BTN3A1TG小鼠自发抗肿瘤免疫。
综上所述,BTN3A1通过与T细胞表面的N-糖基化的CD45分子相互作用,从而物理性的阻断CD45分子从免疫突触的分离,进而阻断TCR信号的传递,抑制T细胞的效应功能。而BTN3A1靶向治疗在重塑 αβ T细胞的抗肿瘤效应功能的同时,能够激活 γδ T细胞对肿瘤细胞的杀伤。因此,靶向BTN3A1的疗法克服了卵巢癌的高度免疫抑制性微环境,为抵抗免疫检查点抑制剂的肿瘤提供了全新的治疗策略。
扫描上面二维码在移动端打开阅读