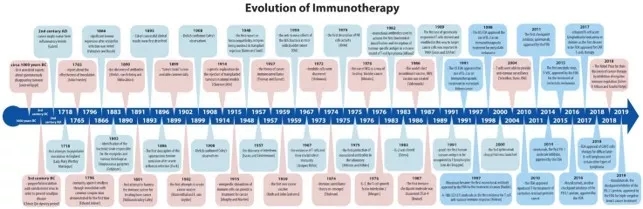
免疫疗法经常被认为是较新的进展,但是实际上,它的产生可以追溯到远古时期。对免疫系统首次通过调节免疫系统治疗癌症的尝试应该要得益于两位德国科学家,Fehleisen and Busch,他们独立发现了丹毒感染后肿瘤明显消退。这接下来重大的进展就来自今日被称为免疫疗法之父的William Bradley Coley。1891年Coley首次尝试利用免疫系统治疗骨癌,他的成就大部分有超过50年没有被人们注意到,还有一些免疫学领域的重大发现,比如1967年T细胞的发现以及它在免疫学的关键作用,加快了如今对癌症免疫疗法的研究。接下来的文章追踪了癌症免疫疗法从目前已知的开端到最近的事件,包括2018年诺贝尔奖获得者颁发给James Allison和Tasuku Honjo,以表彰他们在将检查点分子(checkpoint molecules)视为潜在的治疗目标的细致工作。这项工作促使新检查点抑制剂、CAR T细胞和溶瘤病毒的成功开发,这些进展的步伐给癌症治疗的未来带来了最大的希望。
我们倾向于认为免疫疗法是最近的医学成就,起源于不少于20年前。但实际上免疫疗法sensu lato的开始可以追溯到公元前三世纪中国的秦朝。尽管很难证明,稀缺的记载资料中有提到有目的的接种天花轻度病毒以预防天花疾病。许多个世纪以后,1718年有报道英国驻伊斯坦布尔大使的妻子MaryWortley Montague夫人在奥斯曼帝国进行了这种做法。受到当地习俗及积极成果的启发她尝试在返回英国时推广接种疫苗,但遭受抵抗以及英国医生普遍的不信任而未能成功。然而,1796年John Fewster在医学会成员面前做了一个类似的报告。不久后Edward Jenner通过接种常见的牛痘病毒证明具有抗天花的保护性免疫力。这次事件被广泛接受为疫苗接种的开端,它无可置疑的改变了现代医学并拯救了上百万的生命。
疫苗接种的历史,无论多么吸引人和多么精彩,本文都将无法描述详细。相反,我们将跟踪历史中相对现代的部分Dobosz和Dzieci˛atkowski迷人免疫疗法,immunotherapy sensu stricte,专注于从最初的尝试到2018年的癌症治疗诺贝尔奖获得者James P. Allison和Tasuku Honjo通过抑制负免疫调节癌症疗法的发现。
开端
从古埃及时代,约3000年前到19世纪早期有许多关于肿瘤自发消失和感染后伴随高烧的传闻。希腊医生Galen第一次描述了癌症和炎症的相似性,他指出癌症可能是由炎症病变而来。调整患者的免疫系统去治愈癌症进行的第一次科学尝试可以归功于两位德国医生Fehleisen和Busch,他们各自独立发现丹毒感染后有明显的肿瘤消退。他们都描述了他们的观察并试图重复后来却收效甚微。 最终,Fehleisen设法合理的鉴定化脓性链球菌细菌的菌株引起丹毒和肿瘤缩小。接下来的重大进步来自William Bradley Coley 今天被称为免疫疗法之父。1891年Coley首先尝试利用免疫系统进行治疗骨癌。他直接观察到许多癌症患者在出现丹毒(链球菌性皮肤感染)后自发缓解的病例。 他还研究了19世纪末可供他使用的病历,病原学和医学文献,包括他前辈的著作,并发现了多达47例潜在无法治愈的癌症患者的报告,这些患者在伴随急性细菌感染后自发缓解。自发性肿瘤消退极为罕见,在全世界60,000–100,000癌症患者中,有1个发生。然而,这是一种被广泛接受的现象,病例报告定期在全球当代医学期刊上发表。从1891年起,Coley又向前迈进了一步。他开始将活的和灭活的化脓性链球菌和粘质沙雷氏菌的不同混合物注射到患者的肿瘤中,因此可以说已经开发出了第一个基于免疫的癌症治疗方法。
尽管1893年5月他的成功的临床结果被记录描述,但Coley没有受到医学界的推崇。他从肉瘤,淋巴瘤和睾丸癌开始,在多种类型的恶性肿瘤中获得了持久且完全的缓解,并报告了1000多例退化或完全治愈的患者。尽管取得了成功,但由于缺乏已知的“Coley’s toxins” (可从1899年开始在市场上买到)的作用机制,以及用高致病性细菌感染癌症患者的风险,导致在20世纪初肿瘤学家更喜欢手术和放射疗法。因此,几十年来,Coley的遗产被广泛遗忘,甚至被否认。
对免疫系统的兴趣在1945年之后再次爆发,在免疫和癌症研究方面有许多进展,例如干扰素的发现或Ruth和John Grahams在有史以来第一种癌症疫苗上的成功研究。尽管参与该试验的患者中有22%的患者疾病或癌症缓解稳定,但后者的工作在很大程度上没有引起注意。 T细胞的存在及其在免疫中的关键作用直到1967年才出现,当时雅克·米勒在他的重要“自然”出版物中描述了它们的功能。六年后,树突状细胞被发现,紧接着是自然杀伤细胞(NK细胞)活性的首次描述。同时,免疫学知识的积累使得明尼苏达大学的研究人员和医师得以开创骨髓移植治疗血液系统癌症的方法,该方法至今仍在使用。在最初取得成功之前,已经对移植作为癌症治疗方法的早期试验进行了一个多世纪的测试,主要是在小鼠身上进行的。1914年, Clarence Little在动物模型中提出了移植肿瘤排斥反应的遗传学解释后,人们的努力得到了加强,在首次提出组织相容性抗原参与移植排斥反应的报道后,这一努力在1948年得到了进一步的加强。 最终,在1980年代,第一批基于单细胞表面抗原的疫苗以乙型肝炎的形式出现。疫苗的出现最终使免疫治疗领域崭露头角。人们乐观地认为,免疫治疗可以用于治疗许多疾病,包括癌症,这推动了人们对目前这一状况的研究。
大约五十年前,癌症免疫肿瘤学的先驱Lloyd J. Old教授指出:“癌细胞与正常细胞有所区别,而且这种区别可以被人体的免疫系统识别”。他正确地预测,未来,免疫疗法将与外科手术,化学疗法和放射疗法一起成为癌症的第四种疗法,但他希望进步更快。经过了数十年的深入研究和临床试验,癌症免疫疗法成为治疗癌症的第四大支柱。
1908年,Paul Ehrlich证实了Coley的观察结果,即一些肿瘤被免疫系统的作用自发抑制。与此同时,美国洛克菲勒研究所的墨菲和莫顿进行了小鼠实验,促使他们提出了1915年的假设,即使是免疫细胞受到非特异性刺激,尤其是淋巴细胞,可以为癌症提供治疗。然而,随后几年的人体试验非常不成功,并导致数十年来假说失传,并驳斥了整个癌症免疫疗法的想法。
使用细菌治疗癌症的策略在1976年再次出现,当时进行了一项试验,以检验使用结核病疫苗BacilleCalmette-Guérin(BCG)预防膀胱癌复发的方法效果。这个想法来自于Old和他的团队在1959年进行的一项研究,证明了BCG细菌小鼠对膀胱癌的抗肿瘤作用。卡介苗疫苗是由与导致结核病的细菌密切相关的弱活细菌制成的。将它们以溶液的形式注射入癌症患者的膀胱中并放置在那里数小时,以使细菌可能触发患者的免疫反应。这是一个非常成功的癌症治疗实例,其中涉及活化的巨噬细胞参与肿瘤排斥。BCG治疗已被证明是非常有效的,并且今天仍在非肌肉浸润性膀胱癌中使用。 这也是对Coley原始原则治疗的证实。
细菌感染并非研究人员针对肿瘤免疫应答的潜在诱因的唯一重点。在19世纪初发现病毒后,人们的兴趣集中在病毒性疾病上。 1896年,一名患有白血病的妇女在严重的流感感染后获得了癌症缓解后,美国医师George Dock记录了首次自发性肿瘤缓解。尽管如此,直到二十世纪初,病毒和病毒性疾病才可以通过学术研究与癌症联系起来。
癌症免疫治疗的下一个里程碑是Thomas和Burnet首次提出其出色的癌症免疫监视理论。 1957年,他们首次提出淋巴细胞可能起着前哨的作用,以识别并消除经突变转化的体细胞。同样,缺乏数据和对肿瘤特异性抗原的机制的理解以及技术上体外无法培养淋巴细胞,使得许多进一步的进展都推迟了很多年。1974年,Stutman发现免疫系统功能受损的裸鼠比野生型鼠更容易患上癌症,这是免疫监视理论重新出现。大约在同一时间,自然杀伤细胞被发现,为人类免疫系统的力量提供了额外的支持。 Burnet和Thomas描述了他们在二十世纪中叶对癌症免疫监视的优美假设,但是直到二十世纪末,Schreiber,Dunn,Old及其团队证明T细胞能够提供抗肿瘤监测和抗肿瘤应答。随后的进一步发现包括免疫编辑机制,癌细胞逃逸的证据以及对免疫抑制患者罹患癌症的风险明显更高的认识。
1991年,van der Bruggen及其同事鉴定出第一个被T淋巴细胞识别的人类肿瘤抗原。后来,他们通过克隆黑素瘤抗原编码基因(MAGE)首次鉴定了真正的分子靶标,MAGE是编码一种被细胞毒性T细胞识别的抗原基因。
1890年左右,抗体的发现可以归功于Paul Ehrlich,Emil von Behring和Kitasato。此后,Shibasaburo和小蛋白已成为各种疾病(包括癌症)中公认的治疗形式。它们以多种方式起作用,例如通过防止抗原附着到细胞表面的受体上或标记待破坏的抗原。通常使用单克隆抗体,“单”抗体表示它们是单种抗体。 一种针对特定抗原的抗体,“克隆”表示它们被成千上万倍繁殖,以获得治疗的、临床上有效的剂量。
抗体的主要作用是附着在细胞的抗原上,并标记被专门的免疫系统细胞破坏的癌细胞。一些抗体通过向免疫系统发出信号并触发其进行攻击而发挥作用,而其他抗体可能会中断告知癌细胞生长、分裂和扩散的信号。 Milstein和Köhler于1970年代在实验室中率先开发了单克隆抗体。他们使用了所谓的“杂交瘤”,即由淋巴细胞和骨髓瘤细胞系融合而成的分泌抗体的细胞系。在接下来的几十年中,基于抗体的疗法的研究蓬勃发展,并最终引起了利妥昔单抗的发展,这是一种与未成熟B细胞表面存在的CD20蛋白结合的单克隆抗体。 1997年,利妥昔单抗成为FDA批准用于治疗非霍奇金淋巴瘤的第一种单克隆抗体。该药物靶向未成熟的B细胞,以被NK杀伤细胞消除。
另一个值得一提的重要分子是4-1BB(CD137),它是在80年代后期在活化细胞表面发现的,因此最初被称为人类的“诱导淋巴细胞活化”(ILA)分子。 作为肿瘤坏死因子受体超家族的成员,这种糖蛋白与其在多种细胞类型(包括抗原呈递细胞,活化的B细胞,巨噬细胞和一些肿瘤细胞)上表达的配体(4-1BBL,也称为CD137L)结合。 Melero等人在1997年观察发现该分子在T细胞介导的免疫应答的扩增中起着重要作用,进一步的涉及mAb的实验不仅显示了其在抗癌治疗中的强大作用,而且还重新证实了T细胞介导的免疫应答的证据。进一步的研究支持靶向4-1BB分子通路参与癌症治疗的治疗潜力,导致许多当前正在进行的临床试验。
如果不提及曲妥珠单抗(赫赛汀)那是不正确的,那是一种众所周知的单克隆抗体,它会自身附着于某些类型的乳腺癌细胞上存在的生长因子抗原,从而阻止这些细胞生长,分裂并不可避免地导致死亡。一些单克隆抗体被称为“偶联抗体”,因为它们与另一种化学或放射性试剂相连。 这种化学修饰有助于定位癌细胞和/或破坏癌细胞。
目前在癌症研究中测试的最有希望的抗体是检查点抑制剂,其中几种药物已被FDA批准用于九种以上的癌症类型。 1982年,James Allison及其同事使用单克隆抗体在T细胞淋巴瘤小鼠模型中首次实现了生化鉴定和肿瘤特异性抗原的描述。仅仅一年后,他们确定了第一个T细胞抗原受体。免疫疗法时代已经重新出现,这次成功了。在2000年,第一个ipilimumab临床试验启动,开始了一系列类似研究,直到今天。免疫检查站封锁的概念如今已改变了整个领域,挽救了数千人的生命。为了表明这种靶向治疗方法的成功,FDA已针对具有特定基因组成的每种肿瘤批准了一种药物,这是从传统的原发性组织癌治疗方法到治疗分类的一项进步。 1987年发现了第一个免疫检查点分子,并由Brunet及其团队将其命名为细胞毒性T淋巴细胞抗原4号(CTLA-4)。然而, 1995年它的功能仍然不清楚,直到Jim Allison等人指出它是至关重要的免疫检查点分子,具有作为未来抗癌治疗靶标的巨大潜力。
一年后,即1996年,第一个CTLA阻断抗体被立即开发并在动物身上进行了测试。2011年,FDA批准的第一个检查点抑制剂是伊匹木单抗,用于治疗晚期黑色素瘤。如今,它已被批准用于多种癌症类型,最有希望的结果是,在首次ipilimumab临床试验(2011年批准之前)中,有20%以上的患者仍然活着并且没有疾病迹象。
另一个检查点抑制剂nivolumab在2014年问世,是FDA批准的首个PD-1分子抑制剂。 2014年,Nivolumab成为日本首个获得监管部门批准用于黑色素瘤治疗的PD-1抑制剂。在接下来的4年中,PD-1受体或其配体PD-L1和PD-L2的其他几种抑制剂pembrolizumab,atezolizumab,Durvalumab和avelumab在全球范围内被批准,显示出几种癌症类型的显著改善。 Atezolizumab(以前称为MPDL3280A)是PD-L1蛋白的另一个检查点抑制剂,于2016年获批准用于治疗黑素瘤,肺癌,膀胱癌以及自2019年3月起用于三阴性乳腺癌的治疗。
已知所有上述免疫检查点分子,包括细胞毒性T淋巴细胞抗原4(CTLA-4)或程序性细胞死亡1(PD-1)及其配体(PD-L1和PD-L2)均表达在肿瘤-浸润淋巴细胞(TIL)以及一些肿瘤细胞上。当在肿瘤部位表达时,它们可使癌细胞逃避免疫反应,因此免疫检查点的阻断是癌症治疗中的关键突破。使用先前的常规治疗,预计上述药物的临床试验中仅约4%的患者将活到今天。得益于收到的抗体,这一百分比要高得多,到目前为止,幸存的黑素瘤和肺癌试验患者中有16%至30%(在某些报告中高达50%)。
细胞因子是几种免疫系统细胞天然产生并分泌的小蛋白质。它们对于免疫细胞之间以及免疫细胞与体内其他几种细胞类型之间的信号传递至关重要。第一个被发现的细胞因子是1957年Isaacs和Lindenmann对干扰素α进行了描述,也被称为I型。 IL-2,即T细胞生长因子白介素2,于1976年被鉴定,并允许研究人员首次在体外培养T淋巴细胞。 IL-2于1983年克隆,并立即用于临床试验,从而产生了令人鼓舞的结果,包括肿瘤缩小。如果通过增强T淋巴细胞的产生对转移性癌症患者进行大量给药,它被证明是有效的。因此,通常被称为“免疫刺激性细胞因子”。美国FDA于1991年批准将白介素2用作免疫疗法,用于治疗转移性肾癌,1998年用于转移性黑素瘤。
癌症免疫疗法正在改变癌症治疗模式,但是对几种现有治疗类型的反应率仍然很低。至少部分可以通过宿主先前不存在的抗肿瘤免疫力来解释。此外,癌症的标志之一是避免免疫系统的潜在攻击,逃避免疫控制并保持免疫细胞不可见。重要的是要记住,肿瘤由癌细胞组成,但也由基质特征组成,例如成纤维细胞,血管和浸润性免疫细胞等。所有这些元素统称为肿瘤微环境(TME),并且对免疫治疗的成功至关重要。肿瘤固有的免疫抑制功能还可抑制效应T细胞功能,尤其是TME中的缺氧或乳酸水平升高的区域。实际上,TME在个体和不同肿瘤本身之间变化很大,因此许多临床前和临床试验都针对与TME相关的新靶标,尤其是TME介导的免疫抑制途径。在这些途径中,被最广泛研究的途径是:肿瘤细胞表面I类MHC的下调(以避免被CD8 +效应细胞检测到),FAS和/或TRAIL分子的下调(以避免肿瘤细胞杀伤),以及靶向关键酶(例如吲哚胺2,3-二加氧酶,IDO酶)或几种细胞因子,例如VEGF,TGFb或IL-10。也有正在进行的研究针对免疫介质(例如豆荚菌素),细胞色素(例如CYP450)的治疗方法,或建议使用纳米技术来消除现有的TME抑制作用。
用于癌症化学疗法的大多数药物具有免疫抑制作用。此外,近50年前已经注意到,一些患者在治疗原始肿瘤的同时在不同位置出现了新的肿瘤。此外,在免疫抑制患者中观察到癌症的发病率增加,这至少部分归因于1995年Treg的作用。在所有的肿瘤浸润细胞中,调节性T细胞(Tregs)在调节免疫破坏,通过多种途径促进免疫抑制,尤其是免疫抑制细胞因子的分泌中起着至关重要的作用。 TME中存在的其他细胞,例如髓样衍生的抑制细胞(MDSC),肿瘤相关巨噬细胞(TAM)和肥大细胞,通常在TME中上调,从而阻止免疫系统消除肿瘤细胞。
最后,TME内部存在肿瘤相关的巨噬细胞,特别是M2型,与预后不良有关。作为浸润人类肿瘤的最丰富的细胞,它们能够抑制免疫反应。因此,最近发明了几种靶向肿瘤浸润巨噬细胞的疗法,例如用抗菌落刺激因子1抗体消耗巨噬细胞计数。
可能没有任何一项医学创新会对疫苗和全球健康产生比对疫苗的发明和开发更为重要的影响。正如我们的免疫系统不断工作以预防感染,保护我们免受潜在有害细菌,病毒和寄生虫的侵害一样,免疫系统在预防癌症中也起着关键作用。通过预防感染或通过“教”免疫系统细胞识别并杀死癌细胞,可以增强这种功能。在过去的二十年中,已经使用了几种FDA批准的癌症预防疫苗。这些疫苗包括乙型肝炎(HBV)疫苗和人乳头瘤病毒(HPV)疫苗,它们都可以防止致癌病毒感染。病毒致癌作用的影响越来越明显,通过疫苗接种进行预防是降低此类癌症发生率的最重要,最有效的方法。
除了HPV和HBV等疫苗的预防作用外,针对现有癌症的疫苗也进行了深入,持续的研究,这是癌症免疫遗传学家和免疫肿瘤学家的长期目标。也许可以使用治疗性癌症疫苗来治疗已经出现的癌症?众所周知,某些癌细胞可以逃避免疫细胞,甚至抑制其活性,并且在体内存在很多年都没有引起人们的注意。许多类型的癌细胞可以在其表面表达针对免疫抑制检查点蛋白的特异性配体,从而阻止免疫系统攻击正在生长的肿瘤。后来它们开始不受限制地分裂和扩散,导致组织损伤,肿瘤形成并最终死亡。
治疗性癌症疫苗有两种主要类型,自体和同种异体癌症疫苗。第一类是基于患者自身细胞的个性化癌症疫苗,基于癌细胞或免疫系统细胞。这些细胞取自个体,在实验室进行处理和繁殖,然后重新注入患者的循环系统中。经过处理的细胞识别癌细胞并触发针对癌症的免疫反应。这种类型的治疗方法将与其他癌症疗法(例如手术或放射疗法)一起使用,以消除痕量的持久性癌细胞。理想情况下,某些记忆细胞会保留在患者系统中,并承诺如果癌细胞再次出现,它们可能会立即做出反应。
在疫苗临床试验中也取得了早期成功,该临床试验涉及多种具有癌症特异性的新抗原,这些新抗原具有很高的患者特异性。新抗原是由突变基因编码的抗原,并存在于肿瘤表面,因此,由于它们在癌症免疫治疗中的重要作用,近年来已对其进行了广泛的研究。肿瘤特异性的体细胞突变的结果是,正常组织细胞表面上不存在新抗原。它们具有高度的免疫原性,可以激活CD4 +和CD8 +免疫反应,为基于T细胞的癌症免疫疗法提供了理想的靶点。多项临床前研究已经表明,靶向新抗原的癌症疫苗在肿瘤小鼠模型中的可行性和有效性,对于例如结肠癌,黑素瘤,神经胶质瘤和肉瘤。尽管仍处于早期阶段,但当Blumenthal和E.von Leyden尝试为其疫苗接种时,基于新抗原的疗法与其他类型的免疫疗法(例如检查点抑制剂)以及常规治疗相结合的方法已经在研究中。患者使用源自患者自身的肿瘤组织来抵抗癌症。作为疫苗,他们使用了自体肿瘤细胞悬液并将其施用于数名患有晚期癌症的患者。注意到一些主观的改善,但没有明显的肿瘤减少。
过继性细胞疗法(ACT)涉及分离患者的T细胞(最近也称为NK细胞),这些细胞是肿瘤特异性的,在实验室中对这些细胞进行修饰和繁殖,然后重新注入患者体内。修饰细胞的方法有很多,但最成功的方法之一是CAR T细胞疗法,有时被称为ACT的一种。 1989年报道了以这种方式衍生和修饰的基因工程T细胞首次用于靶向癌细胞。嵌合抗原T细胞(CAR T细胞)于1990年代中期首次被描述,但由于技术上的复杂性和知识上的差距而只能在几年后得到纠正,因此在临床前研究或早期临床试验中均未成功。 CAR T细胞疗法取得了巨大的成功,尽管它并非没有问题,因为几名患者出现了细胞因子风暴,如果不及时治疗可能会致命的不良反应。儿童是首个被FDA批准用于CAR T细胞疗法的疾病(2017年),其次是在2018年被批准用于弥漫性大B细胞淋巴瘤和某些其他类型的淋巴瘤。
溶瘤病毒疗法是一类革命性的新兴癌症疗法,难以明确分类。它们位于癌症的免疫疗法和生物疗法之间,并使用现有的生物制剂治疗癌症。转基因病毒缺乏初始毒力,但仍能够穿透并裂解癌细胞。破裂,垂死的癌细胞释放出许多分子,这些分子进一步吸引免疫系统细胞,加剧了该部位的免疫攻击和整体炎症潜能。第一种溶瘤病毒T-VEC在2015年被FDA批准用于治疗转移性黑色素瘤。 T-VEC是单纯疱疹1病毒,经过基因改造,使其能够表达粒细胞巨噬细胞集落刺激因子(GM-CSF),一种强大的细胞因子,可吸引多种类型的免疫细胞。将注射剂直接注射到肿瘤部位,尤其是在转移部位和不能通过手术切除的部位。在临床试验中显示出令人鼓舞的结果的其他溶瘤病毒包括Pexa-Vec(抗肝细胞癌),CG0070(抗膀胱癌)和G471(抗胶质母细胞瘤和前列腺癌)。
尽管取得了成功的结果,但使用溶瘤病毒至少有一个重要的缺点:它是针对特定病毒的获得性免疫力。如果再次使用,可能会有效干扰同一位患者的任何重复治疗。
了解免疫肿瘤疗法的最重要挑战之一是患者免疫系统与癌症生物学之间复杂的相互作用。尽管如此,癌症是细胞群体,所有群体都受到进化力的影响。如今,免疫肿瘤学领域出现了许多新兴趋势,其中最有希望的是检查点抑制剂,嵌合抗原T细胞(CAR T细胞)和过继性T细胞疗法(ACT)。自2017年以来,CRISPR / Cas9基因编辑技术已用于开发CAR T细胞。在2018年底,又出现了另一项突破:将小鼠和人类成纤维细胞直接重编程为免疫系统细胞,特别是抗原呈递树突状细胞,开辟了新的治疗可能性。我们的免疫系统具有令人难以置信的记忆致病抗原的能力,因此免疫疗法有望为成功治疗癌症和实现长期缓解提供独特的机会。
据估计,每个癌细胞与肿瘤周围的健康细胞相比,有超过11,000个基因组突变差异。一些导致与肿瘤相关的抗原在细胞表面表达,因此成为新的基于抗体的疗法的潜在靶标。另一方面,已知一些肿瘤会失去其MHC I类表达,仍然是巨大的免疫疗法挑战。此外,众所周知,整个肿瘤微环境都会影响癌症的生长,发展并介导潜在的治疗方法,包括微生物组。粪便微生物群移植(FMT)的一些初步试验已经进行,并取得了可喜的结果。
相关生物标志物的鉴定是该过程的关键部分。对于免疫检查点抑制剂,尽管在药物水平较低的情况下报告了良好的预后,但仍在给药前测量了CTLA-4,PD-1或PD-L1基因的表达水平。众所周知,总体突变负荷更大的肿瘤大多对检查点抑制剂治疗有反应。此外,已知由于失配修复缺陷而导致微卫星不稳定性的癌症对PD-1阻断表现出特别强烈的反应,而与癌症类型无关。科学中最重要的挑战之一是发现为什么有些患者对免疫疗法的反应如此完美,而另一些患者对这种形式的治疗则完全不敏感。此外,一些患者被认为在免疫治疗后会发展为癌症,并且这种罕见反应的原因仍然未知。肿瘤学中的免疫疗法已在许多患者中显示出令人鼓舞的反应,但获得性耐药也可能是一个真正的挑战。复发的潜在机制包括下调肿瘤抗原的表达,因此T细胞不再识别肿瘤细胞,宿主T细胞功能的丧失以及靶癌细胞中逃逸突变变体的可能发展。临床研究和对新药物的寻找超越了我们目前在前沿免疫疗法和免疫肿瘤学方面的知识。如果要发现新的更好的癌症疗法并改善现有的癌症疗法,就必须紧急加大对基础科学研究的资金和支持,使免疫系统与癌细胞之间复杂而令人着迷的相互作用发挥作用。
原文来源:
Dobosz P, Dzieciątkowski T. The Intriguing History of Cancer Immunotherapy[J]. Frontiers in Immunology, 2019, 10.
扫描上面二维码在移动端打开阅读