
李媛
肺癌分子诊断不同技术平台的比较和选择
在精准医学时代,精准诊断是精准治疗的前提。目前,非小细胞肺癌(NSCLC)已经进入多基因检测、多靶点治疗的时代,对NSCLC患者来说,基于基因检测的分子分型和药物治疗策略同等重要。亚裔人群NSCLC患者分子变异谱不同于西方人群,主要体现在腺癌,包括常见变异基因EGFR(45-55%)、KRAS(8-10%)、ALK(5-10%),少见变异基因ROS1(2-3%)、MET(2-4%)、HER2(2-4%)、BRAF(1-2%)、RET(2-4%),以及罕见变异基因NTRK(<1%)等。在病理形态学诊断的基础上,需要充分利用各类分子诊断技术平台(包括IHC、PCR、FISH、NGS等)对NSCLC驱动基因进行检测,为临床治疗方案提供依据。本文介绍这几种技术平台,并比较这些平台的优缺点以及实际工作中应该如何选择这些平台。
01
免疫组织化学(Immunohistochemistry,IHC)
» 1.1 平台介绍
IHC技术利用抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及定量[1]。为减少手工染色中常见的人为操作误差,发展出了全自动免疫组化染色平台,创建标准化的实验流程,其优势是快速高效、重复性好、标准化程度高,为临床诊断提供更准确、更科学的检测结果[2]。
» 1.2 样本要求
» 1.2.1组织样本
组织样本可以是冰冻切片或石蜡切片。组织取材时需注意刀口锋利以免组织受挤压,取材主要取病变区、病灶与正常组织交界处,必要时取病灶周围的正常组织做对照。将组织切片至涂有多聚赖氨酸的玻片上。肺穿刺活检或支气管镜活检等方法获得小标本需连续切片。
» 1.2.2 细胞学标本
细胞学标本取材主要有印片法、穿刺吸取涂片法和体液沉淀涂片法。细胞数量多时可直接涂片,细胞数量少则离心沉淀涂片。对找到肿瘤细胞或可疑肿瘤细胞标本均应尽可能制作与活检组织固定程序规范要求一致的福尔马林石蜡包埋(formalin-fixed paraffin-embedded,FFPE)细胞学蜡块,经病理质控后,均可进行相关驱动基因改变检测[3-4]。细胞学标本分型及来源判断所采用的免疫细胞化学染色(immunocytochemistry,ICC)指标及结果判读标准均同组织学标本。
» 1.3 检测靶点
» 1.3.1 肺癌鉴别诊断标志物
《中国临床肿瘤学会CSCO非小细胞肺癌诊疗指南》中提出[5],形态学不明确的 NSCLC,手术标本使用一组抗体鉴别腺癌、鳞癌,手术标本应给出明确亚型,其中 AIS,MIA,附壁型为主的腺癌、肉瘤样癌、腺鳞癌、大细胞癌,以及神经内分泌癌中的类癌、不典型类癌等类型,因需要充分观察标本病理改变或评估肿瘤类型所占比例,手术标本可明确诊断;晚期活检病例,尽可能使用 TTF-1、P40 两个免疫组化指标鉴别腺癌或鳞癌。小细胞癌标记物有:CD56, Syn,CgA,TTF-1,CK,Ki-67;腺癌、鳞癌鉴别标记物有:TTF-1,NapsinA,P40 ,CK5/6(P63)。
» 1.3.2 免疫治疗生物标志物PD-L1
《中国临床肿瘤学会CSCO非小细胞肺癌诊疗指南》中将组织标本采用免疫组化法检测 PD-L1表达作为1类证据提出,免疫检查点抑制剂(PD-1单抗或 PD-L1单抗)已经证实可用于治疗局部晚期或转移性 NSCLC。多项研究结果显示,PD-L1表达与免疫检查点抑制剂疗效呈正相关。免疫检查点抑制剂作为后线治疗或与含铂双药方案联合作为一线治疗时,PD-L1表达的检测并非强制性的,但该检测可能会提供有用的信息。基于KEYNOTE 024 及 KEYNOTE 042 研究的结果,帕博利珠单抗单药作为一线治疗时,需检测 PD-L1表达。免疫检查点抑制剂对于驱动基因阳性(EGFR 突变、ALK 融合和 ROS1 融合等)患者的疗效欠佳,通常不进行PD-L1检测[5]。
NCCN 非小细胞肺癌指南建议在EGFR突变、 BRAF V600E 突变、ALK重排和ROS1重排的检测结果为阴性或未知时,推荐在转移性NSCLC患者一线治疗前进行PD-L1检测(1A类)[6]。
» 1.4 优缺点
IHC平台的优点:(1)成本低、判读方便,便于在病理科开展。(2)方法步骤统一,可以实现平台全自动化,减少实验误差;(3)原位检测,实现定性、定位、定量的统一。IHC技术在细胞及亚细胞水平原位检测抗原分子,是其他任何生物技术难以达到和替代的。
IHC平台的缺点:(1)无法实现突变检测和核酸定量分析。(2)在PD-L1检测中,不同的免疫检查点抑制剂对应不同的 PD-L1免疫组化抗体。使用不同的检测抗体和平台,PD-L1阳性的定义存在差异,临床判读需谨慎。
02
聚合酶链式反应(polymerase chain reaction,PCR)
» 2.1 平台介绍
PCR是一种体外迅速扩增DNA片段的技术,通过温度变化控制DNA的变性和复性,通过设计特异性的引物、加入DNA聚合酶、dNTP就可以完成特定基因的体外复制。它能以极少量的DNA为模版,在几小时内复制出上百万份的DNA拷贝。目前主流的PCR平台包括:改良PCR技术的突变扩增系统(amplification refractory mutation system, ARMS)、数字PCR。
ARMS技术平台的核心在于突变特异性探针,该探针由连接到3'和5'末端的荧光团和猝灭剂组合而成。存在突变时,探针与靶位点结合发生聚合酶反应, 促使荧光团和猝灭剂分离,荧光含量增加后对其检测和测量;反之,荧光标记物难以测出,适用于特定位点突变的检测。
数字PCR(Digital PCR,dPCR)是高灵敏核酸绝对定量分析技术,通过把反应体系均分到大量独立的微反应单元中进行PCR扩增,并计算核酸拷贝数实现定量分析。与传统PCR技术相比,dPCR技术不依赖于标准曲线,具有更高灵敏度、准确度及高耐受性,可实现对样品的绝对定量分析。尤其适用于微量或痕量DNA的检测与定量。
» 2.2 样本要求
» 2.2.1 石蜡组织提取DNA
《中国临床肿瘤学会CSCO非小细胞肺癌诊疗指南》建议,为了避免样本浪费和节约检测时间,在病理诊断的同时,一次性切出需要诊断组织学类型和进行EGFR突变、ALK融合及ROS1融合检测的样本量。如果样本不足以进行分子检测,建议进行再次取材,确保分子检测有足够样本。经病理评估后的特定肿瘤区域用于DNA样本提取。原发肿瘤和转移灶都适于进行EGFR突变、ALK融合及ROS1融合分子检测。
» 2.2.2 外周血提取ctDNA
《中国临床肿瘤学会CSCO非小细胞肺癌诊疗指南》中提出:肿瘤标本无法获取或量少不能行基因检测时,可通过外周血游离/肿瘤 DNA(cf/ctDNA)进行 EGFR突变检测;EGFR TKIs耐药患者,建议再次活检进行 EGFR T790M检测。不能获取肿瘤标本的患者,建议行cf/ctDNA EGFR T790M检测,数字PCR是高灵敏度且可以绝对定量的检测方法,适用于外周血cfDNA、ctDNA等低浓度样本的检测[7-9]。
» 2.3 检测靶点
» 2.3.1 EGFR突变检测
亚裔人群和我国的肺腺癌患者 EGFR基因敏感突变阳性率为40%~50%。EGFR突变主要包括4种类型:外显子19缺失突变、外显子21点突变、外显子18点突变和外显子20插入突变。最常见的EGFR突变为外显子19缺失突变(19DEL)和外显子21点突变(21 L858R),均为EGFR-TKI 的敏感性突变,18外显子G719X、20外显子 S768I和 21外显子L861Q突变亦均为敏感性突变,20外显子的 T790M突变与第一、二代 EGFR-TKI 获得性耐药有关,还有许多类型的突变临床意义尚不明确[5]。
» 2.3.2 其他驱动基因突变检测
PCR技术平台开展的其他肺癌驱动基因突变检测包括:KARS基因G12X、G13X突变、BRAF基因V600E突变、MET基因14外显子跳跃突变、FGFR3基因S249C突变、HER2基因20外显子突变。此外,PCR平台还可以检测MET扩增和HER2扩增[10]。
» 2.4 优缺点
PCR平台的优点是灵敏度高,适用范围广,可以实现一次性多靶点检测。缺点是影响因素多,可能出现假阳性结果,需严格控制实验环境污染和标本间交叉污染。应在具有认证资质的PCR实验室中进行,并设置严格的质控措施(内对照、阳性对照、阴性对照)。
03
荧光原位杂交技术(Fluorescence in situ hybridization,FISH)
» 3.1 平台介绍
荧光原位杂交技术的基本原理是利用与待检测的染色体或靶DNA同源互补核酸探针,经变性—退火—复性,形成靶DNA与核酸探针的杂交体。将核酸探针的某一种核苷酸标记上报告分子如生物素、地高辛,可利用该报告分子与荧光素标记的特异亲和素之间的免疫化学反应,经荧光检测体系在镜下对待测DNA进行定性、定量或相对定位分析。荧光原位杂交技术能够检测染色体结构变异,可以较容易地检测出缺失、附加或替换的染色体。
» 3.2 样本要求
肺癌可用于FISH检测的标本也包括组织样本和细胞样本。样本要求基本与IHC检测的要求一致。对于恶性胸腔积液或心包积液等细胞学样本在细胞数量充足条件下可制备细胞学样本蜡块,进行FISH检测,考虑到细胞学样本的细胞数量少等特点,细胞学标本的检测结果解释需格外谨慎。《中国临床肿瘤学会CSCO非小细胞肺癌诊疗指南》指出,在肺癌中,目前对于 ALK 融合及ROS1融合基因的血液检测,技术尚不成熟,因此对于 ALK/ROS1融合基因检测,仍该尽最大可能获取组织或细胞学样本进行检测[5]。
» 3.3 检测靶点
FISH检测主要用于肺癌中ALK、ROS1、RET、NTRK、FGFR3等基因的融合、易位的检测[10]。
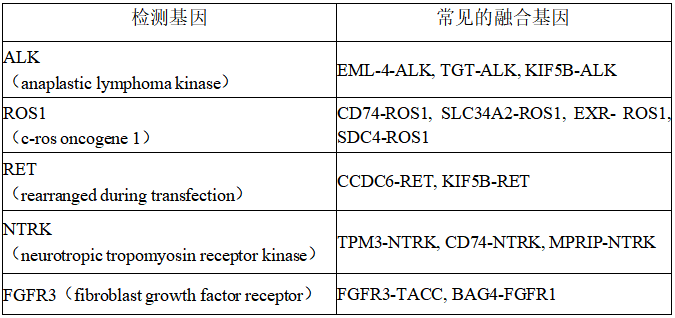
表1 FISH平台检测的基因及靶点
其中,《中国临床肿瘤学会CSCO非小细胞肺癌诊疗指南》指出,ALK融合及 ROS1融合的检测应在患者诊断为晚期NSCLC时即进行。该类阳性的肺癌患者通常可从 ALK抑制剂治疗中获益。ROS1 融合是NSCLC的另一种特定分子亚型。已有多个研究表明晚期ROS1融合的NSCLC克唑替尼治疗有效[5]。
» 3.4 优缺点
FISH技术平台的优点:(1)应用广泛,可用于染色体变异,基因突变,基因拷贝数变化的检测;(2)荧光试剂和探针经济、安全,探针稳定,一次标记后可在两年内使用;(3)实验周期短、能迅速得到结果、特异性好、定位准确;(4)多色FISH通过在同一个核中显示不同的颜色可同时检测多种序列;缺点:(1)步骤繁多,容易造成信号丢失,造成假阴性结果,对技术及判读要求较高;(2)只能定性检测,不能定量;(3)不能达到100%杂交,特别是在应用较短的cDNA探针时效率明显下降。
04
测序技术平台
» 4.1 平台介绍
测序技术平台目前主要包括:Sanger法测序(一代测序)和NGS(下一代测序技术):其基本原理是利用DNA聚合酶来延伸结合在待定序列模板上的引物,使延长的寡聚核苷酸选择性地在标记了不同荧光信号的碱基上终止,从而将序列信号读取为荧光信号并输出。NGS又称高通量测序,以高输出量和高解析度为主要特色,能一次并行对几十万到几百万条DNA分子进行序列读取,在提供丰富的遗传学信息的同时,还可大大降低测序费用、缩短测序时间。
» 4.2 样本要求
测序技术平台所用的样本也主要包括石蜡组织提取DNA和外周血提取的ctDNA,要求基本与PCR平台一致。
» 4.3 检测靶点
» 4.3.1 肺癌驱动基因的突变、融合、扩增检测
测序技术可以检测靶点非常广泛,包括PCR平台和FISH平台对各类肺癌驱动基因的突变、融合、扩增检测的所有靶点检测。NGS可一次性检测多个靶点,包括EGFR基因突变、ALK融合基因、ROS1融合基因外,还应包括MET基因第14号外显子跳跃突变、MET基因扩增、HER2基因突变或扩增、BRAF突变、KRAS突变、RET基因重排、NTRK家族基因重排等。这些驱动基因均为NSCLC中重要的驱动基因异常,并是潜在的治疗靶点。
» 4.3.2肿瘤突变负荷(tumor mutational burden,TMB)
TMB是肿瘤基因组去除胚系突变后的体细胞突变数量,是指每百万碱基中被检测出的体细胞基因编码错误、碱基替换、基因插入或缺失错误的总数。TMB的高表达可以增加免疫原性和新抗原数量并易于被T细胞识别,从而增加抗肿瘤免疫反应,TMB可能预测免疫检查点抑制剂疗效。利用NGS多基因组合估测TMB是临床可行的方法。在组织标本不足时,利用ctDNA进行TMB估测是潜在可行的技术手段[11-12]。
Checkmate-026 研究结果显示,对于 PD-L1≥5%且初治的晚期肺癌患者,Nivolumab较标准化疗未能延长无进展生存期,而对于TMB水平高的患者,用Nivolumab 进行治疗后,肿瘤缓解和生存获益的结果都显著优于化疗[13];CheckMate-227研究证实了Nivolumab联合Ipilimumab 治疗高TMB的NSCLC患者,相较于化疗组可明显提高1年无疾病生存率(42.6%对13.2%)[14];CheckMate-568研究提示无论 PD-L1表达水平如何,TMB≥10 mut/Mb均与Nivolumab联合Ipilimumab治疗的应答增强有关,客观缓解率(ORR)>40%[15],以上研究均证实了TMB作为生物标志物的有效性。随后有学者证实了外周血肿瘤突变负荷(bTMB)可准确重复测量,并且与免疫检查点抑制剂疗效相关,证实了bTMB对免疫治疗药物疗效预测的有效性[16]。尽管TMB在多项临床试验中均表现出良好的预测作用,但由于肿瘤免疫机制及微环境尚未完全探索清楚、TMB检测cut-off值不统一,在应用层面尚未形成共识,仍需更多的前瞻性研究证实 TMB 的预测作用。
» 4.4 优缺点
NGS的优点是节约样本量,适合同时对多个靶点进行检测。近年来,多项研究采用 NGS 针对晚期 NSCLC 进行多基因检测,如目前可作为治疗靶点的基因变异:EGFR突变(包括 T790M 突变),KRAS 突变,ERBB2(HER2)扩增/突变,ALK 融合,ROS1 融合,BRAF V600E突变,RET重排,MET扩增,MET-14外显子跳跃突变及NTRK融合等。NGS的标本可为组织或外周血游离DNA。但目前,由于成本高、检测市场缺乏统一规范、中国市场尚无针对部分靶点的靶向治疗药物等因素限制了 NGS的常规临床应用[5]。
[12] WANG ZJ, DUAN JC, CAI SL, et al. Assessment of Blood Tumor Mutational Burden as a Potential Biomarker for Immunotherapy in Patients With Non–Small Cell Lung Cancer With Use of a Next-Generation Sequencing Cancer Gene Panel. JAMA Oncol, 2019, 5(5):696-702.
扫描上面二维码在移动端打开阅读





