变态反应性哮喘动物模型的开创性研究表明,选择性中和IL-13可以减少气道超敏反应(AHR)、支气管肺泡灌洗(BAL)嗜酸性粒细胞和粘液过度产生。此外,IL-13进入气道引起了所有这些影响[1][2]。IL-13在小鼠肺内过表达可引起黏液高分泌、上皮下纤维化、嗜酸性粒细胞浸润和嗜酸性粒细胞浸润[3]。在慢性哮喘小鼠模型中,给予抗IL-13可抑制气道中嗜酸性粒细胞的募集、杯状细胞增生和上皮下纤维化,但仅略微抑制AHR[4]。一种通过将小鼠IL-13肽插入病毒载体蛋白而制备的IL-13疫苗,可诱导持续而强烈的抗IL-13 IgG抗体,并可抑制卵蛋白(OVA)诱导的急性气道过敏反应[5]。
与健康人相比,在哮喘患者的血液[6]、痰、支气管粘膜[7]和BAL液中[8]发现IL-13浓度增加。IL-13mRNA的过度表达[9]和痰T细胞的体外刺激[10]证实了哮喘中IL-13表达的增加。在过敏原攻击后,BAL中IL-13升高。一些研究表明IL-13在哮喘患者的支气管活检组织中表达。哮喘患者循环中IL-13+ILC2升高,水平与哮喘严重程度相关[11]。
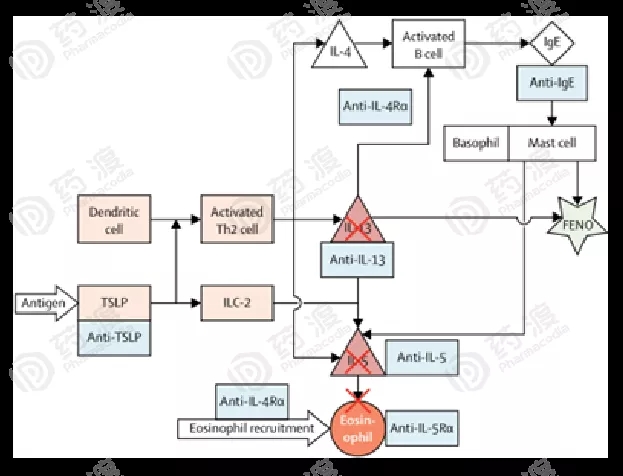
与哮喘2型炎症途径相关的生物制品和生物标志物示意图如下图1所示。
图1.与哮喘2型炎症途径相关的生物制品和生物标志物示意图[12]
Tralokinumab在2008年1月开始开展哮喘的临床二期试验,Lebrikizumab在2008年12月也启动了临床二期试验。
值得注意的是,嗜酸性食管炎患者对dupilumab的反应显示上皮嗜酸性粒细胞减少了92%,dupilumab阻断了白细胞介素4和白细胞介素13的信号[21]。Dupilumab(NCT02573233)在持续性哮喘患者中的快速研究结果值得期待。在严重的持续性哮喘患者中,使用dupilumab可以减少48%的恶化,尽管血液中的嗜酸性粒细胞有短暂的增加,这反过来表明气道中的嗜酸性粒细胞可能已经减少,尽管没有直接测量组织中的嗜酸性粒细胞[22]。
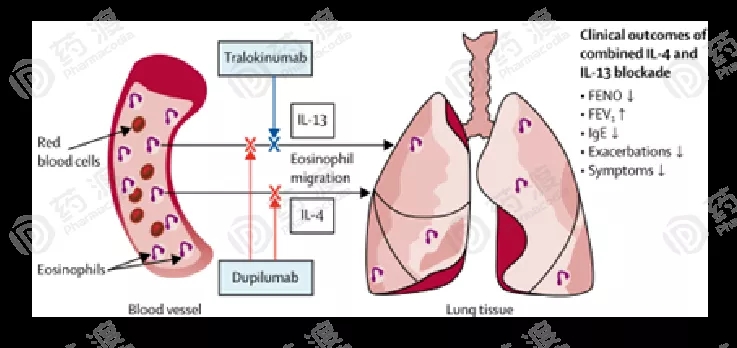
图2.IL-4和IL-13的阻断[12]
特应性皮炎(atopic dermatitis,AD)是一种慢性、复发性、炎症性皮肤病。过去30年全球范围内AD患病率逐渐增加,发达国家儿童AD患病率达10% ~ 20%,我国AD患病率的增加晚于西方发达国家和日本、韩国,但近 10 年来增长迅速。1998 年我国采用Williams诊断标准进行的流行病学调查显示,学龄期青少年(6 ~ 20 岁)AD 的总患病率为 0.70%,2002年10城市学龄前儿童(1 ~ 7岁)的患病率为2.78%,2012年上海地区 3 ~6 岁儿童患病率达8.3%。2014年,采用临床医生诊断标准,我国12个城市 1 ~ 7 岁儿童 AD 患病率达到 12.94%,1-12月婴儿AD患病率达30.48%[24]。
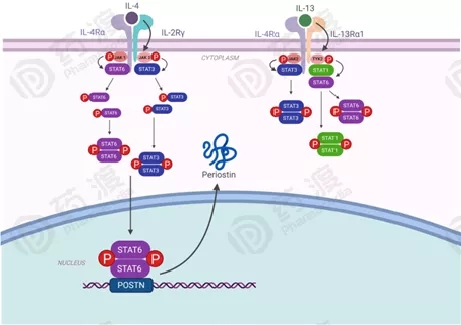
图3.IL-4和IL-13信号通路通过JAK-STAT信号级联
针对IL13进行的哮喘开发经历了多次失败,dupilumab是IL13领域治疗哮喘的最后一丝曙光吗?治疗特异性皮炎的高歌猛进似乎在让Tralokinumab、Lebrikizumab忘却了曾经哮喘治疗的惨败。有研究者提出IL-13很可能不是严重哮喘发病机制复杂网络中的主要细胞因子,也有研究者提出用于识别抗IL-13治疗应答者的生物标志物(如Periostin、DPP-4、外周血嗜酸性粒细胞计数)并不理想等等。相信随着未来哮喘基础病理学机制的逐步阐明与相关临床试验的开展研究会给我们一个明确的答案,同时特异性皮炎的三期临床结果值得期待。
参考文献:
1. Science 282, 2261–2263. doi:10.1126/science.282.5397.2261
2. Science 282, 2258–2261. doi:10.1126/science.282.5397.2258
3. J. Clin. Invest. 103, 779–788. doi:10.1172/JCI5909
4. Am. J. Respir. Crit.Care Med. 170,1043–1048. doi: 10.1164/rccm.200405-681OC
5.J.Respir. Crit. Care Med. 176, 439–445.doi: 10.1164/rccm.200610-1405OC
6.Roleof IL-13 genetic variants in signalling of asthma. Inflammation 40,566–577.doi: 10.1007/s10753-016-0503-3
7. J. Allergy Clin. Immunol. 114,1106–1109. doi:10.1016/j.jaci.2004.08.032
8.Respir.Med. 94, 806–814. doi: 10.1053/rmed.2000.0826
9.Thorax61, 202–208. doi: 10.1136/thx.2005.052399
10.Allergy33, 1238–1243. doi:10.1046/j.1365-2222.2003.01762.x
11. Eur. Respir.J. 9, 899–904. doi:10.1183/09031936.96.09050899
12. Lancet Respir Med 2018; 18:30275–3.
13. Respir. J. 41, 330–338. doi:10.1183/09031936.00223411
14. Lancet Respir. Med. 3, 692–701.doi: 10.1016/S2213-2600(15)00197-6
15.LancetRespir. Med. 6, 499–510. doi: 10.1016/S2213-2600(18)30201-7
16.LancetRespir. Med. 6, 511–525. doi: 10.1016/S2213-2600(18)30184-X
17.J.Allergy Clin. Immunol.Pract. 2661–2671. doi: 10.1016/j.jaip.2019.05.030
18. Eur. Respir. J. 53, 1800948. doi:10.1183/13993003.00948-2018
19.N.Engl. J. Med. 365,1088–1098. doi: 10.1056/NEJMoa1106469
20.Thorax70, 748–756. doi: 10.1136/thoraxjnl-2014-206719
21.WorldCongress of Gastroenterology at ACG2017; Orlando, FL; Oct 13–18, 2017. Abstract20.
22.NEngl J Med 2018; 378: 2486–96.
23. Lancet Respir Med 2018; 18:30275–3.
24.中国特应性皮炎诊疗指南(2020版)
25.https://doi.org/10.1007/s40265-020-01335-7
26. J Allergy ClinImmunol.2019;143(1):135–41.
27. Lancet Respir Med 2018; 18: 30275–3.
28. Drug MetabPharmacokinet.2018;33(3):150–8.
29. J Am Acad Dermatol.2018;78(5):863-71e11
30. JAMA Dermatol. 2020. https://doi.org/10.1001/jamadermat ol.2020.0079.
扫描上面二维码在移动端打开阅读