近日(2020年9月7日),据CDE官网显示,再鼎医药的CD20xCD3双特异性抗体REGN1979获批临床。
REGN1979是通过再生元双特异性抗体平台创造的目前临床进展最领先的双特异性单克隆抗体。4月8日,再鼎医药以3000美元预付款+1.6亿美元的里程碑付款从再生元那获得REGN1979中国开发权益。
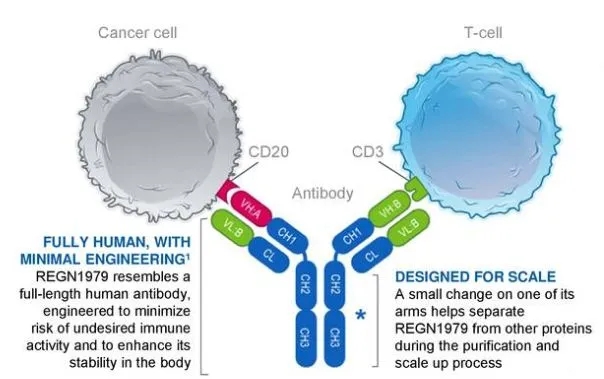
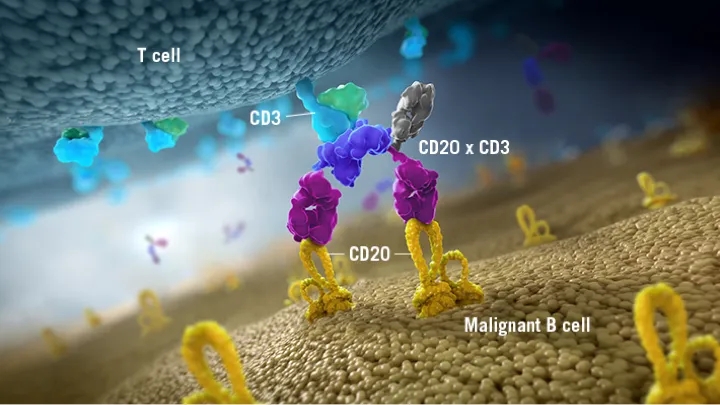
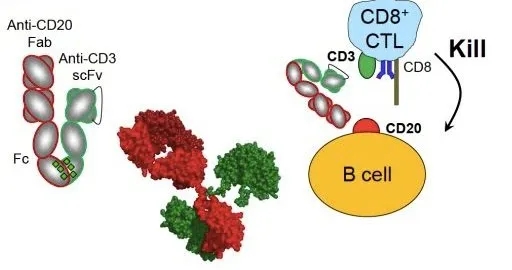
REGN1979通过与B细胞肿瘤蛋白(CD20)和免疫系统T细胞受体(CD3)结合来杀伤癌细胞,此前,REGN1979已被FDA授予孤儿药资格认定,用于治疗DLBCL和FL。目前REGN1979正在晚期FL、DLBCL和其它淋巴瘤患者中进行一项I期临床研究和一项针对B-NHL的可能成为注册试验的II期临床研究。
REGN1979已在多种B细胞非霍奇金淋巴瘤(NHL)患者中表现出出色的治疗效果。2019年ASH会议上,再生元报告了REGN1979的Ⅰ期临床结果。在滤泡淋巴瘤(FL)患者(5mg以上剂量)中的总响应率(ORR)达到93%,完全缓解率(CR)为71%;弥漫大B细胞淋巴瘤DLBCL患者(80mg以上剂量)ORR为57%(4/7),且均为完全缓解,其中2例为经CAR-T疗法治疗失败的患者。
在行业内,有关CAR-T与双抗谁更胜一筹的问题一直争论不休,在去年的ASH年会上,两者的对战到达了顶峰,特别是CD20xCD3双抗极为亮眼的数据让CAR-T感到一丝威胁。
CD20xCD3类双抗当下针对血液肿瘤是重点布局方向,目前罗氏和再生元在此领域的研究最为领先,同时IGM Biosciences、Genmab、Xencor等公司的同类在研产品也在积极推进。
罗氏目前开发了两款CD20xCD3双抗Glofitamab&Mosunetuzumab,其中Glofitamab已经进入临床III期,Glofitamab为2:1型(具有两个与CD20结合的“ Fab”区域和一个与CD3结合的“ Fab”区域)CD20/CD3双抗,这种新颖结构设计使其与B细胞表面CD20的结合性更高,诱导快速T细胞活化、细胞因子释放,以及导致靶细胞裂解。
此前,在EHA年会上,该公司报告了glofitamab在R/R NHL中的最新临床数据,I期剂量递增研究的积极结果,在中位接受了三线治疗后的患者中,glofitamab显示了在NHL中显示了强大的临床疗效,包括更持久的缓解和可控的安全性。
罗氏的另一款CD20/CD3双抗Mosunetuzumab不同于glofitamab,有两个Fab段,其中一个Fab靶向CD20,另一个靶向CD3。
此前在ASH上公布的临床数据显示,Mosunetuzumab在惰性NHL患者中的ORR达到62.7%,43.3%的CR,在侵袭性NHL中的ORR和CR分别为37.1%和19.4%。此前(7月14日),罗氏宣布mosunetuzumab获得FDA突破性疗法认定(BTD)。

→Genmab公司基于DuoBody技术开发了CD3/CD20双抗--Epcoritamab,目前正在进行针对多种血液性B细胞恶性肿瘤的Ⅰ/Ⅱ期临床试验。在刚结束的ASCO年会上,Genmab公布了Epcoritamab的最新临床结果,Epcoritamab在治疗滤泡性淋巴瘤(FL)患者中能够达到86%的ORR,在治疗弥漫性大B细胞淋巴瘤(DLBCL)的患者中也达到了50%的ORR,其中包括3名接受CAR-T疗法失败的患者。
→Xencor公司拥有一款CD20-CD3双抗XmAb13676。在第61届ASH年会上,该公司也公布了XmAb13676在接受过CD20抗体治疗的(R/RNHL)以及慢性淋巴细胞白血病(CLL)患者的初步安全性和有效性数据。结果显示在弥漫大B细胞淋巴瘤DLBCL患者(80mg以上剂量)患者中的总响应率为38.9%,完全响应率为27.8%。
此外,IGM Biosciences公司开发了一款基于IgM的还处于临床前的CD20 x CD3双抗--IGM-2323,目前正在进行复发/难治性非霍奇金淋巴瘤的I期临床研究。
当下,CAR-T疗法最大的竞争压力来自于双抗,特别是双抗在经CAR-T疗法失败的患者中也表现出显著疗效。近年来,制药巨头们抓紧在血液肿瘤中双抗布局,此前信达以及艾伯维斥巨资布局CD20xCD3双抗。随着双抗领域的蓬勃发展,未来这些血液肿瘤患者也将有望更低的治疗方案可供选择。

扫描上面二维码在移动端打开阅读