2020年9月13日---近日,总部位于瑞士洛桑的ADC Therapeutics公布了其靶向CD25的ADC候选产品camidanlumab tesirine(Cami,原为ADCT-301)相关的临床前研究数据,数据显示Cami能够有效耗竭Tregs,并且对某些特定的实体瘤具有有效且持久的抗肿瘤活性。同时数据还支持Cami下一步临床开发。
ADC Therapeutics研究与开发高级副总裁Patrick Van Berkel博士表示:“我们很高兴能够看到,靶向CD25的ADC药物能够耗竭表达CD25的Tregs。在临床前研究中,不仅展示了Cami作为单一疗法的强大抗肿瘤活性,还增强了PD-1疗法的活性。这项研究为ADC作为免疫治疗制剂的新应用提供了概念验证,并支持我们正在进行的1b期晚期实体瘤试验,以继续评估Cami。我们期待着将Cami成为一种治疗实体瘤的新型肿瘤免疫疗法。”
该数据发表在美国癌症免疫治疗学会(Society for Immunotherapy of Cancer)的在线杂志 Journal for ImmunoTherapy of Cancer上。
临床前研究数据
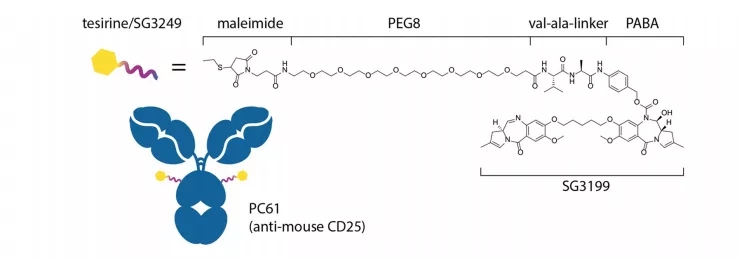
Cami是一款靶向CD25的ADC候选产品,由CD25单抗HuMax-TAC(由Genmab许可)装载吡咯苯二氮平(PBD)二聚体毒素弹头而成。Cami一旦与靶细胞(可以是表达CD25的肿瘤细胞,也可以是表达CD25的Tregs)结合,Cami就会被内化到细胞中,并酶释放释放毒素以杀死目标细胞。
在实体瘤微环境内,与Tregs结合而释放的PBD二聚体毒素也可以杀死周围的肿瘤细胞,同时PBD二聚体毒素也显示出具有诱导免疫原性细胞死亡的作用。
因此,本研究探索了靶向CD25的Cami消耗Tregs和诱导抗肿瘤免疫的能力。
对于实体瘤来说,限制其进行免疫治疗的一大因素是免疫抑制性肿瘤微环境,其中Tregs在肿瘤微环境建立和发展中起到了关键的作用,且是肿瘤免疫疗法的重要障碍。因此,也有许多研究在探索如何通过耗竭或阻止Tregs来使得免疫疗法在实体瘤中获得更多益处。
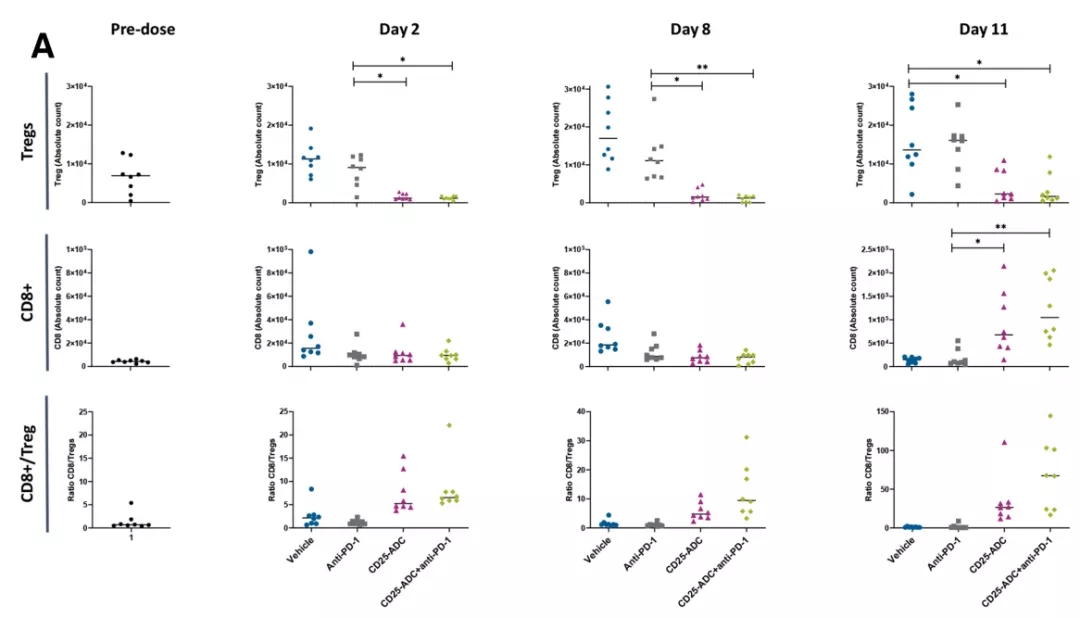
研究中,研究人员建立了CD25阴性的同基因结肠癌模型(表现为表达CD25的Tregs肿瘤浸润),然后输注单次低剂量的Cami单药或/联合PD-1免疫检查点抑制剂。结果显示:单次低剂量的Cami单药或/联合PD-1都能对该模型产生有效且持久的抗肿瘤活性;CD25 ADC的肿瘤杀伤依赖于CD8+ T细胞,CD25 ADC诱导了肿瘤免疫。
重要的是,CD25 ADC能够显著和持续的介导肿瘤微环境内Tregs的耗尽,并且伴随着CD8 + T效应细胞大量的激活和增加,并且全身性的Tregs耗尽是暂时的,减轻了自身免疫副作用的风险。
这项研究的结果表明,基于PBD二聚体毒素的、靶向CD25的Cami能够消耗Tregs,并通过诱导肿瘤免疫消除已经建立的肿瘤。
总体而言,该研究为ADC作为免疫治疗制剂的全新应用提供了一个概念验证,因其主要作用形式是靶向免疫原性细胞,而非肿瘤细胞。同时,本研究提供的临床前数据能够支持Cami对Tregs浸润的实体瘤进行下一步临床开发,以评估Cami单药或联合免疫检查点抑制剂对这些实体瘤的作用。
值得一提的是,目前Cami还在进行一项针对晚期实体瘤的1b期临床试验、一项针对复发性或难治性霍奇金淋巴瘤(HL)的2期临床试验以及一项针对非霍奇金淋巴瘤的1b期临床试验。
关于ADC Therapeutics公司
ADC Therapeutics成立于2011年,是一家肿瘤药物研发公司,专注于开发具有高效吡咯苯二氮平(PBD)弹头的高靶向抗体药物偶联物(ADC),以解决重大未满足的医疗需求,并改善难以治疗的癌症患者的治疗效果。
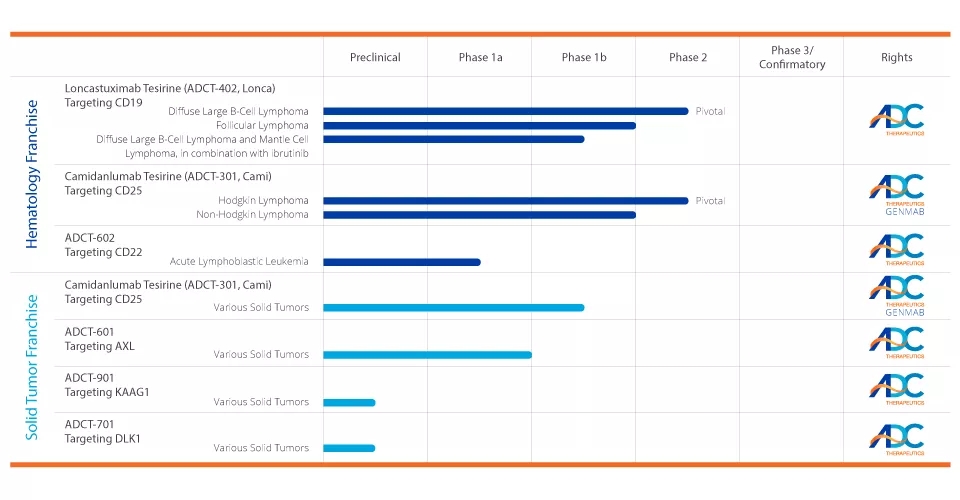
针对基于PBD的ADC的战略目标选择和早期临床开发的大量投资,ADC Therapeutics建立了一个治疗血液学恶性肿瘤和实体肿瘤的治疗的深度临床和研究管道。在美国和欧洲,该公司有多个基于PBD的ADC正在进行临床试验,从首次人体试验到关键的2期临床试验,以及其他正在开发的临床前ADC。ADCT-402和ADCT-301是该公司的两个主要候选产品。
▲ 公司的研发管线(图片来源:adctherapeutics)
ADCT-402是一种抗体药物偶联物(ADC),由与人CD19结合的人源化单克隆抗体组成,通过与吡咯苯二氮平(PBD)二聚体毒素的连接物偶联。一旦与CD19表达细胞结合,ADCT-402被内化到细胞中,其中酶释放基于PBD的弹头。基于PBD的弹头有能力形成高度细胞毒性的DNA链间交联,阻断细胞分裂,导致细胞死亡。CD19是ADC的理想靶点,因为它在一系列B细胞血液学肿瘤(包括某些类型的淋巴瘤和白血病)中都有高表达,是治疗B细胞恶性肿瘤的临床验证靶点,而在健康组织中的表达受到限制。
ADCT-402正在R/R DLBCL 患者中进行一个关键的2期临床试验(NCT03589469)。同时该药物还与强生公司的Imbruvica (ibrutinib)联合用于治疗R/R DLBCL或套细胞淋巴瘤(MCL)在进行Ib期临床试验(NCT03684694),以及与阿斯利康(AstraZeneca)的Imfinzi (Durvalumab)联合用于R/R DLBCL、MCL或滤泡性淋巴瘤在进行Ib期临床试验(NCT03685344)。美国食品和药物管理局授予ADCT-402孤儿药的称号,用于治疗复发或难治性弥漫型大B细胞淋巴瘤和MCL。
此外,2019年7月,ADC Therapeutics完成了1.03亿美元的E系列融资扩张,本轮募资总额达到3.03亿美元。这笔资金将用于完成ADCT-402在复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL)患者中的关键2期临床试验。
参考资料:
扫描上面二维码在移动端打开阅读