据美国莱斯大学科学家介绍,借助一种更加高级的支架结构,对骨癌治疗药物的检测将变得更加简单。
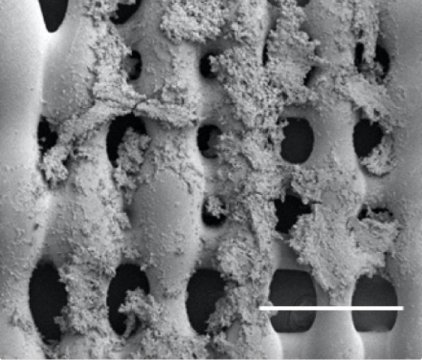
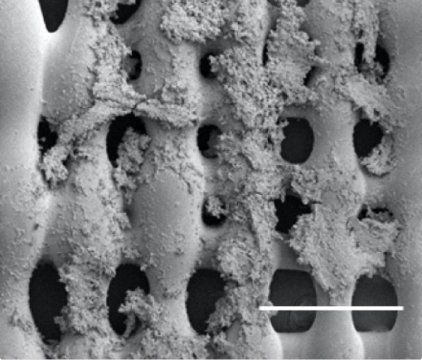
莱斯大学生物工程学家 Antonios Mikos 带领研究团队进一步改进了他们的3D 打印支架用来研究尤文肉瘤(一种骨癌)细胞如何应对刺激,特别是剪应力,当血液等黏性流体经过骨的时候会对肿瘤造成这种作用力。研究人员发现支架结构(天然的和人造的)对于肿瘤细胞表达帮助肿瘤生长的信号蛋白有实质影响。
支架上孔洞的大小和形状以及支架的多孔性会影响细胞的黏附,改变介质和营养成分的渗透能力,影响细胞迁移。科学家们表示3D 打印技术帮助他们进一步模拟了真正的骨结构。
相关研究结果发表在美国化学学会期刊 ACS Biomaterials Science and Engineering 上。
据Mikos介绍支架本身就很特殊,打印出来的仿骨聚合物上包含了不同大小的孔洞能够限制液体流通,对肿瘤细胞产生不同程度的剪应力。“我们想要在体外开发具有肿瘤实际复杂性的肿瘤模型,用于药物检测,因此为药物开发提供一个平台,并降低相应成本。”Mikos 这样说道。他指出通过不同的支架结构可以改变液体流过时造成的机械环境以及对肿瘤细胞施加的剪应力。
研究人员在打印的支架上接种了肿瘤细胞,随后将其放在一个流体灌注反应器中来模拟生物环境下液体和组织产生的作用力。这种模拟比生长在培养皿中的细胞更接近实际情况。
研究人员发现肿瘤细胞在有液体流动的情况下增殖更快,并且当液体开始流动,生长在渗透性受到限制的最小孔洞中的细胞增殖能力更强。他们还发现在有液体流动的情况下肿瘤细胞会增加 IGF-1的合成,这种配体定位于尤文肉瘤细胞表面,该配体介导的信号途径在化疗抵抗中有重要作用。除此之外,孔洞的大小也会影响细胞对 IGF-1的合成。
研究人员推测剪应力和支架孔洞的联合作用导致了蛋白合成的不同水平。他们计划进一步改进他们的3D 打印方法继续研究癌症转移,检测肿瘤对药物的应答情况。(生物谷Bioon.com)
原始出处:
Jordan E. Trachtenberg, Marco Santoro, Cortes Williams,et al.Effects of shear stress gradients on Ewing sarcoma cells using 3D printed scaffolds and flow perfusion.ACS Biomater. Sci. Eng., Just Accepted Manuscript
扫描上面二维码在移动端打开阅读