很多人可能无法想象肿瘤和胚胎之间的相似之处,实际上,癌细胞和胚胎细胞都是快速分裂中的未完全分化细胞。当然,胚胎细胞的快速分化是正常的发育过程。而癌细胞则是组织细胞被不正常地“逆分化“到了更原始的状态,并进入了快速生长的状态。
从快速分裂的未分化细胞到缓慢生长的分化细胞,细胞中的 DNA 序列并没有发生变化,在这个过程中表观遗传学起了很大的作用。表观遗传学研究的是那些对 DNA 进行修饰的蛋白,修饰的过程主要是对特定的碱基进行甲基化,就相当于给基因打上了记号。
表观遗传学中其中一个很重要的蛋白复合物是 PRC2,在胚胎细胞中,PRC2 非常活跃,它可以抑制数千个基因的表达,使细胞处于原始的未分化状态。而随着人的成长,PRC2 逐渐进入了沉默状态,不再发挥作用。但是,研究发现,在包括 B 细胞淋巴瘤在内的某些肿瘤中,PRC2 被重新激活,激活了的 PRC2 使癌细胞进入了快速分裂生长的状态。
最近,来自诺华(Novartis)中国生物医学研究中心的科学家们找到了一种方法,通过小分子药物结合 PRC2 复合物中的一个蛋白 EED,可以有效地抑制 PRC2 的活性。这个方法小鼠的 B 细胞淋巴瘤模型中展示了良好的效果,这项研究被发表在了《自然》杂志子刊《Nature Chemical Biology》上。
全球各地的多个实验室都曾试图寻找抑制 PRC2 活性的药物,不过收获甚微。诺华的团队采取了一种不同的策略,他们并没有试图直接抑制 PRC2 的活性位点,而是通过高通量筛选来寻找那些不直接结合 PRC2 的活性位点,但是能够抑制 PRC2 活性的小分子。在找到这样的一个分子之后,再通过化学生物学的方法来鉴定这个小分子在 PRC2 复合物上的结合部位,并对这个分子加以改进成为候选药物。
在研究过程中,诺华的团队发现,PRC2 在对 DNA 进行修饰之前,需要先通过与一个 DNA 包装蛋白结合来确定修饰的位置。初步筛选出来的化合物中就有一个阻止了 PRC2 复合物中的 EED 蛋白与 DNA 包装蛋白的结合。进一步的结构生物学实验发现,这个化合物可以改变整个 PRC2 复合物的结构,从而使其失活。这个化合物在小鼠的 B 细胞淋巴瘤模型中恢复了数百个基因的正常表达,并使肿瘤出现萎缩。
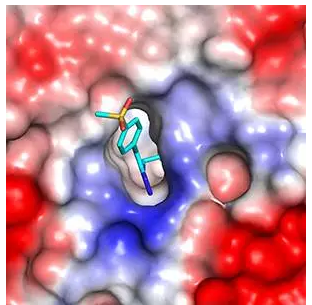
▲诺华研究团队筛选出能结合至 EED 的化合物(图片来源:Nature Chemical Biology)
这项研究的通讯作者、诺华中国生物医学中心主管李恩博士表示:“我们的这个化合物对癌细胞基因组进行了重编程,改变了许多基因的表达量,抑制了癌细胞生长。我们是为数不多的几个开发逆转癌细胞中不正常基因表达的药物的公司之一,这是治疗癌症的一种潜在的新方法。”
基于这项研究,诺华的科学家们继续开发了一个优化后的候选药物 MAK683,这个药物目前正在针对弥漫大 B 细胞淋巴瘤、鼻咽癌等多种癌症的 1 期临床试验中。我们希望这些试验顺利进行,早日为癌症患者带来新药。
参考资料:
[1] Countering the genome reprogramming of cancer cells
[2] 诺华中国官方网站
扫描上面二维码在移动端打开阅读





