新基 2 月 23 日宣布,FDA 已扩大批准 Revlimid(来那度胺)10mg 胶囊的新适应症,用于多发性骨髓瘤患者接受自体同源干细胞移植(auto-HSCT)后的维持治疗。来那度胺成为 FDA 批准的唯一一个接受 auto-HSCT 后的维持用药。
两项大型研究在 1000 例患者中比较了患者在接受 auto-HSCT 术后给予来那度胺直至疾病进展或出现不可耐受毒性与不给予任何维持治疗的临床结局差异,临床研究的主要终点为 PFS,定义为患者从随机化分组到疾病发生进展或死亡的时间。
第 1 项 CALGB 100104 研究(n=460)由美国癌症研究所资助,在美国开展,来那度胺组较对照组 PFS 延长 3.8 年(5.7 vs 1.9 年);第 2 项 IFM 2005-02 研究(n=614)在欧洲开展,来那度胺组 PFS 可延长 1.9 年(3.9 vs 2 年)。
描述性分析结果显示,第 1 项研究中来那度胺组总生存期相比对照组可延长 2.3 年(9.3 vs 7 年),第 2 项研究中来那度胺组总生存期可延长 1.5 年(8.8 vs 7.3 年)。
两项研究中,来那度胺组最常见(≥20%)的不良反应包括中性粒细胞减少(79%,61%),血小板减少(72%,24%),白细胞减少(23%,32%),贫血(21%,9%),上呼吸道感染(27%,11%),支气管炎(5%,47%),鼻咽炎(2%,35%),咳嗽(10%,27%),胃肠炎(0%,23%),腹泻(55%,39%),皮疹(32%,8%),疲劳(23%,11%),虚弱(0%,30%),肌肉痉挛(0%,33%),发热(8%,21%)。不良反应的发生在给药的前 6 个月更为多见,之后发生率降低或保持稳定。
新基全球血液疾病及肿瘤产品负责人 Michael Pehl 指出:“auto-HSCT 对新确诊的多发性骨髓瘤患者仍是一个非常有吸引力的治疗选择,因为这种治疗方案有非常强的应答。如今扩大批准来那度胺用于 auto-HSCT 术后的维持治疗可以延长患者的应答时间,延缓疾病进展。”
来那度胺在 2006 被 FDA 扩大批准新适应症,与地塞米松联用二线治疗多发性骨髓瘤,2015 年继续被 FDA 扩大适用人群,与地塞米松联用一线治疗多发性骨髓瘤,销售收入增长速度进一步加快,在 2016 年已经成为全球最畅销的肿瘤药。
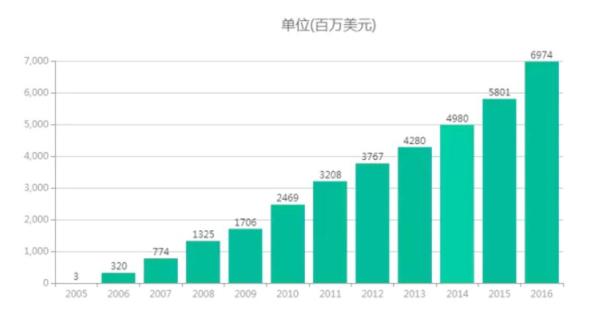
Celgene 来那度胺销售额
2017 年 1 月,欧盟 CHMP 也给予肯定意见,推荐批准来那度胺作为 auto-HSCT 术后的维持用药。在 FiercePharma 前不久发布的 2022 年全球 TOP15 肿瘤药预测中,来那度胺在 2022 年的销售额可达到 140 亿美元(见:2022 年肿瘤药 TOP15:流水的巨头,铁打的罗氏)
Roswell Park 癌症研究所 Philip McCarthy 博士表示:“多发性骨髓瘤患者在诱导治疗后接受 auto-HSCT 是理想的治疗方案,但大部分患者最终仍会出现复发或疾病进展。来那度胺在术后用于维持治疗显示出可以延长患者的无进展生存期,有望成为这类患者的标准疗法。”
扫描上面二维码在移动端打开阅读





