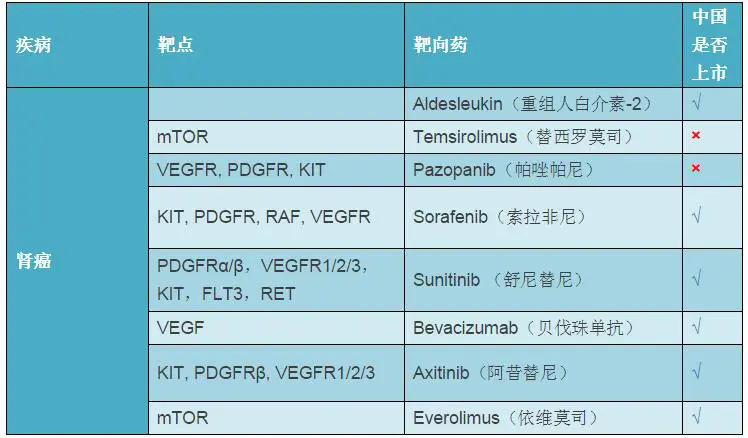
肾细胞癌(RCC)是一种全球范围内常见的恶性肿瘤,发病率和死亡率约占全身肿瘤 2%-3%,在泌尿系统恶性肿瘤中,其发病率仅次于膀胱癌,且呈逐年上升趋势。近年来,靶向药物在晚期肾癌的治疗中取得了较大进展,自 2005 年以后全球已经有多个药物获准上市并成为晚期肾癌的标准治疗。
我国目前男性 RCC 发病率为 4.7/10 万,女性为 3 /10 万左右,肾癌每年发病率增长约 2.5%,已获 CFDA 批准治疗 RCC 的药物包括舒尼替尼(辉瑞)、索拉非尼(拜耳)、依维莫司(诺华)和阿昔替尼(辉瑞)。其中,舒尼替尼、索拉非尼用于晚期 RCC 的一线治疗;依维莫司和阿昔替尼用于晚期 RCC 患者的二线治疗。
3 月 3 日,诺华宣布 CFDA 批准培唑帕尼(帕唑帕尼,Votrient)800mg(qd)用于晚期 RCC 患者的一线治疗,以及曾接受细胞因子治疗的晚期 RCC 癌患者的治疗,为我国 RCC 患者提供了一个新的治疗选择。

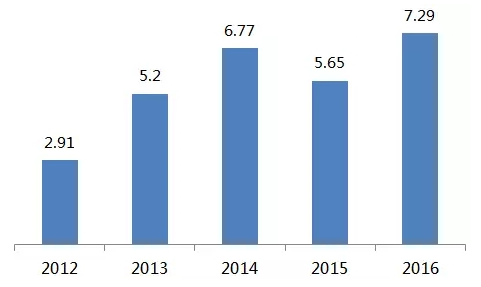
培唑帕尼片是一种血管内皮生长因子受体(VEGFR)酪氨酸激酶抑制剂(TKI),作用机制与索拉非尼、舒尼替尼、阿昔替尼类似,分别 2009 年 10 月和 2010 年 6 月相获得美国和欧盟获得批准上市,至今已在全球 100 多个国家和地区获得批准用于治疗晚期 RCC。培唑帕尼原本是属于 GSK 的产品,但是 2014 年在 GSK 与诺华的资产置换交易中被打包送走。2016 年全球销售额增长至 7.29 亿美元。
Votrient 全球销售额(亿美元)
支持培唑帕尼在中国上市的临床研究主要包括:①一项随机、双盲、安慰剂对照、国际多中心 III 期研究 VEG105192(n=435)及其开放性延期研究 VEG107769(n=78);②一项随机、双盲、阳性药对照(舒尼替尼)、国际多中心 III 期研究 VEG108844(n=927)及其亚洲子研究 VEG113078(n=183);③一项支持性 II 期研究(VEG102616,n=225);④中国肾癌患者的药代动力学数据总结。
关键全球 III 期 VEG105192 研究在初治和既往经过细胞因子治疗的晚期肾细胞癌患者中进行。结果显示,与安慰剂相比,初治患者中位 PFS 显著延长(11.1 vs 2.8 个月),既往经细胞因子治疗亚组人群的中位 PFS 也明显延长(7.4 vs 4.2 个月);总体客观缓解率(ORR)显著提高(30% vs 3%)。另外两项支持性 VEG102616 研究和 VEG107769 研究验证了培唑帕尼治疗晚期 RCC 的疗效及安全性,以上三项研究中共有 18 例中国患者接受了培唑帕尼治疗。相关数据成为支持培唑帕尼在西方国家上市的主要依据。
中国患者的安全有效性数据主要来自全球 VEG108844 研究及在亚洲区域开展的子研究 VEG113078。两项研究总共入选了 1110 名受试者(培唑帕尼组 557 名,舒尼替尼组 553 名),其中 VEG108844 研究入选 927 例,VEG113078 研究入组 183 例。两项研究共入组来自中国大陆、台湾、日本、韩国等亚洲区域人群 367 例,其中包括 209 名中国大陆受试者(培唑帕尼组 109 名,舒尼替尼组 100 名)。
该研究达到了主要终点,证明培唑帕尼在 PFS 上不劣于舒尼替尼。培唑帕尼和舒尼替尼组的中位 PFS 分别为 8.4 和 9.5 个月。各亚组(年龄、性别、人种 / 地域)的 PFS 与主要分析 PFS 的相一致;中位 OS 分别为 28.3 和 29.1 个月。在 IRC 评价的 ORR 方面,培唑帕尼组的确定缓解率(CR+PR)高于舒尼替尼组,差异(6%)具有统计学显著性意义。总体上,该研究有效性结果与这两种药物的预期疗效相一致,且两药相似。
中国亚组分析结果表明,培唑帕尼和舒尼替尼治疗组的中位 PFS 分别为 8.3 和 8.3 个月。该结果与 VEG108844 研究总人群的 IRC 评估的 PFS 结果相同,也与亚洲人群结果一致,所有三个人群中,IRC 评估的 PFS 风险比接近 1,提示三个人群中培唑帕尼和舒尼替尼的疗效相似。
根据中国受试者的 IRC 评估(35% vs 20%, p=0.02),培唑帕尼组的缓解率(CR+PR)在统计学上高于舒尼替尼组。这些结果也与亚洲人群(36% vs 21%, p=0.002)和总研究人群的结果(31% vs 25%, p=0.032)一致。OS 数据尚不成熟。
在安全性方面,截至 2012 年 9 月 9 日,已有 6975 名受试者在临床研究中接受过培唑帕尼治疗,包括正在进行或已经完成的临床研究。其中,1302 名受试者在肾癌研究中接受过培唑帕尼 800mg 单药治疗。报告的最常见的不良事件(>20%)是腹泻(59%),高血压 (44%), 疲乏 (42%), 恶心 (38%), 头发颜色改变 (36%), 食欲下降 (32%), 呕吐 (24%) 和谷丙转氨酶升高 (24%)。大多数 3 - 4 级 AE 为高血压,转氨酶升高,腹泻和疲乏。
中国人群在手足综合征、血液毒性、肝酶异常、高血压等发生率更高,在腹泻等消化道毒性发生率更低,但没有观察到新的安全性信号。AE 类型与其他 VEGF 酪氨酸激酶抑制剂中发生的 AE 类型相似。通过适当的监测以及出现指征时及时干预处理可以得到控制。有关肝毒性的毒性反应也已经纳入说明书中警告内容,有相关的风险控制措施,也制定了上市后风险监测计划。在培唑帕尼和舒尼替尼转化治疗差异的 VEG113046 研究结果提示患者更易于接受培唑帕尼的治疗。
中国肾癌患者中的药代动力学研究数据主要是来自国际多中心 II 期临床研究 VEG102616 的中国肾细胞癌患者的培唑帕尼药代动力学数据及其分析结果,综合分析结果表明,中国患者在各个时间点的培唑帕尼平均血药浓度和药代特征与其他患者群体患者相似,未观察到种族差异。
综上,培唑帕尼可以有效治疗晚期或转移性肾细胞癌,其改善患者无进展生存期(PFS)的疗效与舒尼替尼相似,在一些可能影响生活质量的不良事件上的安全性特征更优。基于现有数据,CDE 认为本品用于中国晚期肾细胞癌患者的安全有效性依据充分,作为在中国批准上市的决定。培唑帕尼将为我国晚期肾细胞癌患者带来更多的治疗选择。
扫描上面二维码在移动端打开阅读