2017年3月12日/生物谷BIOON/---癌细胞具有较深的进化根源,人体内任何重要的细胞都有可能发生癌变。数亿年前,类似珊瑚的微型水螅体内就存在癌细胞,暗示癌症已是人类进化固有的一部分。
目前肿瘤免疫治疗策略似乎都是通过调节T细胞受体信号或使用天然的生物分子和相关肿瘤抗原的单克隆抗体刺激免疫系统的识别。小分子药物相对于生物免疫疗法具有许多的优点:小分子类药物的临床应用历史和发展,使患者更易接受和了解,具有较好的可行性;口服生物利用度;在肿瘤微环境等更大范围的应用可能性等;最显著的优点就是成本低、负担小,而且生产、运输、保存条件和技术要求低,并且患者用药方式方便(口服给药即可)。
基于此,小编针对近期利用小分子阻止癌症取得的最新进展进行盘点,以飨读者。
1.CCR:抗体/小分子组合治疗展现对抗成神经细胞瘤的新希望
doi:10.1158/1078-0432.CCR-16-1743
 最近来自美国洛杉矶儿童医院萨班研究所的研究人员进行了一项研究,进一步揭示了细胞因子TGFβ1在成神经细胞瘤生长中的作用,并且提示了小分子药物/抗体组合疗法治疗这种癌症的可能性。相关研究结果发表在国际学术期刊Clinical Cancer Research上。
最近来自美国洛杉矶儿童医院萨班研究所的研究人员进行了一项研究,进一步揭示了细胞因子TGFβ1在成神经细胞瘤生长中的作用,并且提示了小分子药物/抗体组合疗法治疗这种癌症的可能性。相关研究结果发表在国际学术期刊Clinical Cancer Research上。
除了直接靶向参与疾病发生的分子,许多抗体疗法还靶向激活自然杀伤细胞(NK细胞)。NK细胞是一类受到抗体激活以后能够杀伤肿瘤细胞的免疫细胞。最近发现类似TGFβ1这样的蛋白分子能够抑制肿瘤微环境中NK细胞的抗癌功能。
TGFβ1是一种执行许多种细胞功能的分泌蛋白,其功能包括控制细胞生长、增殖和细胞死亡。在这项研究中,研究人员找到一个对抗成神经细胞瘤的新组合治疗方法,其中既包括抗体药物dinutuximab,又包含一种叫做galunisertib的小分子药物,这种药物能够抑制TGFβ1的作用。研究人员将成神经细胞瘤细胞系或病人来源的成神经细胞瘤组织移植到免疫缺陷小鼠体内在对其进行组合治疗,发现galunisertib介导对TGFβ1的抑制,让dinutuximab和NK细胞能够更加有效地杀伤成神经细胞瘤。
2.Cancer Lett:借助PDX动物开发靶向小分子 治疗抵抗化疗的恶性乳腺癌
doi: 10.1016/j.canlet.2016.07.006
近日,来自美国西北大学的研究人员开发了两种新型肿瘤抑制剂药物,并通过体外细胞实验和人源肿瘤异种移植小鼠模型(PDX)对药物的作用进行了验证,结果表明靶向一个靶点分子可以有效治疗转移性乳腺癌。相关研究结果发表在国际学术期刊Cancer Letter上。
糖原合成酶激酶3beta(GSK-3beta)是一种丝氨酸/苏氨酸蛋白激酶,目前正逐渐成为人类乳腺癌治疗的靶点。在该研究中研究人员以该分子为靶标找到了治疗具有化疗药物抗性的转移性乳腺癌的候选药物。
在研究中研究人员证明通过两个新开发的GSK-3小分子抑制剂——9-ING-41和9-ING-87对GSK-3进行药物抑制,能够降低乳腺癌细胞存活但对非肿瘤细胞的生长几乎没有影响。研究人员通过体外实验发现用9-ING-41进行治疗还可以增强癌症治疗药物依立替康(CPT-11)对乳腺癌细胞的抗肿瘤作用。
随后研究人员使用抵抗化疗药物的恶性乳腺癌病人的转移性胸腔积液构建了两种人源性肿瘤异种移植小鼠模型(BC-1和BC-2),发现9-ING-41也能在体内促进化疗药物CPT-11的抗肿瘤作用,使得已经建立的肿瘤发生退化。结果表明抑制GSK-3是帮助克服人类乳腺癌化疗抵抗的一种非常具有前景的治疗方法,该研究开发的GSK-3抑制剂9-ING-41是治疗转移性乳腺癌的一种强力候选靶向药物。
3.Cell:重大突破!首次鉴定出抑制RAS癌基因的小分子
doi:10.1016/j.cell.2016.03.045
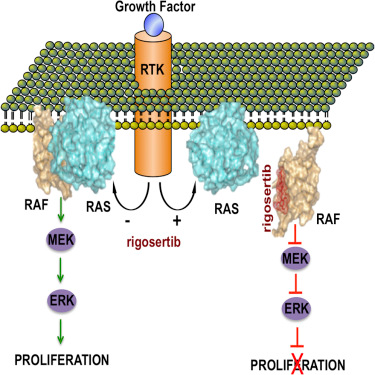 RAS基因在30%以上的人类癌症中发生突变,而且代表着药物开发者最为广受欢迎的癌症靶标之一。然而,由于RAS突变蛋白缺乏药物结合的口袋,这一目标一直难以实现。在一项新的研究中,来自美国西奈山伊坎医学院、斯克利普癌症斯研究所、阿尔伯特-爱因斯坦医学院和纽约结构生物学中心的研究人员鉴定出一种靶向这种重要的癌基因的新机制。相关研究结果发表在2016年4月21日那期Cell期刊上。论文通信作者是西奈山伊坎医学院肿瘤学教授E. Premkumar Reddy博士。
RAS基因在30%以上的人类癌症中发生突变,而且代表着药物开发者最为广受欢迎的癌症靶标之一。然而,由于RAS突变蛋白缺乏药物结合的口袋,这一目标一直难以实现。在一项新的研究中,来自美国西奈山伊坎医学院、斯克利普癌症斯研究所、阿尔伯特-爱因斯坦医学院和纽约结构生物学中心的研究人员鉴定出一种靶向这种重要的癌基因的新机制。相关研究结果发表在2016年4月21日那期Cell期刊上。论文通信作者是西奈山伊坎医学院肿瘤学教授E. Premkumar Reddy博士。
在这项研究中,研究人员鉴定出首个小分子能够同时抑制RAS癌基因激活的不同信号通路。这个被称作rigosertib或ON01910.Na的小分子作为一种蛋白-蛋白相互作用抑制剂发挥作用,阻止RAS与将正常细胞变成癌细胞的信号蛋白(包括RAF和PI3K等)相结合。研究人员开展结构学实验,证实了rigosertib的这个作用机制,并且证实这种靶向作用机制有潜力用于治疗几种由RAS癌基因驱动的癌症。
Reddy博士说,“这一发现是癌症领域的一个重大突破。rigosertib的作用机制代表着一种攻击无药可靶向的RAS癌基因的新策略。我们当前的重点是使用来自我们利用rigosertib开展的研究中提供的信息,设计下一代小分子RAS靶向疗法,而且激动人心的是,我们最近鉴定出我们认为可改善rigosertib性质的几种化合物。”
4.Cancer Res:发现小分子LF3强效地杀死癌干细胞
doi:10.1158/0008-5472.CAN-15-1519
如今,来自德国马克斯-德尔布吕克分子医学中心(Max Delbrück Center for Molecular Medicine)沃尔特-伯彻米尔实验室的Liang Fang和他的同事们发现一种分子能够破坏依赖于WNT信号的癌干细胞存活所必须的生化信号。相关研究结果在线发表在Cancer Research期刊上。
很多药物就是通过阻止受体接受Wnt信号来发挥作用。但在与Wnt相关的癌症中,这种策略不会起作用,这是因为是在Wnt信号通路的下游存在缺陷。科学家们也希望在下游的这些点上发现适合的靶标加以干预从而仅仅破坏在下游存在缺陷的癌细胞。
在当前的这项研究中,Liang Fang和他的同事们着重研究Wnt信号通路中一种被称作β-连环蛋白(beta-catenin)的组分。在环境信号缺乏时,β-连环蛋白被挡在细胞核外,它与一种蛋白复合体结合在一起,并最终让它降解。外界信号能够让它从这种破坏复合体中释放出来,并迁移到细胞核中。在那里,β-连环蛋白结合到诸如TCF4之类的转录因子,它们一起激活特异性的靶基因。在过去几年,沃尔特-伯彻米尔实验室和其他人已证实癌干细胞需要来自这种通路的持续激活才得以存活和维持。
科学家们认为利用一种药物破坏β-连环蛋白和TCF4之间的相互作用是可能的。但是,β-连环蛋白和TCF4之间的接触点较小。
为了解决这个问题,Liang Fang与来自德国莱布尼茨分子药理学研究所筛选中心的Jens von Kries团队开展合作。该筛选中心拥有高通量技术平台和一个由数以万计分子组成的文库,这种分子文库可供科学家们用来筛查抑制剂。
为了发现一种抑制剂,研究人员利用AlphaScreen和酶联免疫吸附检测(ELISA)技术加以筛选。先将TCF4分子固定在微孔板中,然后加入β-连环蛋白和来自这种分子库中的化合物,而且每次加入其中的一种化合物。如果一种化合物干扰β-连环蛋白和TCF4之间的相互作用,那么这两种蛋白将以低速率结合。这系列筛选最终发现一种被称作LF3的化合物强烈地抑制它们之间的结合,接着利用10种LF3化学类似化合物重复上述实验,再次证实LF3是最强效的抑制剂。
这种抑制效应是在试管中发现的。为了证实这种效应在细胞中也存在,Liang Fang开发出一种携带荧光标记的细胞系,其中这种荧光标记能够指示β-连环蛋白和TCF4是否成功地结合。结果是LF3在细胞中也同样有效地阻止它们之间的结合。
接下来就是确定LF3是否也在肿瘤细胞中发挥作用。研究人员发现LF3阻断肿瘤细胞的几个关键性质:它破坏细胞周期、阻止它们复制以及强效地降低它们迁移的能力。结果还表明,LF3似乎对健康细胞一点影响都没有。
5.Cancer Res:白血病靶向治疗新策略 小分子抑制剂将有大用途
doi:10.1158/0008-5472.CAN-15-0236
 近日,来自英国牛津大学的研究人员在国际学术期刊Cancer Research上发表了一项最新研究进展,他们发现了一种能够特异性靶向组蛋白乙酰转移酶CBP/p300的抑制剂分子,这种抑制剂分子或可在未来用于白血病的临床治疗。
近日,来自英国牛津大学的研究人员在国际学术期刊Cancer Research上发表了一项最新研究进展,他们发现了一种能够特异性靶向组蛋白乙酰转移酶CBP/p300的抑制剂分子,这种抑制剂分子或可在未来用于白血病的临床治疗。
在这项研究中,研究人员开发出一种特异性的强力抑制剂分子--I-CBP112,这种抑制剂能够靶向CBP/p300的bromodomain。Bromodomain是一个进化上高度保守的由110个氨基酸组成的蛋白质功能结构域,可特异性识别组蛋白末端乙酰化的赖氨酸位点,通过影响染色质组装参与信号依赖性的,非基础性的基因转录调控。有研究表明含有Bromodomain的蛋白发生改变会导致组蛋白乙酰化失调,参与白血病等恶性肿瘤的发生,找到靶向Bromodomai的抑制剂分子将为肿瘤治疗提供了新的策略。
研究人员用I-CBP112处理人类和小鼠白血病细胞系之后发现这会导致癌细胞克隆形成能力受到损伤,并会诱导细胞分化,在这个过程中没有表现出明显的细胞毒性。除此之外,I-CBP112还能够以剂量依赖方式在体外和体内实验中显著抑制MLL-AF9+细胞的白血病诱发潜能。更为有趣的是,I-CBP112还会增加BET bromodomain抑制剂 JQ1以及阿霉素的细胞毒性。
6.Chem Biol:小分子抑制剂为癌症精准靶向提供新希望
doi:10.1016/j.chembiol.2015.10.003
癌细胞内携带的BRCA1以及BRCA2基因突变一直是癌症治疗的关键靶向目标,但是能够特异性杀死BRCA基因缺失细胞的药物少之又少,而既能杀死上述细胞又不会引起药物抵抗的药物几乎没有。最近来自美国天普大学的科学家表示他们发现了一种小分子药物能够通过阻断癌细胞内一条备用DNA损伤修复途径特异性杀死BRCA缺失癌细胞,这一发现或可帮助解决癌细胞特异性杀伤与药物抵抗问题。相关研究结果发表在国际学术期刊《Chemistry and Biology》上。
研究人员表示,在正常情况下BRCA蛋白能够促进DNA的同源重组损伤修复过程,而缺失BRCA的癌细胞会转而依赖于另外一条由RAD52蛋白介导的DNA损伤修复途径。在这项研究中,他们首次证明利用一种叫做6-OH-dopa的小分子选择性抑制RAD52可以在体外细胞模型中阻断BRCA缺失癌细胞的生长。
在这项研究中,研究人员对超过18,000中化合物进行了筛选,最终发现了这种叫做6-OH-dopa的小分子能够阻止RAD52与单链DNA结合。细胞实验证明6-OH-dopa对于RAD52的抑制作用具有特异性,它通过干扰RAD52的环状结构发挥抑制作用。用这种小分子处理BRCA缺失细胞会导致细胞生长和存活能力受到抑制,而BRCA功能正常的细胞不会受到影响。
研究人员表示发现6-OH-dopa不仅对乳腺癌和卵巢癌的治疗具有重要提示,肺癌,前列腺癌,胰腺癌甚至是白血病都可能出现BRCA缺失,也都可能成为6-OH-dopa的靶向治疗癌症类型。因此6-OH-dopa或可在将来作为癌症治疗的精准靶向药物得到进一步开发。
7.Cancer Cell:靶向BCL2利用小分子药物治肺癌
doi:10.1016/j.ccell.2015.04.010
 近日,来自美国埃默里大学的研究人员发现一种治疗肺癌的方法,他们利用小分子化合物诱导细胞凋亡从而达到治疗目的,这种小分子能够将BCL2从一个抗凋亡因子变为促凋亡因子,具有重大应用前景。
近日,来自美国埃默里大学的研究人员发现一种治疗肺癌的方法,他们利用小分子化合物诱导细胞凋亡从而达到治疗目的,这种小分子能够将BCL2从一个抗凋亡因子变为促凋亡因子,具有重大应用前景。
肺癌是美国癌症相关死亡的头号杀手,因肺癌死亡的人数比乳腺癌,前列腺癌和胰腺癌死亡人数的总和好要多。抗凋亡因子BCL-2家族成员表达上调以及促凋亡家族成员的表达紊乱导致人类肺癌发生化疗抵抗和放疗抵抗的重要因素,这表明BCL-2家族成员可能称为靶向治疗肺癌的关键作用靶点。
BCL-2的BH4结构域对于BCL-2发挥抗凋亡功能具有重要作用,在该项研究中,研究人员通过小分子筛选发现一个靶向BCL2-BH4结构域的拮抗小分子,BDA-366,它能够与BH4结构域结合,同时具有高度的亲和性和特异性。BDA-366与BCL-2结合能够诱导BCL-2发生构象改变,减弱BCL-2的抗凋亡功能,并将其从一个维持细胞存活的蛋白分子转变为一个细胞凋亡诱导因子。BDA-366能够抑制肺癌细胞系以及肺癌病人来源的畸胎瘤的生长,同时对正常组织没有明显的毒副作用。除此之外,研究人员还发现在肺癌细胞以及肺癌病人肿瘤组织中抑制mTOR能够诱导BCL-2表达;将BDA-366与RAD001联合使用治疗肺癌具有很强的协同性。
8.Mol Cancer Ther:治疗病毒性癌症的潜在小分子
doi:10.1158/1535-7163.MCT-13-0466
近日,Christopher Parsons博士等科学家发表研究报告称,发现了特定脂质分子--鞘脂,在病毒引起的侵袭性淋巴瘤生存中发挥关键作用。
新研究还揭示了用于防止淋巴瘤细胞生成鞘脂类的化合物,从而杀死这些细胞。这项研究发表在2014年1月Molecular Cancer Therapeutics杂志。
该研究团队专注于原发性渗出性淋巴瘤(PEL),PEL经常发生在HIV感染者中。虽然科学家们知道,卡波济肉瘤相关疱疹病毒(KSHV)导致PEL ,但一直没有有效的治疗方法。
在了解鞘氨醇激酶(SK)在用于保持PEL肿瘤细胞存活的生物活性鞘脂生成中的作用后,研究人员测试了一种新的临床级小分子,选择性靶向SK。
该分子称为ABC294640,由Apogee Biotechnology公司开发。以前研究发现ABC294640在肾癌,前列腺癌和乳腺癌细胞系中的抗肿瘤作用。在目前的研究中,ABC294640不仅抑制SK功能和诱导PEL细胞死亡,它还选择地作用于病毒感染的细胞,而保留未受感染的细胞。
9.Cancer Cell:科学家发现新型抗癌小分子
doi:10.1016/j.ccr.2013.12.009
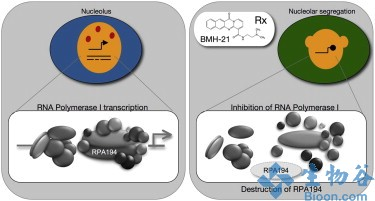 约翰霍普金斯大学科学家在培养细胞体系中发现一种小分子具有破坏癌细胞分裂,防止癌细胞生长的功能。相关报道发表在近期的Cancer Cell杂志上。
约翰霍普金斯大学科学家在培养细胞体系中发现一种小分子具有破坏癌细胞分裂,防止癌细胞生长的功能。相关报道发表在近期的Cancer Cell杂志上。
该研究是由Marikki Laiho博士领导的研究团队完成的。科学家发现小分子BMH-21能够破坏RNA聚合酶POL I转录通路,阻断癌细胞相互交流和复制。
Laiho博士称,他们在可能具有抗癌功能的小分子库中筛选到了BMH-21。接着科学家在国家癌症研究中心收集的9种类型癌症60株癌细胞系中研究了该小分子的功能,发现BMH-21能够结合到癌细胞的DNA上,完全阻断其转录通路。
由于转录机制在所有癌细胞类型中很普遍,所以科学家相信BMH-21有可能治疗多种类型癌症。但是Laiho博士也强调说还需要更多的实验才能证明BMH-21的临床有效性。
10.Nat Commun:分子建模设计出治疗前列腺癌的小分子
doi:10.1038/ncomms2912
德州大学达拉斯分校化学副教授Jung-Mo Ahn博士成功设计并合成出一种新型的小分子,有可能成为一个新型的武器对抗前列腺癌。研究论文发表在5月28日的Nature Communications杂志上,Ahn和得克萨斯大学西南医学中心同事在论文中描述了分子的合理设计,以及实验室测试表明其具有阻断促癌蛋白质雄激素受体功能的成效。
为了寻找新的方法来抗击前列腺癌,Ahn和他的同事关注于阻断雄激素受体上一个重要的结合点。当肿瘤努力成长时,这个位置的激活提供肿瘤所需物质,Ahn表示,雄激素受体表面上还有其他结合位点结合各自蛋白质后继续工作,我们试图只阻止一组有助于前列腺癌生长的受体-蛋白结合互动。
这就是为什么研究人员认为此做法可能会导致强有力的疗效,同时副作用较少。使用计算机辅助分子建模,Ahn设计了螺旋模仿的小分子,恰恰适合放入前列腺癌雄激素受体的口袋上。与泌尿学副教授博士Ganesh Raj合作,研究人员测试了化合物对动物和人体组织的作用。发现化合物没有表现出明显的毒性,能阻止雄激素受体招募其合作伙伴,并阻止前列腺癌细胞的生长。
研究已经表明,新设计出的分子与受体结合非常紧密,对雄激素受体具有很高的亲和力,分子在这些细胞中能抑制雄性激素的功能,有希望开发成药物。
11.Cell子刊:华人科学家发现抑制PD-L1的小分子抗癌药物
doi:10.1016/j.celrep.2016.08.032
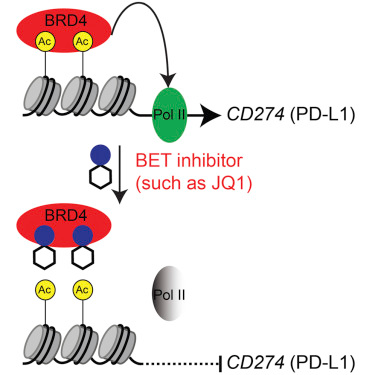 图片来源:Cell。
图片来源:Cell。
近日,来自美国费城Wistar研究所的科学家们发现了一系列称之为BET抑制剂的小分子药物,可以有效地抑制PD-L1的功能,对卵巢癌表现出了良好的抗癌作用。这一成果发表在了Cell子刊Cell Reports上,领导这项研究的是华人科学家张如刚教授。
PD-1/PD-L1信号通路是当下癌症治疗和研究领域最热门的话题之一。近两年获批上市的两种免疫疗法新药,默沙东的Keytruda和百时美施贵宝的Opdivo都瞄准了这一信号通路,使用单抗结合PD-1受体来阻止信号传递,从而激活机体自身的免疫系统对肿瘤展开攻击。这两种新药已经获批用于治疗黑色素瘤等癌症,同时在针对其他一些癌症的临床试验中也表现出了巨大的潜力。不过,这两种药物都有可能引起与免疫反应相关的副作用。而新发现的BET抑制剂有望在保持免疫系统对癌症攻击的同时,在身体其他部位不会引起强烈的免疫反应。
张如刚教授的研究团队在寻找抑制PD-1/PD-L1信号通路的小分子药物的过程中发现了一系列BET抑制剂具有这样的功能。他们使用了其中一种实验性药物JQ1,在卵巢癌的小鼠实验中,JQ1有效地降低了PD-L1的表达和信号传导,减慢了肿瘤生长速度,并延长了患病小鼠的寿命,同时还没有引起很强的炎症反应。JQ1并不需要直接与PD-L1或PD-1结合就能够起到抑制信号传递的作用,那么它是怎么做到这一点的呢?
进一步的研究发现,BET蛋白家族的成员之一BRD4对于PD-L1的表达起着重要的调节作用。BRD4被发现经常在卵巢癌细胞上大量表达,因此增加了PD-L1的表达量。作为BET抑制剂的JQ1抑制了BRD4的功能,从而达到了减少PD-L1的目的。研究人员认为,BRD4可以被用作判断卵巢癌患者是否适用BET抑制剂治疗的生物标记物,那些BRD4表达量高的患者会获得更好的疗效。(生物谷 Bioon.com)
扫描上面二维码在移动端打开阅读





