近日,华南理工大学医学院、生命科学研究院杨显珠教授及王均教授团队发展了一种“变身”式纳米策略,实现更精准、可控式抗肿瘤药物递送,研究成果发表在国际著名学术期刊 Nano Letters 上。
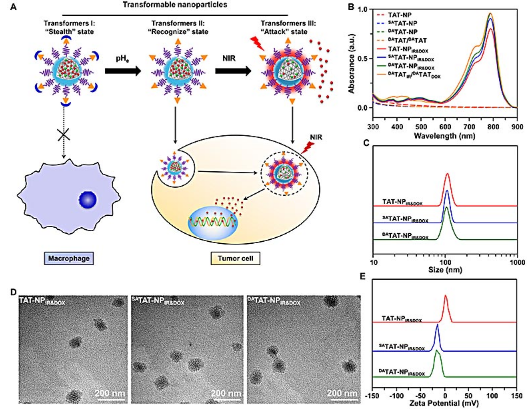
抗肿瘤纳米药物通过静脉给药后,将会与生物系统(如其中的蛋白、细胞、体液、组织和器官等)进行复杂相互作用(nano-bio 相互作用),这将极大程度地影响纳米药物的抗肿瘤效应。理想的抗肿瘤纳米材料进入机体后,能随着其所到达组织部位的不同有效地自我调控其与生物系统的相互作用;在血液循环过程中,纳米药物应尽可能避免或减少和巨噬细胞等吞噬细胞相互作用;而当其到达肿瘤组织时,纳米药物应能够增强与肿瘤细胞的相互作用;在肿瘤细胞内,纳米药物应能够快速释放出活性药物分子,以增强与药物靶标的相互作用。尽管这种设计原则获得研究人员的一致认可,但如何实现这一原则的纳米药物载体仍极具挑战。
杨显珠教授及王均教授团队利用肿瘤酸性微环境的特点以及近红外光调控的方法,发展了可“变身”式纳米载体,以调控纳米药物与生物系统的相互作用。该纳米体系由穿膜肽(TAT,“YGRKKRRQRRRC”)功能化的聚乙二醇—聚磷酸酯嵌段聚合物组装而成;其中 TAT 多肽赖氨酸的氨基被肿瘤酸度敏感的 2,3- 二甲基马来酸酐修饰,疏水内核同时包载化疗药物 DOX 和光热治疗试剂 IR-780,从而制备了 DATAT-NPIR&DOX。通过静脉给药后,DA 修饰的纳米体系 DATAT-NPIR&DOX 处于“隐形”状态,有效降低其与巨噬细胞等的相互作用,从而延长其在体内的循环时间;当纳米颗粒进入肿瘤组织后,TAT 被重新激活,纳米药物进入被“识别”状态(“recognize” state),增强与肿瘤细胞的相互作用,促进纳米颗粒被肿瘤细胞摄取;随后 IR-780 在近红外光照射下产生光热效应,驱动药物快速释放,纳米药物进入“攻击”状态(“attack” state)。这种肿瘤酸度 / 近红外光调控纳米药物与生物体相互作用的设计策略,有效提高了药物抗肿瘤的效果。
该研究获得国家重大科学研究计划、国家自然科学基金项目等的资助。
http://pubs.acs.org/doi/abs/10.1021/acs.nanolett.6b05396?journalCode=nalefd
扫描上面二维码在移动端打开阅读