这篇文章周一发表在自然纳米工程,作者来自FDA的药物评估与研究中心(CDER)的药物质量管理处。
这些FDA的官员分析了过去40年内的涉及纳米材料的新药研究和新药上市的注册趋势后发现,纳米材料提交的新药数量正在上升。
通过分析,作者表示,含纳米材料的研究性新药申请(IND),新药申请(NDAs)和仿制药申请(ANDAs)稳定增长,从1970年代初至80年代初期的寥寥无几到从过去十年的每年20个以上。
这是因为,纳米材料可以发挥多种作用,从作为活性药物成分(API,active pharmaceutical ingredient)到新颖的药物赋形剂和药物载体。
因此,纳米新药的崛起也十分令人期待。
根据作者,FDA药审中心共收到234份含有纳米材料的研究性新药产品,其中44(19%)个产品最终被FDA评审, 还有34份新药上市申请(NDA)最终被FDA批准,约占总数的15%。
这个比率与所有新药和生物制剂的上市申请在第一个周期的审批率相当,作者说。
由于含有纳米技术的新药与其他产品在同一起跑线上,在同样的标准下接受审批,因此这些数据表明,含有纳米材料的新药并不妨碍获得监管审评和批准。
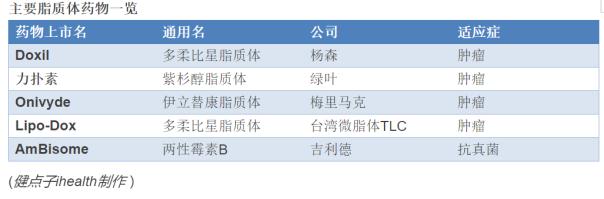
此外,伟脂体是迄今为止最常见的纳米材料类型,作为作为药物载体,脂质体占所有纳米材料的33-35%。
其次是纳米晶体,占20-29%。
为什么微脂体如此受欢迎?作者认为,“可能是因为这个(脂质体)平台的早期成功,其多功能性和一些原始的专利保护和/或营销排他性规定已经过期。”
这项FDA的研究发现,癌症是含纳米材料的最常见的治疗靶点,占含有脂质体的产品的61%。
考虑到纳米材料的独特之处,作者认为,纳米新药治疗治疗肿瘤有其优势。
“纳米材料能够延长循环时间,减少分泌和药物在非靶点组织的积累,并通过被动或主动靶向增加药物在肿瘤靶位点的定位,“作者写道。
原文链接:
http://www.raps.org/Regulatory-Focus/News/2017/04/27/27432/CDER-Officials-Nanomaterial-Submissions-on-the-Rise/
扫描上面二维码在移动端打开阅读