世界卫生组织将启动一项预认证试点,让在中低收入国家的患者能用上最昂贵的癌症疗法。
世界卫生组织(WHO)周四表示,今年将开启一项预认证,Pre-Qualification试点,针对两种抗肿瘤的生物类似药。
WHO计划在今年9月,邀请生物类似药生产药企,提交两种生物制品的生物仿制药生产资格:一个是利妥昔单抗, 主要治疗非霍奇金淋巴瘤和慢性淋巴细胞性白血病, 另一个是曲妥珠单抗,用于治疗乳腺癌。
利妥昔和曲妥珠单抗的原研厂家是瑞士药企罗氏,上市的产品名为美罗华(MabThera)和赫赛汀(Herceptin)。
美罗华和赫赛汀分列世界最畅销的十大生物药之列。2017年第一季度的销售额分别为1.9亿和1.7亿瑞士法郎。
其中,赫赛汀全球增长2%,主要受美国市场驱动。
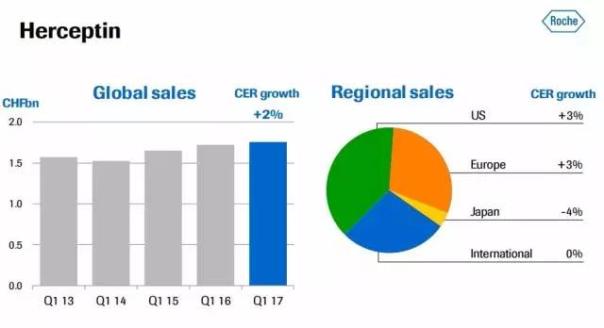
(赫赛汀2017一季度销售)
美罗华世界范围增长4%, 其中,美国市场增长6%。
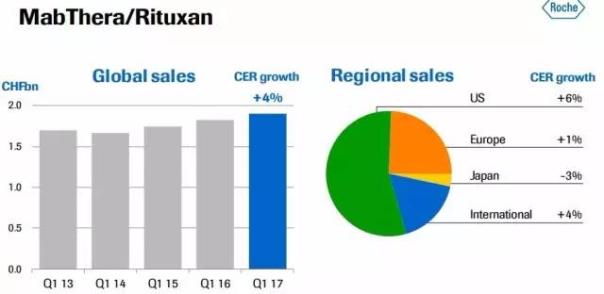
(美罗华2017一季度销售)
由于重磅生物治疗剂的专利过期,导致大批药企热捧生物类似药。安进公司(Amgen, 代码:AMGN)有9个生物类似药项目,其中有三个出于研发的后期阶段。包括:阿达木单抗,ABP215(贝伐珠单抗)和ABP980(曲妥珠单抗)。
韩国三星Bioepis,百健(Biogen)和三星的合资企业,目前有六个生物仿制药产品,包括曲妥珠单抗,阿达木单抗,贝伐珠单抗和甘精胰岛素,这是韩国药企中拥有的最大的生物仿制药研发管线。

国内药企中,苏州信达(Innovent Bio)也有利妥昔单抗的生物类似药产品IBI301,目前正在进行国内的三期临床试验。
全球来看,生物类似药的市场预计将达到550亿美元。
生物类似药为解决中低收入国家推广使用最昂贵的癌症疗法打开了一扇门。
“许多国家的创新生物治疗产品对于许多国家而言通常太贵, 因此生物仿制药是扩大治疗和支持国家监管以及使用这些药物的好机会。”世卫组织卫生系统与创新部门总干事Marie-Paule Kieny博士说。
这个月,世卫组织,国家监管机构,制药业集团,病人和民间社会团体,医保支付和决策者们在日内瓦举行的为期两天的会议,讨论如何增加获取生物治疗药物的途径。
像化学仿制药一样,生物仿制药可以帮助增加资源较少的国家获得治疗的机会,并为高收入国家卫生费用的升级提供解决方案,世界卫生组织说。
世卫组织的资格预认证(PreQ)制度可以增加竞争,进一步降低药品价格。
此外,世界卫生组织将修订2009年发布的“生物类似药评估指南”,以确保这个指南反映最近的证据和经验。
世卫组织说,下一步将计划研究胰岛素产品的预认证方案。
WHO新闻稿:
http://www.who.int/mediacentre/news/releases/2017/pilot-prequalification-biosimilars/en/
扫描上面二维码在移动端打开阅读





