致力于肿瘤精准药物开发的生物技术公司 Ignyta 近日宣布,FDA 授予其新药 entrectinib 突破性疗法认定,治疗 NTRK 基因融合阳性,局部晚期或转移性实体瘤成人和儿童患者,这些患者在接受现有疗法后疾病仍进展,或者没有标准疗法。Entrectinib 是一种新型的具有中枢神经活性的口服酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),靶向含有 NTRK1/2/3,ROS1 或 ALK 基因融合突变的肿瘤。
Entrectinib 是目前唯一临床证实具有活性、针对原发性和转移性中枢神经系统癌症的酪氨酸激酶抑制剂,并且没有不良脱靶效应。该候选药物正在进行 2 期临床试验 STARTRK-2。该试验是一个全球多中心、开放标签、注册相关的 2 期临床试验,使用精准医学的“篮子设计”(basket design),入组时会对肿瘤患者样本进行基因突变筛选,根据肿瘤类型和基因融合,患者将被分配到不同的“篮子”进行治疗。这种“篮子设计”可以纳入一系列不同的肿瘤类型,验证 entrectinib 针对分子靶标的临床效果。
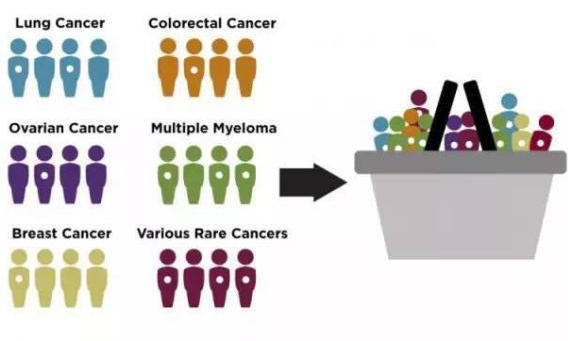
▲一些不同类型的肿瘤患者具有相同突变(图中白点表示),这些患者被分到相同的“篮子”测试同一种药物。(图片来源:Memorial Sloan Kettering Cancer Center)
Ignyta 公司主要研发精确靶向治疗药物,并且建立了分子诊断平台对药物进行伴随诊断测试,采用药物 / 伴随诊断战略发现癌症的分子驱动因素,迅速推进治疗药物开发。Ignyta 关注罕见癌症患者未满足的临床需求,在研管线包括 TRK,ROS1 和 ALK 抑制剂,RET 抑制剂等,这些突变发生在乳腺癌、胆管癌、结直肠癌、头颈部癌、淋巴瘤、黑色素瘤、神经内分泌肿瘤等实体瘤中。
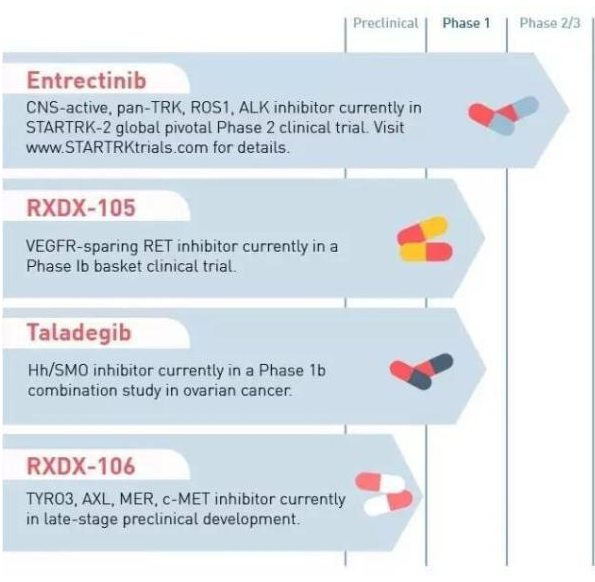
▲Ignyta 公司研发管线(图片来源:Ignyta 官网)
FDA 的突破性疗法认定(Breakthrough Therapy Designation,BTD)目的是加速治疗严重或危及生命的疾病的新药开发和审查时间。当初步临床证据表明某种药物在某些临床有意义的终点上比现有治疗有显著改善时,FDA 会授予 BTD 认定。
Ignyta 董事长兼首席执行官 Jonathan Lim 博士表示:“突破性疗法认定证明了 entrectinib 作为一种新型疗法,对于 TRK 阳性的多数肿瘤类型具有广泛治疗潜力,这些患者目前缺少治疗手段,存在明显的未满足临床需求。”
扫描上面二维码在移动端打开阅读





